Top Qs
Linha do tempo
Chat
Contexto
Caititu
espécie de mamífero Da Wikipédia, a enciclopédia livre
Remove ads
O caititu (nome científico: Pecari tajacu) também conhecido por caitatu, taititu, cateto, tateto, pecari, porco-do-mato[3] e patira, é um mamífero artiodáctilo, da família dos taiaçuídeos (Tayassuidae) e gênero Pecari.[4] Foi descrito por Lineu, em 1758, inicialmente no gênero Sus. De início, também foram descritas 14 subespécies, baseando-se em dados morfológicos. Entretanto, atuais estudos genéticos não corroboram isso, sugerindo a existência de apenas dois clados, um ocorrendo na América Central e América do Norte, e outro na América do Sul.
Quando adultos, medem de 75 a 100 centímetros de comprimento e aproximadamente 45 centímetros de altura. O peso varia de 14 a 30 quilos. A espécie apresenta uma cauda vestigial e um focinho alongado com disco móvel terminal, patas curtas e delgadas e pés pequenos proporcionalmente ao resto do corpo. As patas dianteiras possuem quatro dígitos, sendo dois destes funcionais e as traseiras possuem um dos dígitos não funcional. A espécie possui 38 dentes, sendo os caninos superiores os que mais se destacam. A pelagem é longa e áspera, geralmente de tonalidade cinza mesclada de preto, com uma faixa de pelos brancos ao redor do pescoço que dá o aspecto de um colar.
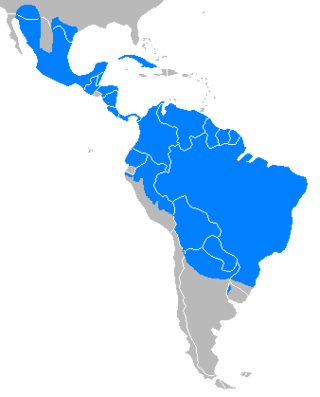
Atualmente, distribuem-se desde o sul dos Estados Unidos, passando por toda América Central e América do Sul a leste dos Andes, até o norte da Argentina. Em condições naturais, os hábitos alimentares dos caititus são determinados de acordo com a disponibilidade de alimento. Nas regiões áridas dos Estados Unidos, alimentam-se basicamente de plantas suculentas do gênero Opuntia, já na caatinga brasileira, um amplo bioma xerófito, sua alimentação se compõe de raízes, tubérculos e sementes, visto que a disponibilidade de frutos e folhas depende de um regime de chuvas que pode não existir durante os períodos de secas severas nessa região.
Remove ads
Etimologia e vernáculos
Caititu, caitatu, taititu, cateto e tateto (historicamente designado taiacetu (1610), tahitetu (1618), cahetatũs (1730), caitetú (1789), taitetu e caetetum (século XVIII)[5]) são provenientes do tupi kaiti'tu[3] ou taïte'tu/taytetú,[5][6] enquanto pecari advém do espanhol pecarí.[7] Em outras línguas indígenas há outros nomes vernáculos, a saber: *jamu (proto-aruaque[8]); hajere (proto-macu oriental[9]); *tohbẽt (cuazá[10]); *ɔɡcɑ (proto-jê meridional[11]); mōiamã (iranxe[12]); kitchóriorch (chiquitano[13]); *Daotsey (proto-tuparí[14]).
Remove ads
Taxonomia e evolução
Resumir
Perspectiva
O caititu foi descrito por Lineu, em 1758, inicialmente no gênero Sus.[15]
A espécie foi classificada na família dos dicotilídeos (Dicotylidae) por Jones et al. (1992) e então na família dos taiçuídeos (Tayassuidae) por Grubb (2005). O nome genérico apropriado tem sido debatido. Foi classificada no gênero Dicotyles por alguns autores, no gênero Pecari por Grubb (1993, 2005) e no gênero Tayassu por Jones et al. (1992). O gênero Dicotyles foi descrito em 1816 por Georges Cuvier.[4] Estudos genéticos não consideram apropriado que seja incluído no gênero Tayassu, junto com o queixada (Tayassu pecari),[16] e corrobora-se que faça parte do gênero à parte Pecari.[1] Tradicionalmente, também foram descritas 14 subespécies, baseando-se em dados morfológicos. Entretanto, atuais estudos genéticos não corroboram isso, sugerindo a existência de apenas dois clados, um ocorrendo na América Central e América do Norte, e outro na América do Sul:[16]
- P. t. tajacu Linnaeus,1758 - da bacia Amazônica à Argentina.
- P. t. angulatus Cope, 1889 - do sul dos Estados Unidos até o nordeste do México.
- P. t. bangsi Goldman, 1917 - do centro do Panamá até o noroeste da Colômbia.
- P. t. crassus Merriam, 1901 - centro-leste do México.
- P. t. crusnigrum Bangs, 1902 - Nicarágua até o oeste do Panamá.
- P. t. humeralis Merriam, 1901 - centro-oeste do México.
- P. t. nanus Merriam, 1901 - sudeste do México.
- P. t. nelsoni Goldman, 1926 - do sul do México até Belize e centro da Guatemala.
- P. t. niger Allen, 1913 - sudoeste da Colômbia e oeste do Equador.
- P. t. nigrescens Goldman, 1926 - sul da Guatemala, Honduras e El Salvador.
- P. t. patira Kerr, 1792 - norte da América do Sul (incluindo Trindade e Tobago).
- P. t. sonoriensis Mearns, 1897 - do sudoeste dos Estados Unidos até o oeste do México.
- P. t. torvus Bangs, 1898 - noroeste da América do Sul.
- P. t. yucatanensis Merriam, 1901 - do sudeste do México até o norte da Guatemala.
Pecari-gigante
O pecari-gigante (descrito como Pecari maximus) foi uma suposta quarta espécie dos taiaçuídeos, relatada pela primeira vez no Brasil em 2000 pelo naturalista holandês Marc van Roosmalen. Em 2003, o cineasta alemão de história natural Lothar Frenz filmou um grupo e coletou um crânio que mais tarde serviu como holótipo (INPA4272). O animal era conhecido localmente como caititu-mundé, que, segundo Roosmalen et al., os moradores afirmavam ser uma palavra tupi que significava “o queixada de colar que é maior e anda em pares”, em oposição a caititu-de-bando, “o caititu que anda em bandos”. Ele foi descrito formalmente em 2007,[17] mas as evidências científicas para seu status como espécie foram rapidamente questionadas.[18][19] Uma revisão em 2011 considerou o pecari-gigante como sinônimo do caititu (P. tajacu),[20] posição também adotada pela IUCN no mesmo ano.[1]
A distribuição relatada do pecari-gigante abrange a região centro-sul da Amazônia, entre os rios Madeira e Tapajós, além do norte da Bolívia.[21] Estaria restrito às florestas de terra firme, que são aquelas que não sofrem inundações sazonais. Diferente de outros caititus da região, o pecari-gigante foi relatado como ocorrendo principalmente em pares ou pequenos grupos familiares. De acordo com sua descrição original, é maior, tem pernas mais longas e cabeça proporcionalmente menor do que o único outro membro do gênero, o caititu.[17] Comparado à maioria dos indivíduos das populações simpátricas do caititu, o pecari-gigante também teria pelos mais ralos, em tons mesclados de marrom e branco, pernas mais negras e um colar relativamente tênue. Cinco peles do pecari-gigante mediam entre 120 e 137 centímetros de comprimento total, enquanto caçadores locais estimaram seu peso entre 40 e 50 quilos (88–110 libras). Com base em um estudo de mtDNA, estimou-se que os caititus e os pecaris-gigantes divergiram há 1,0 a 1,2 milhão de anos, mas esses resultados foram posteriormente questionados devido ao pequeno tamanho da amostra, baixo suporte estatístico e ausência de dados de DNA nuclear e citogenética.[18][1]
Em 2011, uma revisão observou que as medidas fornecidas na descrição inicial estavam dentro dos limites geralmente reconhecidos para o caititu, e que os comportamentos supostamente únicos do pecari-gigante também são conhecidos para o caititu.[20] A revisão também forneceu novas evidências genéticas mostrando que os caititus da América do Sul formam um clado monofilético que inclui o pecari-gigante (sem ele, o clado seria parafilético). Além disso, variações intraespecíficas extensas (tanto individuais quanto por localidade) são conhecidas na morfologia do caititu.[1]
Remove ads
Descrição
Resumir
Perspectiva

O caititu é chamado de porco-do-mato devido à sua aparente semelhança com os javalis (Sus scrofa). Entretanto, várias características anatômicas o tornam diferente, tais como: a presença de uma glândula odorífera na região dorsal e de uma cauda vestigial de 15 a 55 milímetros; o osso da perna fundido ao do pé, que resulta em três dígitos na pata posterior, o fígado reduzido, a ausência de vesícula biliar e a presença de um estômago compartimentalizado em estômago glandular, bolsa gástrica e dois sacos cegos (o saco cego cranioventral e saco cego caudodorsal).[22] A presença desse tipo de estômago permite que os caititus se alimentem de itens diversos, incluindo alimentos fibrosos, sobras de legumes, frutos e pequenos vertebrados.[23]
Dentre as três espécies de pecaris existentes, os caititus são os de menor porte. Quando adultos, medem de 75 a 100 centímetros de comprimento e aproximadamente 45 centímetros de altura. O peso varia de 14 a 30 quilos.[24] A espécie apresenta uma cauda vestigial e um focinho alongado com disco móvel terminal, patas curtas e delgadas e pés pequenos proporcionalmente ao resto do corpo. As patas dianteiras possuem quatro dígitos, sendo dois destes funcionais e as traseiras possuem um dos dígitos não funcional. A espécie tem a fórmula dentária 2/3,1/1,3/3,3/3[25] e possui 38 dentes, sendo os caninos superiores os que mais se destacam. Diferentemente dos porcos verdadeiros, seus caninos são relativamente pequenos e com o crescimento reto e para baixo. Possuem o comportamento de bater os dentes como mecanismo de defesa quando se sentem ameaçados.[26]
A pelagem é longa e áspera, geralmente de tonalidade cinza mesclada de preto, com uma faixa de pelos brancos ao redor do pescoço que dá o aspecto de um colar. Na região dorsal possuem uma crina de pelos mais longos e escuros, que eriçam em situações de estresse ou quando demonstram comportamentos de ameaça. Não existe dimorfismo sexual nessa espécie. No entanto, é possível visualizar o escroto dos machos a curtas distâncias. A glândula dorsal se localiza de 15 a 20 centímetros na região anterior a base da cauda[27] e tem como função a marcação territorial e social.[22][28]
Remove ads
Hábitos
Resumir
Perspectiva


Em condições naturais, os hábitos alimentares dos caititus são determinados de acordo com a disponibilidade de alimento.[22] Nas regiões áridas dos Estados Unidos, alimentam-se basicamente de plantas suculentas do gênero Opuntia,[29] já na caatinga brasileira, um amplo bioma xerófito,[30] sua alimentação se compõe de raízes, tubérculos e sementes, visto que a disponibilidade de frutos e folhas depende de um regime de chuvas que pode não existir durante os períodos de secas severas nessa região. Nas florestas tropicais são essencialmente frugívoros,[31][32] sua alimentação principal são frutos, folhas, raízes e tubérculos,[22] mas podem, eventualmente, consumir larvas, insetos, anfíbios, répteis, entre outros, como fonte de proteína.[24][26] Em partes de sua área de distribuição, desenvolveram uma relação comensal com quatis (Nasua nasua) e bugios-pretos (Alouatta caraya) durante o forrageamento, ao consumirem frutos de palmeiras derrubados por essas espécies.[2]
Os caititus costumam permanecer no mesmo bando onde nasceram durante toda a vida, o que é incomum entre os ungulados. Estudos genéticos indicam um sistema reprodutivo promíscuo, sem monopólio de reprodução por machos ou fêmeas, possivelmente associado ao monomorfismo da espécie. A gestação dura cerca de 144 a 148 dias, com o nascimento de, em média, dois filhotes. Esses filhotes apresentam coloração avermelhada ao nascer, substituída por pelos definitivos no terceiro mês. A espécie apresenta maior taxa de ovulação e tamanho de ninhada em comparação aos queixadas. Estudos na Amazônia peruana apontam cerca de 1,12 nascimentos por ano, com média de 1,98 filhotes por fêmea gestante e perda reprodutiva de aproximadamente 21,3%. A migração embrionária foi observada em cerca de 32% das fêmeas grávidas.[2] Dormem em tocas, muitas vezes sob as raízes de árvores, mas às vezes podem ser encontrados em cavernas ou sob troncos. Embora geralmente ignorem os humanos, reagem se se sentirem ameaçados, defendendo-se com suas presas. Um caititu pode liberar um almíscar forte ou dar um latido agudo se estiver alarmado.[33]
Os caititus são considerados forrageadores diurnos. Durante a forragem, os bandos se dividem em sub-bandos que permanecem separados por distâncias de 20 a 1000 metros, dificultando a contagem exata do tamanho dos grupos. São forrageadores diurnos que ajustam sua atividade conforme a temperatura. No norte do Pantanal, preferem temperaturas entre 20 e 30°C, evitando calor elevado. Na cheia, com temperaturas mais amenas e acesso livre à água, concentram suas atividades nas manhãs, quase sem registros noturnos. No período seco, com temperaturas diurnas acima de 40°C, tornam-se crepusculares e noturnos, padrão semelhante ao do sul do Pantanal e Mata Atlântica. Contudo, no sul do Pantanal, mantêm atividade crepuscular-noturna tanto na cheia quanto na seca.[2]
Remove ads
Habitat
Resumir
Perspectiva
Atualmente, os pecaris distribuem-se desde o sul dos Estados Unidos, passando por toda América Central e América do Sul a leste dos Andes, até o norte da Argentina,[a] e são avistados do nível do mar a três mil metros de altitude.[2] Esses animais habitam uma grande variedade de ambientes, como áreas semiáridas e campos abertos do Arizona e Texas, nos Estados Unidos; florestas tropicais e semitropicais, no Brasil; e o chaco paraguaio.[34] Apesar dessa ampla distribuição, os caititus não habitam áreas de altitudes elevadas.[22] No Brasil, é amplamente distribuído e resistente a mudanças causadas pelo homem, exceto em ambientes muito degradados. Está presente em áreas com cobertura vegetal em todos os biomas, correspondendo a cerca de 12% da Mata Atlântica, 50% do Cerrado, 30% da Caatinga, e 80% da Amazônia e Pantanal. Registros recentes mostram sua presença fora de unidades de conservação no cerrado mineiro, mas a espécie está extinta desde 2006 no Centro de Endemismo Pernambuco (CEP). Como especialista de florestas que depende de frutas nativas, a perda da cobertura vegetal impacta sua distribuição.[2]
A unidade social dos caititus varia consideravelmente em tamanho, mas eles tendem a formar na natureza grupos sociais coesos e estáveis,[28][35][36] de cinco a 15 indivíduos de diferentes faixas etárias, com um ou mais machos e várias fêmeas adultas.[22][37] Em três anos de monitoramento com armadilhas fotográficas na [[Reserva Particular do Patrimônio Natural Sesc Pantanal (RPPN Sesc Pantanal), em Barão de Melgaço, registrou-se que a maioria dos bandos continha de cinco a 10 indivíduos, sendo raros os grupos com mais de 15. No Pantanal da Nhecolândia, os grupos também variam entre cinco e 10 membros.[2] Existe a hipótese de que os caititus foram selecionados para viver em grupos, como uma estratégia para defesa conjunta contra os predadores, já que são presas de grandes carnívoros como as onça-pardas (Puma concolor) e coiotes (Canis latrans) na América do Norte[24] e de onças-pintadas (Panthera onca), pardas e, ocasionalmente, de jacarés no Brasil. Em determinadas épocas do ano, ocorre a formação de grandes agrupamentos com mais de 50 animais, pela fusão de dois ou mais grupos.[38] É possível que esses agrupamentos aconteçam como uma resposta dos pecaris às condições de forrageamento ou aos maiores riscos de predação.[37]
SOWLS (1984) registrou que os grupos de caititus vivem em áreas de vida de 50 a 800 hectares nos Estados Unidos e, em regiões tropicais, a área varia de 143 a 685 hectares. Sabe-se que essas áreas de vida são territorialmente estáveis ao longo do tempo. Dentro dos limites de área de vida, os indivíduos do bando, caminham, alimentam-se e descansam, juntos.[38][39] Os grupos defendem ativamente o território, que consiste de uma zona central, que é usada exclusivamente pelos membros do bando, e as áreas de borda, que são usadas por membros de grupos adjacentes. Não existem interações entre os bandos, mas, ocasionalmente, alguns indivíduos podem mudar de bando e não retornar ao seu grupo original.[28][35]
A glândula odorífera presente nesses animais produz uma substância oleaginosa de forte odor, que é utilizada em contextos sociais e não-sociais, como, por exemplo, quando é esfregada em árvores e outros objetos para a marcação territorial. Armadilhas fotográficas na Mata Atlântica registraram oito comportamentos relacionamentos à marcação (esfregar a glândula ou o flanco no chão ou objetos, eriçar e chacoalhar as cerdas dorsais, patear o solo com a pata anterior e defecar) e reconhecimento olfativo (cheirar o chão ou objetos marcados e friccionar as cabeças mutuamente na região da glândula dorsal).[2] Os grupos de caititus se mantêm coesos através dessas marcações nos indivíduos, pois têm pouca orientação visual, mas o olfato bastante desenvolvido.[26] Através dos comportamentos de esfregamento, recíproco e não-recíproco, os animais esfregam suas glândulas de cheiro uns nos outros, possibilitando aos indivíduos reconhecerem a identidade dos membros do grupo, mantendo, dessa forma, a integridade do bando.[22][40][41]
Remove ads
Conservação
Resumir
Perspectiva

O caititu desempenha um papel ecológico relevante como predadora e dispersora de sementes, contribuindo à regeneração e manutenção dos ecossistemas. Segundo Mazzolli (2006), tanto caititus quanto queixadas são considerados bioindicadores da qualidade ambiental: enquanto a presença de queixadas sugere habitats bem preservados, a tolerância dos caititus a ambientes alterados faz com que sua ausência indique um elevado grau de degradação do habitat. No Brasil, a espécie sofre forte pressão da caça, tanto para subsistência quanto para comércio, devido à valorização de sua carne e couro. A caça é indiscriminada e afeta todas as idades e sexos, o que provoca a separação de filhotes e morte de fêmeas em lactação. Também são registrados casos de óbito por retaliação devido a prejuízos em roçados. A degradação ambiental decorrente da expansão urbana (mineração, produção de carvão, monoculturas), obras de infraestrutura (como a construção de usinas hidrelétricas), incêndios e mudanças na legislação ambiental agravam a situação, em especial no arco do desmatamento da Amazônia. No Pantanal, o avanço das atividades agropastoris, com queimadas descontroladas, substituição da vegetação nativa por gramíneas exóticas, desmatamento e superlotação dos rebanhos impacta todas as espécies frugívoras e herbívoras, que tendem a evitar essas áreas. No Nordeste, a Caatinga vem gradualmente sendo degradada pela instalação ilegal de torres para parques eólicos, cultivo de mamona e pinhão-manso para biocombustíveis, expansão de plantações de sisal, pastagens e roças e criação extensiva de caprinos, ovinos e bovinos. Em áreas do Cerrado, caititus são abatidos por conflitos com agricultores e pela caça esportiva. A introdução de espécies exóticas, como o javali (Sus scrofa), causa disputa territorial interespecífica e potencial transmissão de doenças infecciosas às populações nativas.[2]

A União Internacional para a Conservação da Natureza (UICN / IUCN), em sua Lista Vermelha, classificou o caititu como pouco preocupante devido à sua ampla distribuição geográfica e porque a espécie está populacionalmente estável.[1] Também consta no apêndice II da Convenção sobre o Comércio Internacional das Espécies da Fauna e da Flora Silvestres Ameaçadas de Extinção (CITES).[2][42] No Brasil, em 2005, foi listada como vulnerável na Lista de Espécies da Fauna Ameaçadas do Espírito Santo;[43] em 2010, como vulnerável no Livro Vermelho da Fauna Ameaçada no Estado do Paraná[44] e na Lista de Espécies Ameaçadas de Extinção da Fauna do Estado de Minas Gerais;[45] em 2011, como vulnerável na Lista das Espécies da Fauna Ameaçada de Extinção em Santa Catarina;[46] em 2014, sob a rubrica de "dados insuficientes" na Lista das Espécies da Fauna Ameaçadas de Extinção no Rio Grande do Sul[47][48] e como quase ameaçada no Livro Vermelho da Fauna Ameaçada de Extinção no Estado de São Paulo;[49] em 2018, como pouco preocupante na Lista Vermelha do Livro Vermelho da Fauna Brasileira Ameaçada de Extinção do Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio)[50][51] e vulnerável na Lista das Espécies da Fauna Ameaçadas de Extinção no Estado do Rio de Janeiro;[52] e em 2022, como em perigo (EN) na Lista Vermelha de Espécies Ameaçadas da Fauna do Ceará.[53]
Áreas de conservação
No Brasil, o caititu está presente em várias áreas de conservação:[2]
- Reservas Biológicas (REBIO)
- Abufari
- Araucárias
- Augusto Ruschi
- Poço das Antas
- Sooretama
- Una
- Córrego Grande
- Gurupi
- Lago Piratuba
- Tapirapé
- Uatumã
- União
- Reservas Extrativistas (RESEX)
- Arapixi
- Baixo Juruá
- Cazumbá-Iracema
- Chico Mendes
- Lago do Capanã Grande
- Médio Juruá
- Médio Purus
- Rio Cajari
- Rio Ouro Preto
- Riozinho da Liberdade
- Reservas Particulares do Patrimônio Natural (RPPN)
- Sapucaia e
- Juerana
- Boa União
- Estância Caiman
- Estância Ecológica Sesc - Pantanal
- Fazenda Figueira
- Reserva Capitão
- Reserva Natural Engenheiro Eliezer
- Rio Capitão
- Santuário Caraça
- Áreas de Proteção Ambiental (APA)
- Campos do Jordão
- Serra do Mar
- Baía de Camamu
- Costa de Itacaré/Serra Grande
- Bacia do Rio Macacu
- Chapada dos Guimarães
- João Leite
- Lagoa Encantada
- Municipal do Capivari-Monos
- Sul-RMBH
- Triunfo do Xingu
- Áreas de Relevante Interesse Ecológico (ARIE)
- Japiim
- Estações Ecológicas (ESEC)
- Parques Estaduais (PE)
- Altamiro de Moura Pacheco
- Carlos Botelho
- Chandless
- Ilha do Cardoso
- Serra do Conduru
- Serra do Mar
- Serra dos Montes Altos
- Serra do Tabuleiro
- Campos do Jordão
- Jurupará
- Morro do Diabo
- Rio Doce
- Turvo
- Restinga de Bertioga
- Alto do Ribeira
- Reservas de Desenvolvimento Sustentável (RDS)
- Amanã
- Igapó-Açu
- Uacarí
- Recanto das Antas
- Leão da Montanha
- Territórios Indígenas (TI)
- Awa
- Barra Velha
- Coroa Vermelha - Gleba C
- Paumari do Cuniua
- Paumari do Lago Manissuã
- Paumari do Lago Paricá
- Perigara
- Tupinambá de Olivença
- Waiãpi
- Zoró
Remove ads
Notas
- [a] ^ No Brasil, em especial, ocorre nos estados do Acre, Amapá, Amazonas, Bahia, Distrito Federal, Espírito Santo, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Paraná, Pará, Piauí, Rio Grande do Sul, Rio de Janeiro, Rondônia, Roraima, Santa Catarina, São Paulo e Tocantins, nos biomas da Amazônia, Caatinga, Cerrado, Mata Atlântica e Pantanal. Em termos hidrográficos, está presente nas sub-bacias do Araguaia, do Contas, do Doce, da foz do Amazonas, do Grande, do Guaíba, do Gurupi, do Iguaçu, do rio Itapecuru-Paraguaçu, do Jequitinhonha, do litoral do Amapá, Bahia, Espírito Santo, Rio de Janeiro, São Paulo, Paraná e Santa Catarina, do Madeira, do Mearim, do Negro, do Paraguai 01, 02 e 03, do Paranapanema, do Paranaíba, do Paraná RH1, do Paraíba do Sul, do Alto, Médio e Baixo Parnaíba, do Purus, do Solimões, do Alto, Médio e Submédio São Francisco, do Tapajós, do Tietê, do Alto e Baixo Tocantins, do Trombetas, do Alto e Médio Uruguai e do Xingu.[2]
Remove ads
Referências
- Gongora, J.; Reyna-Hurtado, R.; Beck, H.; Taber, A.; Altrichter, M.; Keuroghlian, A. (2011). «Collared Peccary - Pecari tajacu». União Internacional para Conservação da Natureza (UICN). Lista Vermelha da IUCN. 2011: e.T41777A10562361. doi:10.2305/IUCN.UK.2011-2.RLTS.T41777A10562361.en
 . Consultado em 25 de julho de 2021
. Consultado em 25 de julho de 2021 - Keuroghlian, Alexine; Beisiegel, Beatriz de Mello; Antunes, Andre; Gatti, Andressa; Pontes, Antônio Rossano Mendes; Costa, Hugo Cardoso de Moura; Jorge, Maria Luisa da Silva Pinto; Landis, Mariana; Galetti, Mauro (2023). «Pecari tajacu (Linnaeus, 1758)». Sistema de Avaliação do Risco de Extinção da Biodiversidade (SALVE), Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio). doi:10.37002/salve.ficha.9807.2. Consultado em 27 de maio de 2025. Cópia arquivada em 3 de maio de 2025
- Ferreira, A. B. H (1986). Novo Dicionário da Língua Portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 314
- Acosta, Luis E.; Garbino, Guilherme S. T.; Gasparini, Germán M.; Dutra, Rodrigo Parisi (9 de setembro de 2020). «Unraveling the nomenclatural puzzle of the collared and white-lipped peccaries (Mammalia, Cetartiodactyla, Tayassuidae)». Zootaxa (1): 60–80. ISSN 1175-5334. doi:10.11646/zootaxa.4851.1.2. Consultado em 10 de setembro de 2020
- Grande Dicionário Houaiss, verbete Caititu
- «Caititu». Michaelis. Consultado em 25 de julho de 2021. Cópia arquivada em 26 de julho de 2021
- «Pecari». Michaelis. Consultado em 25 de julho de 2021. Cópia arquivada em 26 de julho de 2021
- Jolkesky, Marcelo Pinho de Valhery (2016). Estudo arqueo-ecolinguístico das terras tropicais sul-americanas (PDF). Brasília: Universidade de Brasília. Cópia arquivada (PDF) em 23 de fevereiro de 2025
- Martins, Valteir (2005). Reconstrução Fonológica do Protomaku Oriental. Col: LOT Dissertation Series. 104. Utreque: Escola Nacional de Pós-Graduação em Linguística, Universidade Livre de Amesterdã
- Manso, Laura Vicuña Pereira (2013). Dicionário da língua Kwazá. Guajará-Mirim: Universidade Federal de Rondônia
- Jolkesky, Marcelo Pinho De Valhery (2010). Reconstrução fonológica e lexical do Proto-Jê Meridional (PDF). Campinas: Universidade Estadual de Campinas, Instituto de Estudos da Linguagem. Cópia arquivada (PDF) em 1 de abril de 2022
- Pereira, Adalberto Holanda (1964). «Vocabulário da língua dos índios Irántxe» (PDF). Revista de Antropologia. 12 (1-2): 105-115. Cópia arquivada (PDF) em 25 de outubro de 2021
- Santana, Áurea Cavalcante (2012). Línguas cruzadas, histórias que se mesclam: ações de documentação, valorização e fortalecimento da língua Chiquitano no Brasil (PDF). Goiânia: Universidade Federal de Goiás. Cópia arquivada em 29 de julho de 2024
- Moore, D.; Vilacy Galucio, A. (1994). «Reconstruction of Proto-Tupari consonants and vowels». In: Langdon, M. Survey of California and Other Indian Languages, Report 8. Columbus: Universidade Estadual de Oio. pp. 119–30
- Grubb, P. (2005). «Pecari tajacu». In: Wilson, D. E.; Reeder, D. M. (eds.). Mammal Species of the World 3.ª ed. Baltimore, Marilândia: Imprensa da Universidade Johns Hopkins. p. 644. ISBN 978-0-8018-8221-0. OCLC 62265494
- Taber, A.B.; Altrichler, M.; Beck, H.; Gongora, J. (2011). «Family Tayassuidae (Peccaries)». In: Wilson, D. E.; Mittermeier, R. A. Handbook of the Mammals of the World - Volume 2: Hoofed Mammals. Barcelona: Lynx Edicions. pp. 308–320. ISBN 978-84-96553-77-4
- van Roosmalen, Marc G. M.; Frenz, Lothar; van Hooft, Wil H. F.; de Iongh, Hans H.; Leirs, Herwig (2007). «A New Species of Living Peccary (Mammalia: Tayassuidae) from the Brazilian Amazon» (PDF). Bonner zoologische Beiträge. 55 (2): 105–112. Consultado em 27 de maio de 2025
- Gongora, Jorge; Taber, Andrew; Keuroghlian, Alexine; Altrichter, Maxi; Bodmer, Richard E.; Mayor, Patricia; Moran, Clare; Damayanti, Christine S.; González, Sandra (2007). «Re-examining the evidence for a 'new' peccary species, Pecari maximus, from the Brazilian Amazon» (PDF). Newsletter of the Pigs, Peccaries, and Hippos Specialist Group of the IUCN/SSC. 7 (2): 19–26. Consultado em 27 de maio de 2025. Cópia arquivada (PDF) em 22 de março de 2024
- Hammer, Joshua (fevereiro de 2008). «Trials of a Primatologist». Smithsonian Magazine. Consultado em 27 de maio de 2025. Cópia arquivada em 14 de outubro de 2009
- Gongora, Jorge; Biondo, Camila; Cooper, Jonathan D.; Taber, Andrew; Keuroghlian, Alexine; Altrichter, Maxi; Ferreira do Nascimento, Fernanda; Chong, Adrian Y.; Miyaki, Cristina Y.; Bodmer, Richard; Mayor, Patricia; González, Sandra (2011). «Revisiting the species status of Pecari maximus van Roosmalen et al., 2007 (Mammalia) from the Brazilian Amazon» (PDF). Bonn Zoological Bulletin. 60 (1): 95–101. Consultado em 27 de maio de 2025. Cópia arquivada (PDF) em 15 de maio de 2024
- Moravec, Jiří; Böhme, Wolfgang (2009). «Second Find of the Recently Discovered Amazonian Giant Peccary, Pecari maximus (Mammalia: Tayassuidae) van Roosmalen et al., 2007: First Record from Bolivia» (PDF). Bonner zoologische Beiträge. 56 (1-2): 49-54. Consultado em 27 de maio de 2025. Cópia arquivada (PDF) em 19 de novembro de 2014
- Sowls, L. K. (1997). Javelinas and other peccaries: Their biology, management and use 2.ª ed. Austin: Imprensa da Universidade do Texas
- Deustch, L. A.; Puglia, L. R. P. (1988). Os Animais Silvestres: Proteção, Doenças e Manejo. Rio de Janeiro: Globo
- Mayer, J. J.; Brandt, P. N. (1982). «Identity, distribution, and natural history of the peccaries, Tayassuidae». In: Mares, M. A.; Genoways, H. H. Mammalian biology in South America. 6. Pitsburgo: Universidade de Pitsburgo. pp. 85–93
- Reid, Fiona (2006). Peterson Field Guide: Mammals of North America 4.ª ed. Nova Iorque: Houghton Mifflin Company. p. 158. ISBN 978-0-395-93596-5
- Nowak, R. M.; Paradiso, J. L. (1983). Walkers’ Mammals of the World. 4.ª. Baltimore, Marilândia; Londres, Reino Unido: Imprensa da Universidade Johns
- Wilber, J. P.; Hannon, P. G.; Grant, W. E. (1991). «Effects of seasonally varying diet quality on collared peccary population dynamics - a simulation study». Ecol. Model. 53: 109-129
- Schweinsburg, R. E. (1971). «Home range movements and herd integrity of the collared peccary (Tayassu tajacu)». Journal of Wildlife Management. 35: 455-460
- Corn, J. L.; Warren, R. J. (1985). «Seasonal food habits of the Collared Peccary in South Texas». Journal of Mammalogy. 66 (1): 155-159
- Reis, A. C. (1976). «Clima da Caatinga». Anais da Academia Brasileira de Ciências. 48: 325-335
- Olmos, F. (1993). «Diet of sympatric Brazilian caatinga peccaries (Tayassu tajacu and T. pecari)». Journal of Tropical Ecology. 9: 255-258
- Judas, J. (1999). Écologie du Pécari à collier Tayassu tajacu en forêt tropicale humide de Guyane française. Tours: Universidade de Tours
- Reid, Fiona (2006). Peterson Field Guide: Mammals of North America 4.ª ed. Nova Iorque: Houghton Mifflin Company. p. 488. ISBN 978-0-395-93596-5
- Eisenberg, J. F.; Redford, K. H. (1999). Mammals of the neotropics, the central neotropics. 3. Chicago: Universidade de Chicago
- Ellisor, J. E.; Harwell, W. F. (1969). «Mobility and home range of collared peccary in southern Texas». Journal of Wild Life Management. 33: 425-427
- Byers, J. A.; Bekoff, M. (1981). «Social, spacing and cooperative behavior of collared peccary». Journal of Mammalogy. 62 (4): 767-785. Cópia arquivada em 4 de novembro de 2020
- Robinson, J. G.; Eisenberg, J. F. (1985). «Group size and foraging habits of the collared peccary Tayassu tajacu». Journal of Mammalogy. 66: 153-159
- Green, G. E.; Grant, W. E.; Davis, E. (1984). «Variability of observed group sizes within collared peccary herds». Journal of Wild Life Management. 48 (1): 244-248
- Byers, J. A. (1983). «Social interactions of juvenile collared peccaries, Tayassu tajacu (Mammalia: Artiodactyla)». Londres. Journal o f Zoology. 201: 83-96
- Schweinsburg, R. E.; Sowls, L. K. (1972). «Aggressive behavior and related phenomena in the collared peccary». Zeit Tierpsychology. 30: 132-145
- Diaz, G. A. C. (1978). «Social behavior of the collared peccary in captivity». Tegucigalpa, Honduras: Departamento de Vida Silvestre e Recursos Ambientais, Escola Agrícola Panamericana. CEIBA. 22: 75-125. Cópia arquivada em 15 de agosto de 2021
- «CITES listings». Consultado em 13 de abril de 2023. Cópia arquivada em 15 de março de 2023
- «Lista de Espécies da Fauna Ameaçadas do Espírito Santo». Instituto de Meio Ambiente e Recursos Hídricos (IEMA), Governo do Estado do Espírito Santo. Consultado em 7 de julho de 2022. Cópia arquivada em 24 de junho de 2022
- Livro Vermelho da Fauna Ameaçada. Curitiba: Governo do Estado do Paraná, Secretaria do Meio Ambiente e Recursos Hídricos do Paraná. 2010. Consultado em 2 de abril de 2022
- «Lista de Espécies Ameaçadas de Extinção da Fauna do Estado de Minas Gerais» (PDF). Conselho Estadual de Política Ambiental - COPAM. 30 de abril de 2010. Consultado em 2 de abril de 2022. Cópia arquivada (PDF) em 21 de janeiro de 2022
- Lista das Espécies da Fauna Ameaçada de Extinção em Santa Catarina - Relatório Técnico Final. Florianópolis: Governo do Estado de Santa Catarina, Secretaria de Estado do Desenvolvimento Econômico Sustentável, Fundação do Meio Ambiente (FATMA). 2010
- de Marques, Ana Alice Biedzicki; Fontana, Carla Suertegaray; Vélez, Eduardo; Bencke, Glayson Ariel; Schneider, Maurício; Reis, Roberto Esser dos (2002). Lista de Espécies da Fauna Ameaçadas de Extinção no Rio Grande do Sul - Decreto Nº 41.672, de 11 de junho de 2002 (PDF). Porto Alegre: Museu de Ciências e Tecnologia da Pontifícia Universidade Católica do Rio Grande do Sul; PANGEA - Associação Ambientalista Internacional; Fundação Zoo-Botânica do Rio Grande do Sul; Secretaria Estadual do Meio Ambiente (SEMA); Governo do Rio Grande do Sul. Consultado em 2 de abril de 2022. Cópia arquivada (PDF) em 31 de janeiro de 2022
- «Decreto N.º 51.797, de 8 de setembro de 2014» (PDF). Porto Alegre: Estado do Rio Grande do Sul Assembleia Legislativa Gabinete de Consultoria Legislativa. 2014. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 16 de março de 2022
- Bressan, Paulo Magalhães; Kierulff, Maria Cecília Martins; Sugleda, Angélica Midori (2009). Fauna Ameaçada de Extinção no Estado de São Paulo - Vertebrados (PDF). São Paulo: Governo do Estado de São Paulo, Secretaria de Infraestrutura e Meio Ambiente do Estado de São Paulo (SIMA - SP), Fundação Parque Zoológico de São Paulo. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 25 de janeiro de 2022
- «Livro Vermelho da Fauna Brasileira Ameaçada de Extinção» (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 2018. Consultado em 3 de maio de 2022. Cópia arquivada (PDF) em 3 de maio de 2018
- «Pecari tajacu (Linnaeus, 1758)». Sistema de Informação sobre a Biodiversidade Brasileira (SiBBr). Consultado em 17 de abril de 2022. Cópia arquivada em 9 de julho de 2022
- «Texto publicado no Diário Oficial do Estado do Rio de Janeiro contendo a listagem das 257 espécies» (PDF). Rio de Janeiro: Governo do Estado do Rio de Janeiro. 2018. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 2 de maio de 2022
- «Lista Vermelha de Espécies Ameaçadas da Fauna do Ceará». Governo do Estado do Ceará, Secretaria do Meio Ambiente e Mudança do Clima (SEMA). Consultado em 14 de junho de 2025. Cópia arquivada em 16 de fevereiro de 2025: Mamíferos continentais; Anfíbios e Répteis; Aves; Mamíferos marinhos; e Tartarugas marinhas
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads