Top Qs
Linha do tempo
Chat
Contexto
Tubarão-galha-preta
Espécie de peixe Da Wikipédia, a enciclopédia livre
Remove ads
O tubarão-galha-preta[3] (nome científico: Carcharhinus limbatus), também conhecido popularmente como cação-de-fundo, cação-galha-preta, cação-peru, cação-ponta-preta, cação-sicuri, corta-garoupa, galha-preta, machote, serra-garoupa, sicuri e sicuri-de-galha-preta,[4] é uma espécie de peixe carcarriniforme, pertencente à família dos carcarrinídeos (Carcharhinidae). É comum em águas costeiras tropicais e subtropicais do Atlântico, Pacífico e Índico, inclusive em habitats salobros. Análises genéticas revelaram variações significativas dentro dessa espécie, com populações do Atlântico Ocidental isoladas e distintas das do restante de sua distribuição. O tubarão-galha-preta possui um corpo robusto e fusiforme, com um focinho pontudo, longas fendas branquiais e sem crista entre as nadadeiras dorsais. A maioria dos indivíduos apresenta pontas ou bordas pretas nas peitorais, dorsais, pélvicas e caudais. Normalmente atinge um comprimento de 1,5 metro (4,9 pés).
Rápidos e enérgicos piscívoros, os tubarões-galha-preta são conhecidos por darem saltos giratórios fora d'água ao atacar cardumes de peixes pequenos. Seu comportamento é descrito como "tímido" em comparação com outros grandes tubarões. Tanto os juvenis quanto os adultos formam grupos de tamanhos variados. Como outros membros de sua família, o tubarão-galha-preta é vivíparo; as fêmeas dão à luz de um a dez filhotes a cada dois anos. Os jovens passam os primeiros meses de vida em criadouros rasos, e as fêmeas adultas retornam a esses locais onde nasceram para parir. Na ausência de machos, as fêmeas também são capazes de realizar reprodução assexuada.
Normalmente cautelosos com os humanos, os tubarões-galha-preta podem se tornar agressivos na presença de alimento e já foram responsáveis por diversos ataques a pessoas. Esta espécie é importante tanto para a pesca comercial quanto para a pesca esportiva em várias partes de sua distribuição, sendo aproveitada sua carne, pele, nadadeiras e óleo de fígado. Foi classificada como Vulnerável pela União Internacional para a Conservação da Natureza (UICN), com base em sua baixa taxa reprodutiva e alto valor para os pescadores.
Remove ads
Etimologia
O nome vernáculo tubarão tem origem obscura, mas pode derivar de alguma das línguas nativas do Caribe. Seu registro mais antigo ocorre em 1500, como tubaram, na Carta de Pero Vaz de Caminha, e então como tuberão, em 1721.[5] Cação provavelmente foi construído com a aglutinação do verbo caçar e o sufixo -ão de agente. Foi registrado pela primeira vez no século XIII como caçon, e depois em 1376 como caçom e 1440 como caçõoes.[6]
Sicuri compartilha da etimologia de sucuri e derivou do tupi suku'ri no sentido de espécie de cação, e então espécie de ofídio. Teodoro Sampaio em O Tupi na Geografia Nacional (TupGN) e Vocabulário Tupi-Guarani (VocTG) atribui o sentido de "morde rápido" ao termo original. Foi registrado em 1587 e ca. 1594, respectivamente, socori e cururi em referência ao cação, mas em 1587 como sucuriú, em 1751 como securí e em 1783 como sucuris em referência ao ofídio.[7]
O nome genérico Carcharhinus deriva dos termos gregos karcháros (καρχάρος) e rhinós (ῥινός), aludindo à textura áspera da pele, e o epíteto específico limbatus vem do latim "margeado", em referência às bordas pretas das nadadeiras desse tubarão.[8][9]
Remove ads
Taxonomia
O tubarão-galha-preta foi descrito pela primeira vez pelo zoólogo francês Achille Valenciennes como Carcharias (Prionodon) limbatus na obra Systematische Beschreibung der Plagiostomen, de Johannes Müller e Friedrich Henle, publicada em 1839. Os exemplares-tipo eram dois indivíduos capturados nas proximidades da Martinica, ambos atualmente perdidos. Autores posteriores transferiram essa espécie para o gênero Carcharhinus.[10][11]
Remove ads
Filogenia e evolução
Resumir
Perspectiva
Os parentes mais próximos do tubarão-galha-preta foram originalmente considerados Carcharhinus amblyrhynchoides e o Carcharhinus brevipinna, devido a semelhanças na morfologia e no comportamento. No entanto, essa interpretação não foi confirmada por estudos de DNA mitocondrial e DNA ribossômico, que sugerem, em vez disso, afinidade com o tubarão-de-focinho-negro (C. acronotus). Mais estudos são necessários para esclarecer completamente a relação entre o tubarão-galha-preta e outras espécies do gênero Carcharhinus.[12] Análises de DNA mitocondrial também revelaram duas linhagens distintas dentro dessa espécie: uma ocupando o Atlântico Ocidental e outra abrangendo o Atlântico Oriental, os oceanos Índico e Pacífico. Isso sugere que os tubarões-galha-preta do Indo-Pacífico descendem daqueles do Atlântico Oriental, enquanto os tubarões do Atlântico Ocidental tornaram-se isolados devido ao alargamento do oceano Atlântico de um lado e à formação do istmo do Panamá do outro. Os tubarões dessas duas regiões diferem em morfologia, coloração e características de história de vida, e a linhagem do Atlântico Oriental pode merecer o status de espécie distinta.[13] Dentes fósseis pertencentes a essa espécie foram encontrados em depósitos do Mioceno Inferior (23–16 Ma) em Delauare e na Flórida.[14][15]
Descrição
Resumir
Perspectiva

O tubarão-galha-preta possui um corpo fusiforme, robusto e hidrodinâmico, com o focinho longo, pontudo e proporcional à largura da boca, além de olhos pequenos e arredondados. Os cinco pares de fendas branquiais são relativamente longos - especialmente a terceira, que mede entre 3,8% e 4,9% do comprimento total (CT) - e mais extensos do que os de espécies semelhantes. Os lobos nasais são baixos e amplamente triangulares, os sulcos labiais são curtos, e os dentes das mandíbulas - 15 fileiras de cada lado, com dois dentes sifisiais na mandíbula superior e um na inferior - são quase simétricos entre as arcadas, com base larga, cúspide estreita e alta, bordas serrilhadas ou finamente serrilhadas e pontas retas.[11]
As nadadeiras apresentam morfologia marcante: a primeira dorsal é moderadamente a muito alta (8,2–13,8% do CT), falcada e pontiaguda, com curta ponta posterior livre, situada sobre ou logo atrás da inserção posterior da nadadeira peitoral. A segunda nadadeira dorsal tem a ponta posterior livre de comprimento igual à altura da própria nadadeira, com origem aproximadamente sobre a origem da nadadeira anal. As nadadeiras peitorais são grandes ou moderadamente grandes, falcadas e pontiagudas; as nadadeiras pélvicas podem apresentar pontas pretas, e a nadadeira anal é geralmente branca. A nadadeira caudal é fortemente assimétrica, com lobo inferior bem desenvolvido, crista ondulada ao longo do dorso do lobo superior e uma reentrância sob sua ponta. Não há quilha entre as nadadeiras dorsais nem na base da cauda.[10][16]
A coloração varia do cinza ao castanho-acinzentado no dorso, esbranquiçando na região ventral, com uma faixa lateral branca a cinza-clara que se estende até o abdome superior. As nadadeiras geralmente apresentam pontas pretas - especialmente as peitorais, a segunda dorsal e o lobo inferior da caudal -, enquanto a primeira dorsal e o lobo superior da caudal frequentemente têm bordas pretas. Em alguns indivíduos maiores, as nadadeiras podem apresentar poucas ou nenhuma marca visível.[9] Durante florações de cocolitóforos, também chamadas de "embranquecimentos", esses tubarões podem perder temporariamente quase toda a sua coloração.[17] A espécie atinge normalmente 1,5 metro (4,9 polegadas) de comprimento, podendo chegar a 2,55–2,8 metros (8,4–9,2 polegadas), e um peso máximo conhecido de 123 quilos (270 libras). Os filhotes nascem com 38 a 72 centímetros.[18][16]
- Tem manchas pretas na maioria de suas barbatanas
- Dentes inferiores
- Dentes superiores
Remove ads
Distribuição e habitat
Resumir
Perspectiva
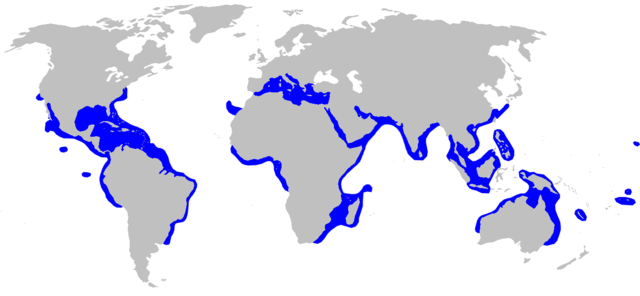
O tubarão-galha-preta é distribuído circumglobalmente em mares tropicais, subtropicais e temperados quentes:[1][10]
- África (Angola, Argélia, Benim, Cabo Verde, Camarões, Comores, República Democrática do Congo, Jibuti, Egito, Eritreia, Gabão, Gâmbia, Gana, Guiné, Guiné-Bissau, Libéria, Líbia, Madagáscar, Mauritânia, Marrocos, Moçambique, Nigéria, Quénia, São Tomé e Príncipe, Senegal, Seicheles, Serra Leoa, Somália, África do Sul, Sudão, Tanzânia, Togo, Tunísia, Saara Ocidental);
- América: do Norte (Estados Unidos (desde a Califórnia (Pacífico) e Massachussetes (Atlântico)), Havaí, México (ilhas Revillagigedo)), Central (Belize, Costa Rica, El Salvador, Guatemala, Nicarágua, Panamá, Porto Rico), do Sul (Brasil (São Paulo, Rio Grande do Norte, Espírito Santo, Piauí, Pará, Amapá e Maranhão[19][20]), Colômbia, Equador (Galápagos), Guiana, Guiana Francesa, Honduras, Peru, Suriname, Venezuela) e Caribe (Anguila, Antígua e Barbuda, Baamas, Barbados, Cuba, Curaçau, Dominica, República Dominicana, Granada, Haiti, Ilhas Virgens Britânicas, Ilhas Virgens Americanas, Jamaica, Monserrate, Santa Lúcia, São Cristóvão e Neves, São Martinho (neerlandês) São Martinho (francês), São Vicente e Granadinas e Trindade e Tobago);
- Ásia (Arábia Saudita, Bangladexe, Barém, Brunei, Camboja, China, Emirados Árabes Unidos, Filipinas, Índia, Indonésia, Irão, Iraque, Israel, Japão (ilhas Léquias[21]), Cuaite, Líbano, Malásia, Malta, Mianmar, Omã, Paquistão, Catar, Síria, Seri Lanca, Taiuã, Tailândia, Timor-Leste, Turquia, Vietnã, Iêmem);
- Europa (Albânia, Bósnia e Herzegovina, Croácia, Eslovênia, Espanha (ilhas Canárias), França, Grécia, Itália, Montenegro, Portugal (Madeira);
- Oceania (Austrália, Fiji, Marquesas, Nova Caledônia, Papua-Nova Guiné, Samoa, Ilhas Salomão, Tonga, Polinésia Francesa (Taiti)).

Há registro de migração sazonal da população da costa leste dos Estados Unidos, que se desloca para o norte até a Carolina do Norte no verão e retorna ao sul, até a Flórida, durante o inverno.[22] Também são relatadas migrações sazonais entre o Brasil e a Nova Escócia, no Canadá, que indicam conectividade populacional significativa.[23] A maioria dos tubarões-galha-preta habita águas rasas - com menos de 30 metros de profundidade - sobre plataformas continentais e insulares, embora possam atingir até 64 metros.[18] Seus habitats preferenciais incluem baías lamacentas, lagoas insulares, estuários, manguezais e bordas de recifes de coral. São também tolerantes à baixa salinidade, podendo penetrar em ambientes estuarinos e manguezais. Embora indivíduos sejam ocasionalmente encontrados distantes da costa, não habitam águas oceânicas abertas.[10] Além disso, ocorrem em áreas de lama, areia, cascalho, praias e pradarias marinhas, sendo encontrados tanto sobre fundos moles quanto em regiões rochosas e em recifes formados por rochas, corais ou ostras. Estão frequentemente associados a recifes, incluindo suas bordas e zonas adjacentes compostas por coluna d'água e substrato macio.[16]
Remove ads
Biologia e ecologia
Resumir
Perspectiva
O tubarão-galha-preta é um predador extremamente rápido e energético, geralmente encontrado em grupos de tamanhos variados.[9] Não ocorre segregação por sexo e idade; machos adultos e fêmeas não grávidas são encontrados separados das fêmeas grávidas, e ambos estão separados dos juvenis.[10] Na baía de Terra Ceia, na Flórida, uma área de criadouro para essa espécie, os juvenis formam agregações durante o dia e se dispersam à noite. Essas agregações são mais intensas no início do verão, quando os tubarões são mais jovens, sugerindo que eles buscam refúgio contra predadores (principalmente tubarões maiores) ao se manterem em grupo.[24] A evasão de predadores pode também explicar por que os juvenis não se concentram nas áreas com maior densidade de presas na baía.[25] Não há predadores conhecidos para os adultos. Entre os parasitas registrados estão os copépodes Pandarus sinuatus e P. smithii, e os monogeneanos Dermophthirius penneri e espécies de Dionchus, que se fixam na pele do animal.[11][26][27] A espécie também é parasitada por nematódeos da família Philometridae (gênero Philometra), que infestam os ovários.[28]
Comportamento

Assim como Carcharhinus brevipinna, o tubarão-galha-preta é conhecido por saltar para fora da água girando três ou quatro vezes em torno de seu próprio eixo antes de cair. Alguns desses saltos ocorrem ao final de ataques alimentares, nos quais o tubarão avança em espiral verticalmente por meio de cardumes de peixes pequenos, sendo lançado no ar pelo impulso do movimento.[9] Observações nas Baamas sugerem que esses saltos também podem ocorrer como forma de remover Echeneis naucrates aderidos ao corpo, que irritam a pele e comprometem sua forma hidrodinâmica.[29] A velocidade média alcançada durante esses saltos foi estimada em 6,3 m/s (21 pés/s).[30] Possuem uma disposição tímida e geralmente perdem disputas por alimento para tubarões-das-galápagos (C. galapagensis) e C. albimarginatus de tamanho semelhante.[10] Quando se sentem ameaçados ou desafiados, podem realizar uma exibição agonística, na qual nadam em direção à ameaça e em seguida se afastam, enquanto rolam de um lado para o outro, abaixam as nadadeiras peitorais, erguem a cabeça e a cauda e fazem movimentos laterais de mordida. Essa sequência dura cerca de 25 segundos. Esse comportamento é semelhante às ações de um tubarão tentando se livrar de um Echeneis naucrates, sugerindo que um desses comportamentos pode ter evoluído a partir do outro.[31]
Alimentação
Peixes representam cerca de 90% da dieta do tubarão-galha-preta.[32] Diversas espécies já foram registradas como presas dessa espécie, incluindo sardinhas, sáveis, arenques, anchovas, peixe-camurim, bagres marinhos, peixe-corneta, linguados, polinemídeos, tainhas, cavalinhas, xaréus, garoupas, robalos, pargos, gerreídeos, imperadores, roncadores, peixe-manteiga, corvinas, solhas, tilápias, peixe-porcos, peixe-caixas e peixe-baiacus. Também se alimentam de arraias, além de pequenos tubarões do gênero Mustelus e tubarões-de-bico-fino (Rhizoprionodon). Crustáceos e cefalópodes são consumidos ocasionalmente.[10][33] No golfo do México, as presas mais importantes são o Brevoortia patronus, seguido pela corvina-brasileira (Micropogonias undulatus).[32] Na costa da África do Sul, as principais presas são os xaréus e os arenques.[34] A caça atinge seu pico ao amanhecer e ao entardecer.[32] A natureza excitável e social do tubarão-galha-preta o torna propenso a frenesi alimentar quando grandes quantidades de alimento ficam repentinamente disponíveis, como durante o despejo de resíduos por embarcações de pesca.[10]
História de vida
Assim como outros tubarões do grupo dos carcarrinídeos, o tubarão-galha-preta é vivíparo. As fêmeas normalmente dão à luz de quatro a sete filhotes (com variações de um a dez) a cada dois anos, utilizando berçários costeiros rasos, ricos em alimento e com poucos predadores.[10] Esses berçários já foram identificados em locais como Pine Island Sound, na bacia de Terra Ceia, e Yankeetown, na costa do golfo da Flórida; Bulls Bay, na Carolina do Sul; e Pontal do Paraná, no Brasil.[35] Apesar de adultos altamente móveis, esses tubarões são filopátricos, ou seja, retornam ao mesmo local de nascimento para se reproduzir, o que resulta em estoques reprodutivos geneticamente distintos que se sobrepõem geograficamente.[36][37]
O acasalamento ocorre entre a primavera e o início do verão, e os filhotes nascem aproximadamente um ano depois, após um período de gestação de 10 a 12 meses.[10] As fêmeas possuem um ovário funcional e dois úteros, cada um dividido em compartimentos, com um embrião por compartimento.[38] Inicialmente, os embriões são nutridos por um saco vitelino; por volta da 10.ª ou 11.ª semana de gestação, quando medem 18–19 centímetros (7.1–7.5 polegadas), o saco vitelino é absorvido e se transforma em uma placenta que sustenta o desenvolvimento até o nascimento. O comprimento ao nascer varia entre 55-60 centímetros (22–24 polegadas) na costa leste dos Estados Unidos e 61–65 centímetros (24–26 polegadas) no norte da África.[22][38] A taxa de mortalidade nos primeiros 15 meses de vida é de 61–91%, com as principais ameaças sendo predação e fome.[39] Os filhotes permanecem nos berçários até o outono seguinte, quando migram para áreas de invernada.[22]
O crescimento desacelera com a idade: de 25–30 centímetros (9.8–11.8 polegadas) nos primeiros seis meses, para 20 centímetros (7.9 polegadas) por ano até o segundo ano, depois 10 centímetros (3.9 polegadas) por ano até a maturação e então apenas cinco centímetros (dois polegadas) por ano na fase adulta.[40][41] O tamanho na maturidade varia geograficamente: machos e fêmeas atingem a maturidade entre 1.4–1.5 metro (4.6–4.9 pés) e 1.6 metro (5.2 pés) no Atlântico Nordeste,[22] entre 1.3–1.4 metro (4.3–4.6 pés) e 1.5–1.6 metro (4.9–5.2 pés) no golfo do México,[40][42] 1.5 e 1.6 metro (4.9 and 5.2 pés) na África do Sul,[43] e 1.7 e 1.8 metro (5.6 and 5.9 pés) no norte da África.[38] A idade de maturação é de 4–5 anos para os machos e 7–8 anos para as fêmeas,[40][42] e a expectativa de vida é de pelo menos 12 anos.[10]
Em 2007, uma fêmea de tubarão-galha-preta de nove anos no Aquário e Centro de Ciências Marinhas da Virgínia foi encontrada grávida de um filhote fêmea próximo do parto, apesar de nunca ter tido contato com um macho. Análises genéticas confirmaram que o filhote foi resultado de partenogênese automítica, uma forma de reprodução assexuada em que o óvulo se funde com um corpúsculo polar, formando um zigoto sem fertilização. Esse caso, somado a um registro anterior no tubarão-de-pala (Sphyrna tiburo), sugere que a reprodução assexuada pode ser mais comum entre os tubarões do que se pensava.[44] O tubarão-galha-preta é a única espécie de tubarão conhecido por gerar híbridos, neste caso, com o tubarão-da-barreira-de-coral (Carcharinus tilstoni). O híbrido não possui nomeação, e é pouco distinto das espécies progenitoras, porém está se tornando relativamente abundante em mares australianos, sendo versátil o suficiente para competir com o endêmico tubarão da região. Cerca de 57 híbridos adultos saudáveis foram-se achados, e aparentam fertilidade.[45]
Remove ads
Interação com humanos
Resumir
Perspectiva

Tubarões-galha-preta demonstrando curiosidade por mergulhadores já foram relatados, mas permanecem a uma distância segura. Na maioria das circunstâncias, não são considerados altamente perigosos para os seres humanos. No entanto, podem se tornar agressivos na presença de alimento, e seu tamanho e velocidade impõem respeito.[10] Até 2008, o International Shark Attack File registrava 28 ataques não provocados (um fatal) e 13 ataques provocados por essa espécie.[46] Os tubarões-galha-preta são responsáveis anualmente por 16% dos ataques de tubarão ocorridos na Flórida. A maioria dos ataques por essa espécie resulta apenas em ferimentos leves.[11]
Como um dos maiores tubarões comuns em águas costeiras, é capturado em grande número por pescarias comerciais ao redor do mundo, utilizando espinhéis, redes de fundo fixas, rede de arrasto de fundo e linha e anzol. Sua carne é de alta qualidade e comercializada fresca, congelada ou seca e salgada. Além disso, as nadadeiras são utilizadas na preparação de sopa de barbatana de tubarão, a pele na fabricação de couro, o óleo de fígado na produção de vitaminas, e as carcaças na fabricação de farinha de peixe.[10] É uma das espécies mais importantes para a pesca de tubarões no noroeste do Atlântico, ficando atrás apenas do tubarão-corre-costa (C. plumbeus). Sua carne é considerada superior à do tubarão-corre-costa, o que leva a que esse e outros carcarrinídeos sejam vendidos sob o nome "tubarão-galha-preta" nos Estados Unidos. A espécie também tem grande importância para as pescarias da Índia e do México, sendo ainda capturada, em diferentes quantidades, por pescarias no Mediterrâneo, no mar da China Meridional e ao norte da Austrália.[41]
O tubarão-galha-preta é popular entre pescadores esportivos na Flórida, no Caribe e na África do Sul. Está listado como peixe de esporte pela International Game Fish Association. Uma vez fisgado, oferece forte resistência, mantendo uma luta constante e, por vezes, saltando para fora da água.[11] Desde 1995, o número de tubarões-galha-preta capturados por pescadores esportivos nos Estados Unidos tem se igualado ou superado ao número capturado pela pesca comercial.[41]
Remove ads
Conservação
Resumir
Perspectiva
Em 2018, o tubarão-galha-preta foi classificada como quase ameaçada (NT) no Livro Vermelho da Fauna Brasileira Ameaçada de Extinção do Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio)[3][47] e consta no Apêndice II da Convenção sobre o Comércio Internacional das Espécies Silvestres Ameaçadas de Extinção (CITES) (a menção é à família dos carcarrinídeos).[48] A União Internacional para a Conservação da Natureza (UICN) classifica o tubarão-galha-preta como vulnerável (VU), pois tem baixa taxa reprodutiva e sofre pela sobrepesca. Em regiões com medidas de manejo em vigor, como o golfo do México e o Atlântico Norte (EUA), Austrália e África do Sul, acredita-se que a pesca dessa espécie ocorre de forma sustentável.[1] Nos Estados Unidos e na Austrália a regulamentação ocorre dentro de planos de manejo que englobam diversas espécies de tubarões, como é o caso da categoria de grandes tubarões costeiros do Plano de Gestão das Pescarias de Tubarões do Atlântico do National Marine Fisheries Service dos Estados Unidos. Nenhum plano de conservação específico para essa espécie foi implementado.[41]
Ameaças
O tubarão-galha-preta sofre pressão pesqueira em toda a sua distribuição. É capturado tanto como alvo quanto como captura acessória em pescarias artesanais e industriais, utilizando diversos petrechos, como redes de emalhe, espinhéis e arrastos. Sua carne e nadadeiras são comercializadas, salvo em locais onde a retenção é proibida por regulamentação. Também é capturado na pesca recreativa, embora geralmente seja devolvido ao mar, e em programas de proteção costeira voltados ao controle de grandes tubarões. A mortalidade após a soltura de indivíduos ainda vivos foi estimada em 44% e 31% nas pescarias comerciais com espinhéis demersais e redes de emalhe nos Estados Unidos, respectivamente, e entre 19% e 23% na pesca recreativa com linha no Golfo do México.[1]
Na região do Atlântico Sudoeste, as pescarias artesanais são intensas, e as atividades comerciais permanecem amplamente desreguladas em muitas áreas. Na Venezuela, por exemplo, tanto as pescarias industriais quanto artesanais apresentaram picos de captura seguidos por quedas, sinalizando sobrepesca sequencial. Na costa ocidental da África, o esforço de pesca aumentou em eficiência e intensidade ao longo dos últimos 50 anos. A frota artesanal que opera na costa da Mauritânia, por exemplo, teve um aumento estimado de dez vezes no esforço efetivo de pesca nos últimos 25 anos. O tubarão-galha-preta também é ocasionalmente capturado em pescarias com redes de deriva no mar Mediterrâneo. No Sudeste Asiático, a pressão pesqueira histórica e atual é elevada, com destaque para o mar da China Meridional, onde os estoques pesqueiros foram severamente explorados — com quedas superiores a 70% nas zonas costeiras, de plataforma e mar aberto entre as décadas de 1960 e 1990.[1]
Além da pressão pesqueira, a espécie é ameaçada por perda e degradação de habitat, em especial por sua preferência por águas costeiras rasas. A poluição, o desmatamento de manguezais e outras alterações humanas comprometem os ambientes que utiliza. As mudanças climáticas representam uma ameaça adicional significativa. Eventos de branqueamento em larga escala de recifes de coral, relacionados ao aquecimento global, têm ocorrido com frequência crescente desde 1997, resultando em degradação de habitats em todo o mundo. Mesmo que o aquecimento global seja limitado a 1,5 °C, quase todos os recifes de corais de águas tropicais deverão sofrer perdas significativas de área e extinções locais.[1]
Tendência populacional
Dados genéticos apontam uma estruturação populacional entre diferentes bacias oceânicas, com distinções claras entre o Atlântico Ocidental, o Golfo do México e o Mar do Caribe em relação ao Atlântico Oriental e Indo-Pacífico. Também pode haver estruturação dentro das próprias bacias. Globalmente, observa-se uma tendência de dispersão predominante entre os machos e fidelidade ao local de nascimento pelas fêmeas. As tendências populacionais foram avaliadas com base em três fontes principais: avaliações de estoque no Golfo do México e no Atlântico Noroeste, e dados padronizados de captura por unidade de esforço (CPUE) no Oceano Índico Ocidental. Essas informações foram analisadas com um modelo bayesiano de espaço de estados, produzindo taxas anuais de variação, estimativas medianas de mudança ao longo de três gerações e probabilidades associadas às categorias da Lista Vermelha da IUCN. No Golfo do México, a população não estava sobre-explorada em 2016, com indícios de leve recuperação após declínio até o início dos anos 2000. A fecundidade do estoque reprodutivo foi reduzida entre 1% e 32% desde 1981, sendo a estimativa mais provável inferior a 5%, com tendência de redução inferior a 20% ao longo de três gerações. Já no Atlântico Norte, embora não houvesse sobrepesca em 2018, o histórico mostrou quedas anteriores. A fecundidade do estoque caiu 54% entre 1981 e 2018, com estimativa de redução entre 50% e 79% ao longo de três gerações. Na África do Sul, os dados de CPUE indicam declínio contínuo entre 1981 e 2019, com estimativa mediana de redução de 20,3% ao longo de três gerações. Apesar disso, observações empíricas sugerem aumento da espécie na costa de KwaZulu-Natal desde 2006, onde continua sendo uma das mais capturadas.[1]
Na Austrália, dados de CPUE de longlines indicaram estabilidade na abundância da espécie e de suas congêneres entre 2003 e 2017, embora com incerteza devido ao baixo número de capturas. Como a pesca comercial foi suspensa na área pesquisada a partir de 2005, sugere-se que não houve efeitos negativos significativos sobre a população. Desde 2009, não há ameaças conhecidas na região. Avaliações de estoques do complexo de espécies correlatas indicam que, embora tenham sido sobre-exploradas no passado no norte do país, as populações nas costas norte, oeste e leste se recuperaram e são atualmente sustentáveis. A dificuldade de identificação visual entre algumas espécies, contudo, dificulta avaliações específicas. Na região dos Mares da Arábia, o tubarão-galha-preta é comum nas capturas, sendo, em alguns locais, a espécie mais frequentemente desembarcada. Porém, houve declínios localizados: em Omã, a proporção caiu de 7% para 1% em um ano; no Paquistão, estima-se uma redução de 20% a 30% desde 1999; e na Índia, houve queda de 60% nas últimas duas décadas, mesmo com esforço pesqueiro estável ou crescente. O aumento da demanda por barbatanas desde os anos 1970 impulsionou a intensificação da pesca na região, com crescimento da atividade pesqueira costeira e consequente declínio das capturas. Estima-se uma redução populacional entre 30% e 49% nessa região ao longo de três gerações (~39 anos).[1]
Em outras áreas, os dados populacionais específicos para a espécie são escassos. Contudo, a análise de capturas históricas de tubarões-requiem e espécies correlatas entre 1950 e 2016 indica uma redução de 49% nas capturas entre 1983 e 2016, mesmo com aumento do esforço pesqueiro — o que sugere um declínio real das populações. Isso equivale a uma redução estimada de 54% ao longo de três gerações (38 anos), refletindo tendências amplas de declínio na região, ainda que não específicas para a espécie. De forma geral, o tubarão-galha-preta é considerado sustentavelmente explorado em regiões com gestão pesqueira ativa, como o Golfo do México, Atlântico Norte, Austrália e África do Sul. Nessas áreas, as reduções populacionais variam de <20% a cerca de 59%, com indicadores de recuperação ou estabilidade. Em outras regiões, onde há menos controle e maior demanda, como nos Mares da Arábia e no Indo-Pacífico, a espécie provavelmente sofreu reduções significativas. Considerando todos os dados disponíveis, estima-se que o tubarão-galha-preta tenha sofrido uma redução populacional entre 30% e 49% ao longo das últimas três gerações (27 a 49 anos), em decorrência da exploração pesqueira.[1]
Remove ads
Referências
- Rigby, C.L.; Carlson, J.; Chin, A.; Derrick, D.; Dicken, M.; Pacoureau, N. (2021). «Blacktip Shark, Carcharhinus limbatus». Lista Vermelha de Espécies Ameaçadas. 2021: e.T3851A2870736. doi:10.2305/IUCN.UK.2021-2.RLTS.T3851A2870736.en
 . Consultado em 12 de novembro de 2021
. Consultado em 12 de novembro de 2021 - Froeser, R.; Pauly, D. «Carcharhinus limbatus (Valenciennes, 1839)». World Register of Marine Species (WoRMS). Consultado em 9 de junho de 2025. Cópia arquivada em 28 de maio de 2025
- «Livro Vermelho da Fauna Brasileira Ameaçada de Extinção» (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 2018. Consultado em 3 de maio de 2022. Cópia arquivada (PDF) em 3 de maio de 2018
- Grande Dicionário Houaiss, verbete tubarão-galha-preta
- Grande Dicionário Houaiss, verbete tubarão
- Grande Dicionário Houaiss, verbete cação
- Grande Dicionário Houaiss, verbete sucuri
- «Family CARCHARHINIDAE Jordan & Evermann 1896 (Requiem Sharks)». ETYFish Project. Consultado em 9 de junho de 2025. Cópia arquivada em 3 de dezembro de 2024
- Ebert, D. A. (2003). Sharks, Rays, and Chimaeras of California. Berkeley, Califórnia: Imprensa da Universidade da Califórnia. pp. 156–157. ISBN 0-520-23484-7. Consultado em 18 de abril de 2023
- Compagno, Leonard J. V. (2001). Sharks of the World: An annotated and illustrated catalogue of shark species known to date. Roma: Organização das Nações Unidas para a Alimentação e a Agricultura. p. 91
- Curtis, T. «Biological Profiles: Blacktip Shark». Departamento de Ictiologia do Museu de História Natural da Flórida. Consultado em 9 de junho de 2025. Cópia arquivada em 29 de junho de 2007
- Dosay-Akbulut, M. (2008). «The phylogenetic relationship within the genus Carcharhinus». Comptes Rendus Biologies. 331 (7): 500–509. PMID 18558373. doi:10.1016/j.crvi.2008.04.001. Cópia arquivada (PDF) em 27 de novembro de 2024
- Keeney, D. B.; Heist, E. J. (outubro de 2006). «Worldwide phylogeography of the blacktip shark (Carcharhinus limbatus) inferred from mitochondrial DNA reveals isolation of western Atlantic populations coupled with recent Pacific dispersal». Molecular Ecology. 15 (12): 3669–3679. PMID 17032265. doi:10.1111/j.1365-294X.2006.03036.x
- Benson, R.N., ed. (1998). Geology and Paleontology of the Lower Miocene Pollack Farm Fossil Site Delaware (PDF). Dover: Delaware Natural History Survey. pp. 133–139. Cópia arquivada (PDF) em 9 de junho de 2025
- Brown, R. C. (2008). Florida's Fossils: Guide to Location, Identification, and Enjoyment 3.ª ed. Sarasota, Flórida: Pineapple Press Inc. p. 100. ISBN 978-1-56164-409-4
- «Carcharhinus limbatus». Sistema de informação online Shorefishes of the Greater Caribbean. Consultado em 9 de junho de 2025. Cópia arquivada em 30 de março de 2025
- Martin, R. A. «Albinism in Sharks». ReefQuest Centre for Shark Research. Consultado em 9 de junho de 2025. Cópia arquivada em 26 de abril de 2025
- «Carcharhinus limbatus (Valenciennes, 1839)». FishBase. Consultado em 9 de junho de 2025. Cópia arquivada em 9 de junho de 2025
- «Ocorrência de Carcharhinus limbatus». Sistema de Informação sobre a Biodiversidade Brasileira (SiBBr). Consultado em 9 de junho de 2025. Cópia arquivada em 10 de junho de 2025
- Nunes, J. L. S.; Piorski, N. M. (2011). Peixes marinhos e estuarinos do Maranhão (PDF). São Luís: Café & Lápis. ISBN 9788562485176. Consultado em 15 de maio de 2025
- Yano, Kazunari; Morrissey, John F. (1 de junho de 1999). «Confirmation of blacktip shark, Carcharhinus limbatus, in the Ryukyu Islands and notes on possible absence of C. melanopterus in Japanese waters» (PDF). Ichthyological Research (em inglês). 46 (2): 193–198. ISSN 1341-8998. doi:10.1007/BF02675438
- Castro, J.I. (novembro de 1996). «Biology of the blacktip shark, Carcharhinus limbatus, off the southeastern United States». Bulletin of Marine Science. 59 (3): 508–522
- «Blacktip sharks, Carcharhinus limbatus – MarineBio». MarineBio Conservation Society. Consultado em 15 de maio de 2025
- Heupel, M. R.; Simpfendorfer, C. A. (2005). «Quantitative analysis of aggregation behavior in juvenile blacktip sharks». Marine Biology. 147 (5): 1239–1249. doi:10.1007/s00227-005-0004-7
- Heupel, M. R.; Hueter, R. E. (2002). «The importance of prey density in relation to the movement patterns of juvenile sharks within a coastal nursery area». Marine and Freshwater Research. 53 (2): 543–550. doi:10.1071/MF01132
- Bullard, S. A.; Frasca, A. (Jr.); Benz, G. W. (junho de 2000). «Skin Lesions Caused by Dermophthirius penneri (Monogenea: Microbothriidae) on Wild-Caught Blacktip Sharks (Carcharhinus limbatus)». Journal of Parasitology. 86 (3): 618–622. PMID 10864264. doi:10.1645/0022-3395(2000)086[0618:SLCBDP]2.0.CO;2
- Bullard, S. A.; Benz, G. W.; Braswell, J. S. (2000). «Dionchus postoncomiracidia (Monogenea: Dionchidae) from the skin of blacktip sharks, Carcharhinus limbatus (Carcharhinidae)». Journal of Parasitology. 86 (2): 245–250. JSTOR 3284763. PMID 10780540. doi:10.1645/0022-3395(2000)086[0245:DPMDFT]2.0.CO;2
- Rosa-Molinar, E.; Williams, C.S. (1983). «Larval nematodes (Philometridae) in granulomas in ovaries of blacktip sharks, Carcharhinus limbatus (Valenciennes)». Journal of Wildlife Diseases. 19 (3): 275–277. PMID 6644926. doi:10.7589/0090-3558-19.3.275
- Riner, E. K.; Brijnnschweiler, J. M. (2003). «Do sharksuckers, Echeneis naucrates, induce jump behaviour in blacktip sharks, Carcharhinus limbatus?». Marine and Freshwater Behaviour and Physiology. 36 (2): 111–113. doi:10.1080/1023624031000119584
- Brunnschweiler, J. M. (2005). «Water-escape velocities in jumping blacktip sharks». Journal of the Royal Society Interface. 2 (4): 389–391. PMC 1578268
 . PMID 16849197. doi:10.1098/rsif.2005.0047
. PMID 16849197. doi:10.1098/rsif.2005.0047 - Ritter, E. K.; Godknecht, A. J. (1 de fevereiro de 2000). Ross, S. T., ed. «Agonistic Displays in the Blacktip Shark (Carcharhinus limbatus)». Copeia. 2000 (1): 282–284. JSTOR 1448264. doi:10.1643/0045-8511(2000)2000[0282:ADITBS]2.0.CO;2
- Barry, K. P. (2002). Feeding habits of blacktip sharks, Carcharhinus limbatus, and Atlantic sharpnose sharks, Rhizoprionodon terraenovae, in Louisiana coastal waters (Tese de MS). Baton Rouge: Louisiana State University. Consultado em 9 de junho de 2025. Cópia arquivada (PDF) em 11 de abril de 2018
- Thomas, N. «Carcharhinus limbatus». Animal Diversity Web. Consultado em 9 de junho de 2025. Cópia arquivada em 31 de maio de 2025
- Dudley, S. F. J.; Cliff, G. (1993). «Sharks caught in the protective gill nets off Natal, South Africa. 7. The blacktip shark Carcharhinus limbatus (Valenciennes)» (PDF). African Journal of Marine Science. 13: 237–254. doi:10.2989/025776193784287356
- Bornatowski, H. (2008). «A parturition and nursery area for Carcharhinus limbatus (Elasmobranchii, Carcharhinidae) off the coast of Paraná, Brazil». Brazilian Journal of Oceanography. 56 (4): 317–319. doi:10.1590/s1679-87592008000400008. Cópia arquivada em 3 de dezembro de 2023
- Keeney, D.B.; Heupel, M.; Hueter, R.E.; Heist, E.J. (2003). «Genetic heterogeneity among blacktip shark, Carcharhinus limbatus, continental nurseries along the U.S. Atlantic and Gulf of Mexico» (PDF). Marine Biology. 143 (6): 1039–1046. doi:10.1007/s00227-003-1166-9
- Keeney, D.B.; Heupel, M.R.; Hueter, R.E.; Heist, E.J. (2005). «Microsatellite and mitochondrial DNA analyses of the genetic structure of blacktip shark (Carcharhinus limbatus) nurseries in the northwestern Atlantic, Gulf of Mexico, and Caribbean Sea». Molecular Ecology. 14 (7): 1911–1923. PMID 15910315. doi:10.1111/j.1365-294X.2005.02549.x
- Capapé, C.H.; Seck, A.A.; Diatta, Y.; Reynaud, C.H.; Hemida, F.; Zaouali, J. (2004). «Reproductive biology of the blacktip shark, Carcharhinus limbatus (Chondrichthyes: Carcharhinidae) off West and North African Coasts» (PDF). Cybium. 28 (4): 275–284
- Heupel, M.R.; Simpfendorfer, C.A. (2002). «Estimation of mortality of juvenile blacktip sharks, Carcharhinus limbatus, within a nursery area using telemetry data». Canadian Journal of Fisheries and Aquatic Sciences. 59 (4): 624–632. CiteSeerX 10.1.1.514.5335
 . doi:10.1139/f02-036
. doi:10.1139/f02-036 - Branstetter, S. (9 de dezembro de 1987). «Age and Growth Estimates for Blacktip, Carcharhinus limbatus, and Spinner, C. brevipinna, Sharks from the Northwestern Gulf of Mexico» (PDF). Copeia. 1987 (4): 964–974. JSTOR 1445560. doi:10.2307/1445560. Cópia arquivada (PDF) em 14 de dezembro de 2024
- Fowler, S.L.; Cavanagh, R.D.; Camhi, M.; Burgess, G.H.; Cailliet, G.M.; Fordham, S.V.; Simpfendorfer, C.A.; Musick, J.A. (2005). Sharks, Rays and Chimaeras: The Status of the Chondrichthyan Fishes (PDF). Glande, Suíça: União Internacional para a Conservação da Natureza. pp. 106–109, 293–295. ISBN 978-2-8317-0700-6. Cópia arquivada (PDF) em 24 de maio de 2025
- Killam, K.A.; Parsons, G.R. (maio de 1989). «Age and Growth of the Blacktip Shark, Carcharhinus limbatus, near Tampa Bay» (PDF). Florida Fishery Bulletin. 87: 845–857. Consultado em 10 de novembro de 2016. Arquivado do original (PDF) em 15 de dezembro de 2016
- Wintner, S.P.; Cliff, G. (1996). «Age and growth determination of the blacktip shark, Carcharhinus limbatus, from the east coast of South Africa» (PDF). Fishery Bulletin. 94 (1): 135–144. Consultado em 10 de novembro de 2016. Arquivado do original (PDF) em 16 de dezembro de 2016
- Chapman, D.D.; Firchau, B.; Shivji, M.S. (2008). «Parthenogenesis in a large-bodied requiem shark, the blacktip Carcharhinus limbatus» (PDF). Journal of Fish Biology. 73 (6): 1473–1477. doi:10.1111/j.1095-8649.2008.02018.x
- Voloder, Dubravka (3 de janeiro de 2012). «World-first hybrid sharks found off Australia». ABC News. Consultado em 5 de janeiro de 2012. Cópia arquivada em 5 de janeiro de 2012
- «ISAF Statistics on Attacking Species of Shark». Flmnh.ufl.edu. 20 de maio de 2009. Consultado em 6 de maio de 2022. Cópia arquivada em 31 de agosto de 2012
- «Carcharhinus limbatus (Müller & Henle, 1839)». Sistema de Informação sobre a Biodiversidade Brasileira (SiBBr). Consultado em 9 de junho de 2025. Cópia arquivada em 17 de maio de 2025
- «Appendices - CITES». cites.org. Consultado em 14 de janeiro de 2022. Cópia arquivada em 6 de agosto de 2011
Remove ads
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads