Лучшие вопросы
Таймлайн
Чат
Перспективы
Хлорид серебра(I)
химическое соединение Из Википедии, свободной энциклопедии
Remove ads
Хлори́д серебра́(I) (хло́ристое серебро́, химическая формула — AgCl) — неорганическая бинарная серебряная соль соляной кислоты.
В нормальных условиях, хлорид серебра — это белый порошок или бесцветные кристаллы.
Встречается в природе в виде минерала хлораргирита.
Remove ads
Молекулярная и кристаллическая структура
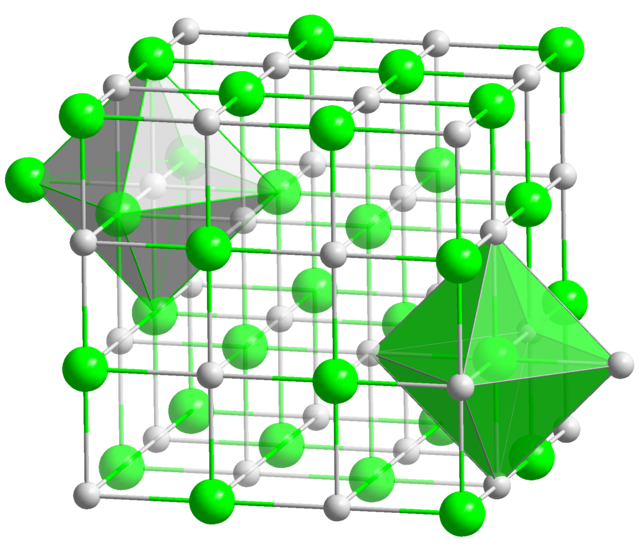
Хлорид серебра имеет следующий элементный состав: Серебро (Ag) — 75,26 %, хлор (Cl) — 24,74 %. Атом серебра в молекуле находится в состоянии sp3d2-гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм[9].
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6[10].
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера[10].
Remove ads
Физические свойства
Суммиров вкратце
Перспектива
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро»[11].
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10−10. С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10−8[12]. Нерастворим в минеральных кислотах, этиловом и метиловом спиртах, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке[5][13]. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
Термодинамические константы:
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль[14];
- Стандартная энтропия, S°298: 96 Дж/(моль·K)[14];
- Стандартная энергия Гиббса, ΔG°298: −110 кДж/моль[14].
- Стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K)[5];
- Энтальпия плавления, ΔHпл: 13,2 кДж/моль [5];
- Энтальпия кипения, ΔHкип: 184 кДж/моль [5].
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением[15]:
Remove ads
Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра[16]:
- Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов[17]:[стр. 233]: :
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении[18]:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах[19]:
Remove ads
Получение
Суммиров вкратце
Перспектива
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Remove ads
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl−;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии[20];
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды[17]:[с. 167]:
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Remove ads
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
См. также
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001. — ISBN 5-06-003363-5.
- Лидин Р. А. Справочник по общей и неорганической химии. — М.: КолосС, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основы общей химии. — М.: Лань, 2004. — ISBN 5-8114-0501-4.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М.: ЧеРо, 2002. — ISBN 5-88711-168-2.
Remove ads
Примечания
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





![{\displaystyle {2\,\mathrm {AgCl} {}\mathrel {\xrightarrow {\mathrm {hv} } } {}2\,\mathrm {Ag} {}+{}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2ab94e58a74166fd3ca5315774e5de4a98c06b23)
![{\displaystyle {\mathsf {AgCl+2NH_{3}\cdot H_{2}O=[Ag(NH_{3})_{2}]Cl+2H_{2}O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ec038a662c1aa73f2049b3b309bdfe5e9c02ddf7)
![{\displaystyle {\mathsf {AgCl+2Na_{2}SO_{3}S=Na_{3}[Ag(SO_{3}S)_{2}]+NaCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7155220cc5ad3d6c965fac8bca9320214bf14833)
![{\displaystyle {\mathsf {AgCl+2KCN=K[Ag(CN)_{2}]+KCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/acb56aaf4100af6c43720143f546d1041007d03b)





![{\displaystyle {\mathsf {AgCl+Cl^{-}=[AgCl_{2}]^{-}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/78c1b767d0f9ed85706a3a7f5686ffed3fcda8f4)





