Лучшие вопросы
Таймлайн
Чат
Перспективы
Ядерные рецепторы
Из Википедии, свободной энциклопедии
Remove ads
Ядерные рецепторы — это класс внутриклеточных белков, которые отвечают за восприятие стероидных и тиреоидных гормонов, а также некоторых других молекул. Уникальным свойством ядерных рецепторов, которое отличает их от других классов рецепторов, является их способность напрямую взаимодействовать с геномной ДНК и регулировать экспрессию соседних генов, тем самым контролируя развитие, гомеостаз и метаболизм организма. Следовательно, эти рецепторы классифицируются как факторы транскрипции[2]. Регуляция экспрессии генов ядерными рецепторами обычно происходит только тогда, когда присутствует лиганд-молекула, которая влияет на поведение рецептора. Связывание лиганда с ядерным рецептором приводит к конформационному изменению рецептора, которое, в свою очередь, активирует рецептор, что приводит к усилению или понижению регуляции экспрессии гена.
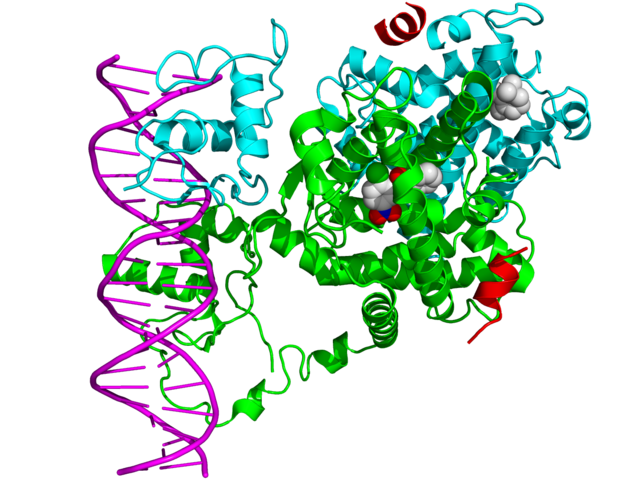
Вследствие способности напрямую взаимодействовать с геномной ДНК и контролировать ее экспрессию, ядерные рецепторы играют ключевую роль как в эмбриональном развитии, так и в гомеостазе взрослых.
Ядерные рецепторы можно классифицировать по механизму[3] или гомологии[4].
Remove ads
Распространение
Ядерные рецепторы специфичны для многоклеточных животных и не обнаруживаются у простейших, водорослей, грибов или растений. У людей, мышей и крыс соответственно по 48, 49 и 47 ядерных рецепторов[5].
Лиганды
Суммиров вкратце
Перспектива

Лиганды, которые связываются с ядерными рецепторами и активируют их, включают липофильные вещества, такие как эндогенные гормоны, витамины A и D, а также ксенобиотические эндокринные разрушители. Поскольку экспрессия большого количества генов регулируется ядерными рецепторами, лиганды, активирующие эти рецепторы, могут оказывать сильное воздействие на организм. Многие из этих регулируемых генов связаны с различными заболеваниями, что объясняет, почему молекулярные мишени примерно 13 % лекарств, одобренных Управлением по контролю за продуктами и лекарствами США, нацелены на ядерные рецепторы.
Ряд ядерных рецепторов, называемых орфанными рецепторами, не имеют известных (или, по крайней мере, общепризнанных) эндогенных лигандов. Некоторые из этих рецепторов, такие как FXR[англ.], LXR[англ.] и PPAR, связывают ряд промежуточных продуктов метаболизма, таких как жирные кислоты, желчные кислоты и / или стерины, с относительно низким сродством. Следовательно, эти рецепторы могут функционировать как метаболические сенсоры.[6] Другие ядерные рецепторы, такие как CAR и PXR, по-видимому, действуют как сенсоры ксенобиотиков, регулируя экспрессию ферментов цитохрома P450, которые метаболизируют эти ксенобиотики[7].
Remove ads
Структура
Суммиров вкратце
Перспектива
Большинство ядерных рецепторов имеют молекулярные массы от 50 000 до 100 000 дальтон. Ядерные рецепторы имеют модульную структуру и содержат следующие домены:
- (A-B) N-концевой регуляторный домен: содержит функцию активации 1 (AF-1), действие которой не зависит от присутствия лиганда. Активация транскрипции AF-1 обычно очень слабая, но она действительно действует синергетически с AF-2 в E-домене, обеспечивая более устойчивую повышающую регуляцию экспрессии гена. Последовательность домена A-B сильно варьируется между различными ядерными рецепторами.
- (C) ДНК-связывающий домен (DBD): высококонсервативный домен, содержащий два цинковых пальца, которые связываются со специфическими последовательностями ДНК, называемыми элементами гормонального ответа (англ. Hormone response element (HRE)).
- (D) Шарнирная область: Предполагается, что это гибкий домен, который соединяет DBD с LBD. Влияет на внутриклеточный транспорт и субклеточное распределение с целевой пептидной последовательностью.
- (E) Лиганд-связывающий домен (LBD): умеренно консервативный по последовательности и высококонсервативный по структуре между различными ядерными рецепторами. Структура LBD упоминается как альфа-спиральная сэндвич-складка, в которой три антипараллельных альфа-спирали («сэндвич-начинка») фланкируются двумя альфа-спиралями с одной стороны и тремя с другой («хлеб»). Полость для связывания лиганда находится внутри LBD и чуть ниже трех антипараллельных альфа-спиральных сэндвич-«наполнителей». Наряду с DBD, LBD вносит вклад в интерфейс димеризации рецептора и, кроме того, связывает белки коактиватора и корепрессора. LBD также содержит функцию активации 2 (AF-2), действие которой зависит от присутствия связанного лиганда, контролируемого конформацией спирали 12 (H12).
- (F) С-концевой домен: последовательность различных ядерных рецепторов сильно варьируется.
N-терминал (A / B), ДНК-связывающий (C) и лиганд-связывающий (E) домены являются независимо хорошо сложенными и структурно стабильными, в то время как шарнирная область (D) и необязательные C-концевые (F) домены могут быть конформационными — гибкие и беспорядочные. Относительные ориентации доменов сильно различаются при сравнении трёх известных многодоменных кристаллических структур, две из которых связываются с DR1, одна связывается с DR4.[8]
Remove ads
Механизм работы
Суммиров вкратце
Перспектива
Ядерные рецепторы — многофункциональные белки, которые передают сигналы своих родственных лигандов. Ядерные рецепторы (ЯР) можно разделить на два широких класса в соответствии с их механизмом действия и субклеточным распределением в отсутствие лиганда. Небольшие липофильные вещества, такие как природные гормоны, диффундируют через клеточную мембрану и связываются с ядерными рецепторами, расположенными в цитозоле (ЯР типа I) или ядре (ЯР типа II) клетки. Связывание вызывает конформационное изменение рецептора, которое, в зависимости от класса рецептора, запускает каскад последующих событий, направляющих ЯР к сайтам регуляции транскрипции ДНК, что приводит к усилению или понижению регуляции экспрессии генов. Обычно они действуют как гомо / гетеродимеры.[9] Кроме того, были идентифицированы два дополнительных класса: тип III, который является вариантом типа I, и тип IV, которые связывают ДНК в виде мономеров.
По механизму работы ядерные рецепторы делятся на четыре класса:
Тип I
Связывание лиганда с ядерными рецепторами I типа в цитозоле приводит к диссоциации белков теплового шока, гомодимеризации, транслокации (т.е. активному переносу) из цитоплазмы в ядро клетки и связыванию со специфическими последовательностями ДНК, известными как элементы гормонального ответа. (HRE). Ядерные рецепторы типа I связываются с HRE, состоящими из двух полусайтов, разделенных ДНК переменной длины, и второй полусайт имеет последовательность, инвертированную по сравнению с первым (инвертированный повтор). Ядерные рецепторы типа I включают членов подсемейства 3, таких как андрогеновые рецепторы, эстрогеновые рецепторы, глюкокортикоидные рецепторы, рецепторы прогестерона.
Было отмечено, что некоторые из ядерных рецепторов подсемейства 2 могут связываться с прямым повтором вместо HRE с инвертированным повтором. Кроме того, некоторые ядерные рецепторы связываются либо как мономеры, либо как димеры, при этом только один ДНК-связывающий домен рецептора присоединяется к одному полусайту HRE. Эти ядерные рецепторы считаются орфанными рецепторами, поскольку их эндогенные лиганды до сих пор неизвестны.
Комплекс ядерный рецептор / ДНК затем привлекает другие белки, которые транскрибируют ДНК ниже HRE в информационную РНК и, в конечном итоге, в белок, что вызывает изменение функции клетки.
Тип II
Рецепторы типа II, в отличие от типа I, сохраняются в ядре независимо от статуса связывания лиганда и, кроме того, связываются с ДНК в виде гетеродимеров (обычно с RXR). В отсутствие лиганда ядерные рецепторы типа II часто образуют комплексы с корепрессорными белками. Связывание лиганда с ядерным рецептором вызывает диссоциацию корепрессора и рекрутирование белков-коактиваторов. Дополнительные белки, включая РНК-полимеразу, затем привлекаются к комплексу ЯР / ДНК, который транскрибирует ДНК в информационную РНК.
Ядерные рецепторы типа II включают в основном подсемейство 1, например рецептор ретиноевой кислоты, ретиноидный X-рецептор и рецептор тиреоидных гормонов.
Тип III
Ядерные рецепторы типа III (в основном ЯР подсемейства 2) подобны рецепторам типа I в том, что оба класса связываются с ДНК как гомодимеры. Однако ядерные рецепторы типа III, в отличие от типа I, связываются с прямым повтором вместо HRE с инвертированным повтором.
Тип IV
Ядерные рецепторы типа IV связываются как мономеры или димеры, но только один ДНК-связывающий домен рецептора связывается с одним полусайтом HRE. Примеры рецепторов типа IV встречаются в большинстве подсемейств NR.
Remove ads
Альтернативные механизмы
Суммиров вкратце
Перспектива
Трансрепрессия
Наиболее распространенный механизм действия ядерного рецептора включает прямое его связывание я с элементом гормонального ответа ДНК. Этот механизм называется трансактивацией. Однако некоторые ядерные рецепторы обладают способностью напрямую связываться не только с ДНК, но и с другими факторами транскрипции. Это связывание часто приводит к дезактивации второго фактора транскрипции в процессе, известном как трансрепрессия. Одним из примеров ядерного рецептора, который способен трансрепрессировать, является глюкокортикоидный рецептор (GR). Кроме того, некоторые лиганды GR, известные как селективные агонисты глюкокортикостероидных рецепторов (англ. selective glucocorticoid receptor agonists (SEGRA)), способны активировать глюкокортикоиды таким образом, что GR сильнее трансрепрессирует, чем трансактивирует. Эта селективность увеличивает разделение между желаемыми противовоспалительными эффектами и нежелательными метаболическими побочными эффектами этих селективных глюкокортикоидов.[10]
Негеномный механизм
Классическое прямое влияние ядерных рецепторов на регуляцию генов обычно занимает несколько часов, прежде чем функциональный эффект проявляется в клетках — из-за большого количества промежуточных этапов между активацией ядерных рецепторов и изменениями уровней экспрессии белка. Однако было замечено, что многие эффекты применения ядерных гормонов, такие как изменения активности ионных каналов, происходят в течение нескольких минут, что несовместимо с классическим механизмом действия ядерных рецепторов. Хотя молекулярная мишень для этих негеномных эффектов ядерных рецепторов не была окончательно продемонстрирована, была выдвинута гипотеза, что существуют варианты ядерных рецепторов, которые связаны с мембраной, а не локализованы в цитозоле или ядре. Кроме того, эти ассоциированные с мембраной рецепторы функционируют посредством альтернативных механизмов передачи сигнала, не связанных с регуляцией генов.
Хотя было высказано предположение, что существует несколько мембранно-ассоциированных рецепторов ядерных гормонов, было показано, что для многих быстрых эффектов требуются канонические ядерные рецепторы. Однако исследованиям геномных и негеномных механизмов in vivo препятствует отсутствие специфических молекулярных механизмов негеномных эффектов, которые могут быть заблокированы мутацией рецептора без нарушения его прямого воздействия на экспрессию генов.
Молекулярный механизм негеномной передачи сигналов через ядерный рецептор тиреоидных гормонов TRβ включает фосфатидилинозитол-3-киназу (PI3K). Эта передача сигналов может быть заблокирована одной заменой тирозина на фенилаланин в TRβ без нарушения прямой регуляции гена. Этот механизм, по-видимому, сохраняется у всех млекопитающих, но не в TRα или каких-либо других ядерных рецепторах. Таким образом, фосфотирозин-зависимая ассоциация TRβ с PI3K обеспечивает потенциальный механизм интеграции регуляции развития и метаболизма тиреоидным гормоном и рецепторными тирозинкиназами. Кроме того, передача сигналов гормона щитовидной железы через PI3K может изменять экспрессию генов[11].
Remove ads
Димеризация
Как было показано в крупномасштабных экспериментах с двугибридным анализом, ядерные рецепторы человека способны димеризоваться со многими другими ядерными рецепторами (гомотипическая димеризация)[12][13]. Тем не менее, существует специфичность: члены одного и того же подсемейства имеют очень схожие партнеры по димеризации ЯР, а лежащая в основе сеть димеризации имеет определенные топологические особенности, такие как наличие высокосвязных концентраторов (RXR и SHP).
Remove ads
Корегуляторные белки
Суммиров вкратце
Перспектива
Ядерные рецепторы, связанные с элементами гормонального ответа, привлекают значительное количество других белков (называемых корегуляторами транскрипции), которые облегчают или ингибируют транскрипцию связанного гена-мишени в мРНК. Функции этих корегуляторов разнообразны и включают ремоделирование хроматина (делая целевой ген более или менее доступным для транскрипции) или мостиковую функцию для стабилизации связывания других корегуляторных белков. Ядерные рецепторы могут специфически связываться с рядом белков-корегуляторов и, таким образом, влиять на клеточные механизмы передачи сигнала как прямо, так и косвенно[14].
Коактиваторы
Связывание лигандов-агонистов (см. раздел ниже) с ядерными рецепторами индуцирует конформацию рецептора, который предпочтительно связывает белки-коактиваторы. Эти белки часто обладают внутренней активностью гистонацетилтрансферазы (HAT), которая ослабляет ассоциацию гистонов с ДНК и, следовательно, способствует транскрипции генов.
Корепрессоры
Связывание лигандов-антагонистов с ядерными рецепторами, напротив, индуцирует конформацию рецептора, которая предпочтительно связывает корепрессорные белки. Эти белки, в свою очередь, привлекают гистоновые деацетилазы (HDAC), что усиливает ассоциацию гистонов с ДНК и, следовательно, подавляет транскрипцию генов.
Remove ads
Агонизм и антагонизм
Суммиров вкратце
Перспектива
В зависимости от задействованного рецептора, химической структуры лиганда и ткани, которая подвергается воздействию, лиганды ядерного рецептора могут проявлять резко разнообразные эффекты в диапазоне от агонизма до антагонизма и до обратного агонизма.[15]
Агонисты
Активность эндогенных лигандов (таких как гормоны эстрадиол и тестостерон), когда они связаны с родственными им ядерными рецепторами, обычно приводит к усилению экспрессии генов. Эта стимуляция экспрессии гена лигандом называется ответом агониста. Агонистические эффекты эндогенных гормонов также могут имитироваться некоторыми синтетическими лигандами, например, противовоспалительным лекарственным средством дексаметазон. Лиганды-агонисты работают, индуцируя конформацию рецептора, которая способствует связыванию коактиватора (см. Верхнюю половину рисунка справа).
Антагонисты
Другие синтетические лиганды ядерных рецепторов не оказывают заметного влияния на транскрипцию генов в отсутствие эндогенного лиганда. Однако они блокируют действие агониста за счет конкурентного связывания с одним и тем же сайтом связывания в ядерном рецепторе. Эти лиганды называют антагонистами. Примером лекарственного средства антагонистического ядерного рецептора является мифепристон, который связывается с рецепторами глюкокортикоидов и прогестерона и, следовательно, блокирует активность эндогенных гормонов кортизола и прогестерона соответственно. Лиганды-антагонисты работают, индуцируя конформацию рецептора, которая предотвращает коактивацию и способствует связыванию корепрессора (см. Нижнюю половину рисунка справа)
Обратные агонисты
Наконец, некоторые ядерные рецепторы способствуют низкому уровню транскрипции генов в отсутствие агонистов (также называемой базовой или конститутивной активностью). Синтетические лиганды, которые снижают этот базальный уровень активности ядерных рецепторов, известны как обратные агонисты.[16]
Селективные модуляторы рецепторов
Ряд препаратов, которые действуют через ядерные рецепторы, проявляют агонистический ответ в одних тканях и антагонистический ответ в других тканях. Такое поведение может иметь существенные преимущества, поскольку оно позволяет сохранить желаемые полезные терапевтические эффекты лекарственного средства при минимизации нежелательных побочных эффектов. Лекарства с таким смешанным профилем действия агонистов / антагонистов называются селективными модуляторами рецепторов (SRM). Примеры включают селективные модуляторы андрогенных рецепторов (SARM), селективные модуляторы эстрогенных рецепторов (SERM) и селективные модуляторы рецепторов прогестерона (SPRM). Механизм действия SRM может варьироваться в зависимости от химической структуры лиганда и задействованного рецептора, однако считается, что многие SRM работают, способствуя конформации рецептора, которая тесно сбалансирована между агонизмом и антагонизмом. В тканях, где концентрация белков-коактиваторов выше, чем корепрессоров, равновесие смещено в сторону агонистов. И наоборот, в тканях, где преобладают корепрессоры, лиганд ведет себя как антагонист.[17]
Remove ads
Члены семейства
Remove ads
Примечания
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
