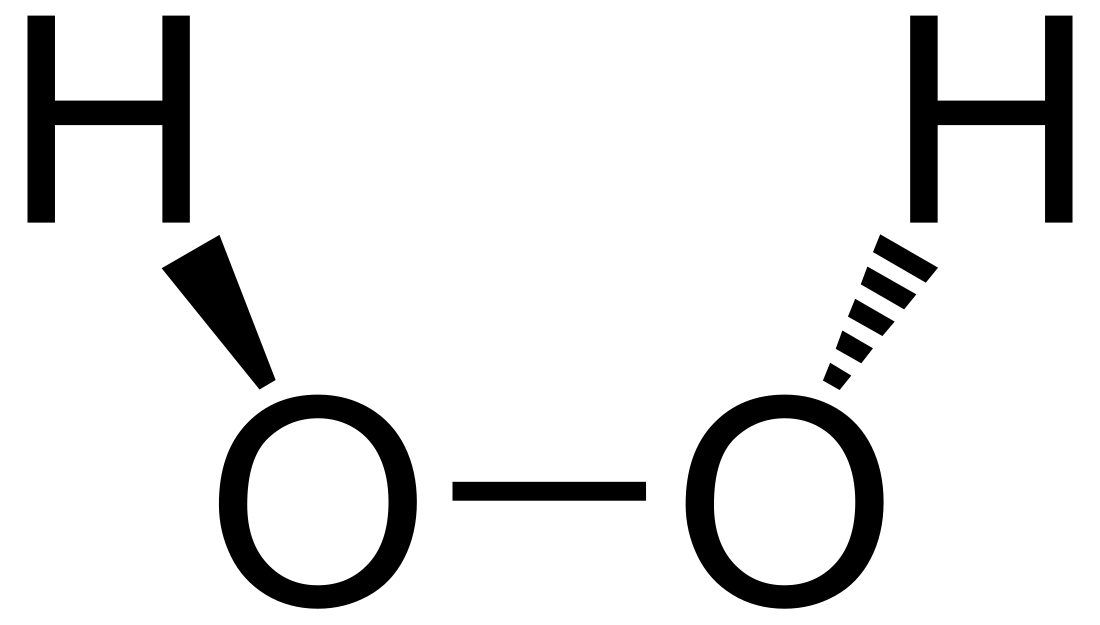Vodonik peroksid
From Wikipedia, the free encyclopedia
Remove ads
Vodonik-peroksid (H2O2) je plavičasto, u razblaženoj formi bezbojno, tečno jedinjenje vodonika i kiseonika. U vodenim otopinama vodik-peroksid je slaba kiselina, koja disocira u dva stupnja. Metalni peroksidi se smatraju njegovim solima.[5][6]
Remove ads
Historija
Vodonik-peroksid je prvi put dobio Lui Žak Teral 1918. godine reakcijom barium-peroksida i azotne kiseline. Dodavanje hlorovodonične kiseline, a potom i kasnije isprobana reakcija sa sumpornom kiselinom, pokazala se kao posebno dobro rešenje jer se prilikom takve reakcije izdvaja barijum-sulfat.
Dobijanje
Pre se vodonik-peroksid dobijao uglavnom eletrolizom sumporne kiseline:
U laboratorijskim uslovima se dobija reakcijom peroksida sa kiselinama. Istorijski važan reagens je barium-peroksid, koji reaguje u rastvoru sumporne kiseline gradeći vodonik-peroksid i barium-sulfat:
- ΔfH0gas: −136,11 kJ/mol
- ΔfH0liq: −188 kJ/mol
- ΔfH0sol: −200 kJ/mol
Remove ads
Upotreba
Upotrebljava se za izbjeljivanje (ponajčešće kose), kao antiseptik, u kemijskoj industriji, a upotrebljavao se kao oksidans za raketno gorivo. Danas vodonik sulfid predstavlja ozbiljnu energetsku silu koja ce naici na veliku primenu u razvoju tehnologije raketnih pogona.
U prodaju dolazi u koncentracijama od 3,6,9,12, i 30% (takva koncentracija se naziva komercijalno i "Perhidrol").
Povezano
Izvori
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads