சீரியம்
From Wikipedia, the free encyclopedia
Remove ads
சீரியம் (Cerium) என்பது Ce என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு தனிமம் ஆகும். இதனுடைய அணுஎண் 58 ஆகும். சீரியத்தில் தொடங்கி லித்துவேத்தியம் வரையுள்ள 14 தனிமங்களும் லாந்தனைடுகள் எனப்படுகின்றன. இவை யாவும் இலந்தனம் தனிமத்துடன் நெருங்கிய தொடர்பு கொண்டிருப்பதால் லாந்தனைடுகள் எனப்படுகின்றன.
Remove ads
பண்புகள்
சீரியம் பார்ப்பதற்கு வெள்ளியைப் போல வெண்மையான தனிமமாகும். மென்மையான இதை கத்தியால் வெட்டலாம். தகடாகவும் அடிக்கலாம். கம்பியாகவும் நீட்டலாம். காற்றில் படநேர்ந்தால் இது தன் பளபளப்பை இழக்கிறது. லாந்தனைடு தொடரில் இரண்டாவது தனிமமான இது +3 என்ற ஆக்சிசனேற்ற நிலையை வெளிப்படுத்துகிறது. விதிவிலக்காக சீரியம் +4 என்ற ஆக்சிசனேற்ற நிலையிலும் நிலைப்புத்தன்மை கொண்டு நீரை ஆக்சிசனேற்றம் செய்யாத தன்மையை வெளிக்காட்டுகிறது. உயிரினச் செயல்பாடுகள் எதையும் சீரியம் கொண்டிருக்கவில்லை. மிகுந்த நச்சுத்தன்மை கொண்ட தனிமமாகவும் இது இல்லை.
மோனசைட்டு மற்றும் பாசுடனசைட்டு போன்ற கனிமங்களில் மற்ற அரிய-மண் தனிமங்களுடன் எப்பொழுதும் கலந்தே காணப்பட்ட போதிலும் சீரியத்தை அதன் தாதுகளிலிருந்து பிரித்தெடுப்பது எளிதான செயலாகும். ஏனெனில் அதன் தனித்தன்மையான +4 என்ற ஆக்சிசனேற்ற நிலை இதை எளிதாக பிரித்தெடுக்க உதவுகிறது. சீரியத்தைப் போல நியோடிமியம், இலந்தனம், பிரசியோடைமியம் போன்ற தனிமங்களும் லாந்தனைடுகளில் பொதுவானவையாகும். புவி மேலோட்டில் மில்லியனுக்கு 66 பகுதிகள் என்ற அளவில் சிரியம் காணப்படுகிறது. அதிகமாகக் காணப்படும் தனிமங்கள் வரிசையில் இதற்கு 26 ஆவது இடமாகும். குளோரின் அளவில் பாதியாகவும் ஈயத்தைக் காட்டிலும் இது ஐந்து மடங்கும் அதிகமாகும்.
சுவீடனிலுள்ள பாசுட்னாசில் 1803 ஆம் ஆண்டு யோன் யோக்கோபு பெர்சிலியசு மற்றும் வில்லெம் இசிங்கர் ஆகியோர் கண்டுபிடிக்கப்படவேண்டிய லாந்தனைடுகளில் முதலாவதாக சீரியத்தைக் கண்டுபிடித்தனர். மார்ட்டின் எயின்ரிச் கிளாப்ரோத் செருமனியில் இதைத் தனியாகக் கண்டறிந்தார். 1839 இல் காரல் குசுடாப் மசாண்டர் சீரியத்தை தனித்துப் பிரித்தெடுத்தார். இன்று சீரியமும் அதன் சேர்மங்களும் பல்வேறு பயன்களைக் கொண்டிருக்கின்றன. உதாரணமாக சீரியம்(IV) ஆக்சைடு பளபளப்பான கண்ணாடிகளிலும் வினைவேக மாற்ரியாகவும் பயன்படுத்தப்படுகிறது. சீரியம் உலோகம் பெர்ரோசீரியம் தீமூட்டிகளில் அதனுடைய தானே பற்றிக் கொள்ளும் பண்புக்காகப் பயன்படுத்தப்படுகிறது.
இயற்பியல் பண்புகள்
லாந்தனைடு தொடரில் சீரியம் இரண்டாவது தனிமமாகும். தனிமவரிசை அட்டவணையில் இதன் இடப்புறத்தில் இலந்தனமும் வலப்புறத்தில் பிரசியோடிமியமும் இடம்பெற்றுள்ளன. இதற்கு மேலே ஆக்டினைடான தோரியம் இடம்பெற்றுள்ளது. கம்பியாக நீட்சியடையும் தன்மையை சீரியம் கொண்டிருக்கிறது. இதனுடைய கடினத்தன்மை வெள்ளியை ஒத்ததாக உள்ளது. சீரியத்தின் 58 எலக்ட்ரான்களும் [Xe]4f15d16s2 என்ற எலக்ட்ரான் அமைப்பில் நிரம்பியுள்ளன. வெளிக்கூட்டில் உள்ள 4 எலக்ட்ரான்களும் இணைதிறன் எலக்ட்ரான்களாகும். இலந்தனத்திற்கு அடுத்ததாக உள்ள 4f ஆர்பிட்டல்கள் திடீரென ஒடுங்கி சுருங்குகிறது. இணைதிற எலக்ட்ரான்களின் மீது உட்கருவின் ஈர்ப்பு அதிகரிப்பதால் கூடு ஒடுங்குகிறது அல்லது சுருங்குகிறது. இதனால் அணுப்பருமன் குறைந்து கொண்டே செல்கிறது. இருப்பினும் இவ்விளை சீரியத்தில் போதுமான அளவுக்கு வலிமையாய் இல்லை. எனவே இங்கு 5d துணை ஆர்பிட்டால் நிரம்புகிறது[1]. எஞ்சியிருக்கும் 4f எலக்ட்ரான்கள் மிக வலிமையுடன் பிணைக்கப்பட்டிருப்பதால் பெரும்பாலான லாந்தனைடுகள் மூன்று எலக்ட்ரான்களையே இணைதிறன் எலக்ட்ரான்களாக பயன்படுத்துகின்றன. சீரியம் மட்டும் இதற்கு விதிவிலக்காகும். +4 ஆக்சிசனேற்ற நிலையில் சீரியம் உள்ளது.
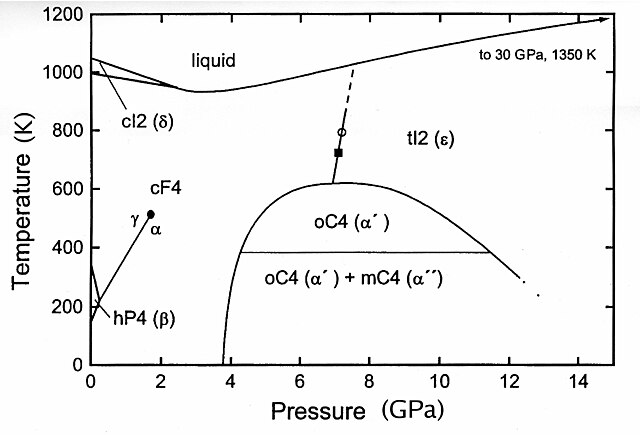
திட்ட அழுத்தத்தில் சீரியத்திற்கு நான்கு புறவேற்றுமை வடிவங்கள் உள்ளன. α முதல் δ: வரையிலான பெயர்கள் அவற்றுக்கு இடப்பட்டுள்ளன :[2].
- உயர்வெப்பநிலை வடிவம், δ-சீரியம்- உடல்மைய்ய கனசதுரப் படிக வடிவத்தில் இது காணப்படுகிறது. 726 °செல்சியசு வெப்பநிலைக்கு மேல் இது காணப்படுகிறது.
- நிலையான வடிவம், γ-சீரியம் தோராயமாக அறை வெப்பநிலையில் இது காணப்படுகிறது. முகமையா கனசதுரப் படிக வடிவத்தில் இது உள்ளது.
- சீரியம் இரட்டை அறுகோண நெருக்கப் பொதிவு கட்டமைப்பில் இது காணப்படுகிறது. அறை வெப்பநிலையிலிருந்து -150 பாகை செல்சியசு வெப்பநிலையில் இது காணப்படுகிறது.
- முகமைய்ய கனசதுர வடிவில் காணப்படும் α-சீரியம் நான்காவது புறவேற்றுமை வடிவமாகும். -150 பாகை செல்சியசு வெப்பநிலைக்கும் கீழ் இது காணப்படுகிறது. இதனுடைய அடர்த்தி 8.16கி/செமீ3 ஆகும்.
- உயர் அழுத்தத்தில் இதர திண்மநிலை சீரியம் வடிவங்கள் காணப்படுவதை அருகிலுள்ள நிலை வரைபடம் காட்டுகிறது. சமநிலை மாறு வெப்பம் 75 பாகை செல்சியசு எனக் கருதப்படுகிறது [2].
வேதிப்பண்புகள்
காரக்கனிம மாழைகளில் ஐரோப்பியம் என்னும் தனிமத்திற்கு அடுத்தாற்போல அதிக வேதியியல் வினையுறுந் தன்மை உடைய தனிமம். காற்று பட்டால் மங்கி விடுகின்றது. மென் காரக் கரைசல்களாலும், மென் மற்றும் கடும் காடிகளாலும் தாக்குறுகின்றது. குளிர்ந்த நீரில் இருந்தால் சீரியம் மெதுவாக ஆக்ஸைடாகும். தூய சீரியத்தை காற்றுபடும் இடத்தில் வைத்து கீறினால் தீப்பிடிக்கக்கூடும்.

சீரியம் (IV) (சீரிக் ceric) உப்புகள் மஞ்சள் கலந்த சிவப்பாகவோ மஞ்சளாகவோ காணப்படும், ஆனால் சீரியம் (III) (சீரஸ் cerous) உப்புகள் வெண்மையாகவோ நிறமில்லாமலோ இருக்கும். இரண்டு ஆக்ஸைடாகும் நிலைகளில் உள்ளவையும் புற ஊதாக்கதிர்களை நன்றாக உள்ளேற்கின்றன. கண்ணாடிகளில் சீரியம் (III) சேர்த்தால் கண்ணாடியின் ஒளியூடுருவும் பண்பை மாற்றாமல் புற ஊதாக்கதிர்களை உள்ளேற்று கடத்தாமல் தடுக்க உதவுகின்றது. எனவே புற ஊஉதாக்கதிர்களின் வடிகட்டியாக பயன்படுகின்றது. அரிதாக கிடைக்கும் காரக்கனிம கலவைகளில் சீரியம் இருந்தால் அதனை எளிதாக ஒரு சோதனை மூலம் கண்டுபிடிக்கலாம். அமோனியாவும் ஹைட்ரஜன் பெராக்ஸைடும் லாந்த்தனைடு கரைசலில் சேர்த்து அக்கலவையுடன் கூட்டினால், சீரியம் அதில் இருந்தால் கரும் பழுப்பு நிறம் தோன்றும்.
Remove ads
கனிமங்கள்
காரக்கனிம தனிமங்களிலேயே மிக அதிகமாகக் கிடைக்கும் தனிமம் சீரியம்தான். இது நில உருண்டையின் புற ஓட்டின் எடையில் 0.0046% ஆகும். சீரியம் கிடைக்கும் கனிமங்கள்: அல்லனைட் (allanite) அல்லது (ஆர்த்தைட்) என்றழைக்கப்படும் கனிமம் —(Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH), மோனசைட்டு (monazite) (Ce, La, Th, Nd, Y)PO4, பாசுட்னசைட்டு (bastnasite) (Ce, La, Y)CO3F, ஹைட்ராக்ஸைல்பாஸ்ட்னாசைட்(hydroxyl)(bastnasite) (Ce, La, Nd)CO3(OH, F), ராப்டொஃவேன்(rhabdophane) (Ce, La, Nd)PO4-H2O, சிர்க்கோன்(zircon) (ZrSiO4), சின்ச்சிசைட் (synchysite) Ca(Ce, La, Nd, Y)(CO3)2F ஆகும்.மோனாசைட்டும் பாசுட்னசைட்டும் சீரியம் பெறுவதற்கு தற்பொழுது இரண்டு முதன்மையான கனிமங்களாகும்.
மோனசைட்டு கனிமம் மோனசைட்டு மணல் என்றும் அழைக்கப்படுகிறது. இது சீரியம் மற்றும் இலந்தனம் ஆகியவற்றின் ஆர்த்தோபாசுப்பேட்டுகளும் தோரியாவும் கொண்ட கலவையாகும். தோரியத்தை தயாரிக்க இது பெருமளவில் பயன்படுகிறது.சீரியத்தின் நீரேற்றம் பெற்ற சிலிக்கேட்டு சீரைட்டு எனப்படுகிறது. பாசுட்டனசைட்டில் சிறிதளவு தோரியம் காணப்படுகிறது.
Remove ads
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


