கிடை வரிசை (தனிம அட்டவணை)
From Wikipedia, the free encyclopedia
Remove ads
தொடர் ( period ) என்பது நீள்வடிவத் தனிம வரிசை அட்டவணையில் இடமிருந்து வலமாகச் செல்லும் கிடைமட்ட வரிசைகளில் ஒன்றாகும். ஒரு தொடர் வரிசையில் உள்ள எல்லா தனிமங்களும் ஒரே எண்ணிக்கையிலான எலக்ட்ரான் கூடுகளைப் பெற்றுள்ளன. ஒரு தொடரில் இடமிருந்து வலமாகச் செல்கையில் ஒவ்வொரு தனிமமும் ஒரு புரோட்டானை அதிகமாகப் பெறுகின்றன. ஒவ்வொரு தனிமத்தின் உலோகப்பண்பும் முன்னதாக உள்ள தனிமத்தைக் காட்டிலும் குறைகிறது. இதேபோல தனிம வரிசை அட்டவனையில் மேலிருந்து கீழாக அமைக்கப்பட்டுள்ள செங்குத்து வரிசைகள் தொகுதிகள் எனப்படுகின்றன. ஒரு தொகுதியில் இடம்பெற்றுள்ள தனிமங்கள் அவற்ரின் இணைதிரன் கூட்டில் ஒரே எண்ணிக்கையில் எலக்ட்ரான்களைப் பெற்றுள்ளன. ஒரே இணைதிற்னையும் பெற்றுள்ளன. ஒரு தொகுதியில் அடுக்கப்பட்டுள்ள அனைத்துத் தனிமங்களும் ஒரே மாதிரியான இயற்பியல் மற்றும் வேதியல் பண்புகளைப் பெற்றுள்ளன. உதாரணமாக கார உலோகங்கள் முதல் தொகுதியில் அடுக்கப்பட்டுள்ளன. அதிக வினைத்திறன் மற்றும் மந்த வாயு எலக்ட்ரான் அமைப்பை அடைய ஓர் எலக்ட்ரானை இழத்தல் உட்பட ஒரே மாதிரியான பண்புகள் பலவற்றைப் பெற்றுள்ளன. 2016 ஆம் ஆண்டின் படி இதுவரை 118 தனிமங்கள் கண்டுபிடிக்கப்பட்டு தனிமவரிசை அட்டவனையில் அவற்றின் இடங்களும் உறுதிபடுத்தப்பட்டுள்ளன.
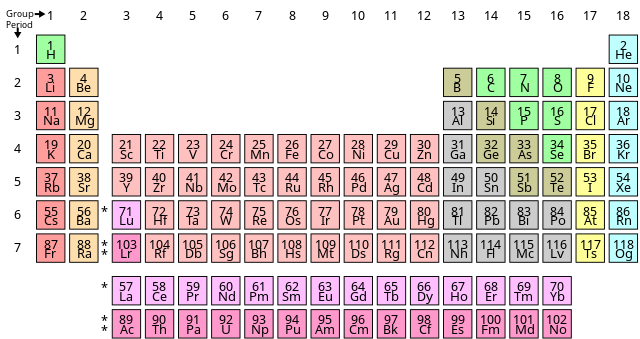
நவீன ஆவர்த்தன விதியின்படி தனிமங்களை அவற்றின் அணு எண்களின் ஏறுவரிசையில் அமைத்தால் ஒத்த பண்புகளை உடைய தனிமங்கள் சீரான் இடைவெளிக்குப் பின் அமைகின்றன. தற்கால குவாண்டம் இயங்கியல் கோட்பாடுகளின்படி ஒரு தொடரில் அணு எண் உயர்வதற்கு ஏற்ப அவற்றின் ஆற்றல் கூடுகள் எலக்ட்ரான்களால் ஒரு மந்தவாயு அமைப்பு வரும்வரை முறையாக நிரப்பப்படுகின்றன. ஒவ்வொரு எலக்ட்ரான் கூடும் பூர்த்தி செய்யப்பட்டுக் கொண்டே வருவதை அட்டவணையில் உள்ள தொடர்கள் காட்டுகின்றன.

தனிம வரிசை அட்டவணையில் அமைந்துள்ள எசு தொகுதி மற்றும் பி தொகுதி தனிமங்கள் ஒரே தொடருக்குள் இருக்கும் போது பொதுவாக ஆவர்த்தன போக்கையும் பண்புகளில் ஒற்றுமையையும் காட்டுவதில்லை. மேலிருந்து கிழாகச் செல்லும் தொகுதிகளில் உள்ள தனிமங்கள் இப்பண்புகளை வெளிப்படுத்துகின்றன. இருப்பினும் டி தொகுதி தனிமங்கள் தொடர்களில் இந்த பண்புகளை வெளிப்படுத்துகின்றன. அதேபோல எப் பிரிவு தனிமங்கள் தொடர்களில் அதிக அளவு ஒற்றுமையை காட்டுகின்றன. இயற்கையில் தோன்றிய தனிமங்கள் தனிம வரிசை அட்டவனையின் ஏழு தொடர்களில் இடம்பெற்றுள்ளன. எட்டாவது தொடரில் உள்ள தனிமங்கள் செயற்கை முறையில் தயாரிக்கப்பட்டவை ஆகும். குறிப்பாக 2016 ஆம் ஆண்டுக்கு பின்னால் தயாரிக்கப்பட்டவை ஆகும். இடமிருந்து வலமாகச் செல்லும் கிடைமட்ட வரிசைகள் தொடர்கள் எனப்படுகின்றன. தனிம வரிசை அட்டவணையில் ஏழு தொடர்கள் உள்ளன.
Remove ads
முதல் தொடர் மிகவும் குறுகிய தொடர் ஆகும். இதில் ஐதரசன் ஈலியம் என்ற இரண்டு தனிமங்கள் மட்டுமே உள்ளன. எனவே இங்கு எண்ம விதி பின்பற்றப்படவில்லை. ஈலியம் மந்த வாயுவாக செயல்படுகிறது. எனவே இது 18 ஆவது தொகுதியின் உறுப்பினராகக் கருதப்படுகிறது. அணுக்கட்டமைப்பைப் பொறுத்தவரையில் இவை எசு தொகுதி தனிமங்கள் ஆகும். எனவே சில சன்மயங்களில் ஈலியத்தை 2 ஆவது தொகுதி தனிமம் என்பர். அல்லது 2,18 ஆவது தொகுதி தனிமம் என்பர். ஐதரசன் ஒரு எலக்ட்ரானை இழக்கவும் பெறவும் செய்கிறது என்பதால் அதை 1 மற்றும் 17 ஆவது தொகுதி தனிமம் என்பர்.
- ஐதரசன் (H) என்பது வேதியியல் தனிமங்களில் அதிகமாகக் காணப்படும் தனிமம் ஆகும். மிகவும் இலேசான தனிமம் ஆகும். இது பிரபஞ்சத்தின் அடிப்படை தனிமங்களில் 75% ஆகும் [1]. தனிமநிலை ஐதரசன் ஒப்பீட்டளவில் அரிதானது ஆகும். மீத்தேன் போன்ற ஐதரோ கார்பன்களில் இருந்து தொழிற்துறையில் இது தயாரிக்கப்படுகிறது. பெரும்பாலான தனிமங்களுடன் சேர்ந்து சேர்மங்களை உருவாக்கும். நீர் மற்றும் கரிமச் சேர்மங்களில் அதிக அளவில் உள்ளது [2]
- ஈலியம் (He) ஒரு வாயுவாக உள்ளது..[3] இரண்டாவது அதிக அளவில் கிடைக்கும் தனிமம் ஈலியம் ஆகும்.[4] பெரு வெடிப்பில் உருவானது. விண்மீன்களில் அணுக்கரு இணைவு மூலம் புதிய ஈலியம் தோன்றுகிறது..[5]
Remove ads
இரண்டாவது தொடர்: அணு எண் 3 முதல் அணு எண் 10 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இதுவும் ஒரு குறுகிய தொடர் ஆகும். இலித்தியம் தொடங்கி நியான் வரை 8 தனிமங்கள் உள்ளன.
மூன்றாவது தொடர்: அணு எண் 11 முதல் 18 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இதுவும் ஒரு குறுகிய தொடர் ஆகும். சோடியம் தொடங்கி ஆர்கான் வர உள்ள 8 தனிமங்கள் இத்தொடரில் இடம்பெற்றுள்ளன.
நான்காவது தொடர்: அணு எண் 19 முதல் 36 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இது ஒரு நீண்ட தொடர் ஆகும். பொட்டாசியம் முதல் கிரிப்டான் வரை 18 தனிமங்கள் இத்தொடரில் உள்ளன. இதில் எட்டு எளிய தனிமங்களும் 10 இடைநிலைத் தனிமங்களும் காண்ப்படுகின்றன.
Remove ads
ஐந்தாவது தொடர்: அணு எண் 37 முதல் 54 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இது ஒரு நீண்ட தொடர் ஆகும். ருபீடியம் முதல் செனான் வரை 18 தனிமங்கள் இத்தொடரில் உள்ளன. இதில் எட்டு எளிய தனிமங்களும் 10 இடைநிலைத் தனிமங்களும் காண்ப்படுகின்றன.
Remove ads
ஆறாவது தொடர்: அணு எண் 55 முதல் 86 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இது ஒரு மிகவும் நீண்ட தொடர் ஆகும். சீசியம் முதல் ரேடான் வரை 32 தனிமங்கள் இத்தொடரில் உள்ளன. இதில் எட்டு எளிய தனிமங்களும் 10 இடைநிலைத் தனிமங்களும் பதினான்கு உள் இடைத் தனிமங்களும் (லாந்தனைடுகள்) காணப்படுகின்றன.
Remove ads
ஏழாவது தொடர்: அணு எண் 87 முதல் 118 வரை உள்ள தனிமங்கள் இடம்பெற்றுள்ளன. இது ஒரு மிகவும் நீண்ட தொடர் ஆகும். ப்ரான்சியம் முதல் 26 தனிமங்கள் இத்தொடரில் உள்ளன. எஞ்சியிருக்கும் 32 வரை தனிமங்கள் நிரப்பு இடம் ஒதுக்கப்பட்டுள்ளது.
Remove ads
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
