சோடியம் ஈத்தாக்சைடு
வேதிச் சேர்மம் From Wikipedia, the free encyclopedia
Remove ads
சோடியம் ஈத்தாக்சைடு (Sodium ethoxide) C2H5ONa என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் கரிம வேதியியல் சேர்மாகும். சோடியம் எத்தாக்சைடு, சோடியம் எத்தனாலேட்டு, சோடியம் எத்தைலேட்டு என்ற பெயர்களாலும் அறியப்படுகிறது. CH3CH2ONa என்ற கட்டமைப்பு வாய்ப்பாடும், NaOEt என்ற சுருக்க வாய்ப்பாடும் சோடியம் ஈத்தாக்சைடு என்ற அயனிக் கரிமச்சேர்மத்தையே குறிக்கின்றன. ஒரு வெள்ளையான திடப்பொருளாக காணப்பட்டாலும் தூய்மையற்ற மாதிரிகள் மஞ்சள் அல்லது பழுப்பு நிறத்தில் தோன்றுகின்றன. எத்தனால் போன்ற முனைவுக் கரைப்பான்களில் சோடியம் ஈத்தாக்சைடு கரைகிறது. பொதுவாக ஒரு வலுவான காரமாகப் பயன்படுத்தப்படுகிறது.[2]
Remove ads
தயாரிப்பு
நீரற்ற திடப்பொருளைத் தயாரிப்பதற்கு சில நடைமுறைகள் மட்டுமே பதிவாகியுள்ளன. அதற்கு பதிலாக, இப்பொருள் பொதுவாக எத்தனால் கொண்ட கரைசலில் தயாரிக்கப்படுகிறது. வணிக ரீதியாகக் கிடைக்கிறது. எத்தனாலில் உள்ள ஒரு கரைசலாகவும் கிடைக்கிறது. சோடியம் உலோகத்தை முழுமையான எத்தனாலுடன் சேர்த்து சூடுபடுத்துவதன் மூலம் ஆய்வகத்தில் சோடியம் ஈத்தாக்சைடு எளிதாகத் தயாரிக்கப்படுகிறது:[3]
2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
நீரற்ற எத்தனாலுடன் சோடியம் ஐதராக்சைடு வினைபுரியும் போது எத்தாக்சைடு முழுமையடையாமல் மாற்றமடைகிறது, ஆனால் அசிட்டோனைப் பயன்படுத்தி வீழ்படிவாக்குதல் மூலம்[4] அல்லது கூடுதல் NaOH காரத்தைப் பயன்படுத்தி உலர்த்துவதன் மூலம் உலர்ந்த NaOEt சேர்மத்தை உருவாக்க முடியும்.[5]
Remove ads
வினைகள்
சோடியம் ஈத்தாக்சைடு பொதுவாக கிளெய்சன் ஒடுக்கம்[6] மற்றும் மாலோனிக் எசுத்தர் தொகுப்பு வினை[7] ஆகியவற்றில் ஒரு காரமாகப் பயன்படுத்தப்படுகிறது. சோடியம் ஈத்தாக்சைடு ஓர் எசுத்தர் மூலக்கூறின் α-நிலை புரோட்டானை நீக்கி, ஓர் ஈனோலேட்டை உருவாக்கும் அல்லது எசுத்தர் மூலக்கூறு மாற்று எசுத்தராக்கல் எனப்படும் அணுக்கருநாட்ட மாற்றீட்டிற்கு உட்படும். தொடக்கப் பொருள் ஒரு எத்தில் எசுத்தராக இருந்தால், தயாரிப்பு தொடக்கப் பொருளுக்கு ஒத்ததாக இருப்பதால் மாற்று எசுத்தராக்கல் வினை பொருத்தமற்றதாகும். நடைமுறையில், ஆல்ககால்/ஆல்காக்சைடு கரைக்கும் கலவையானது வெவ்வேறு தயாரிப்புகளின் எண்ணிக்கையைக் குறைக்க வினைபுரியும் எசுத்தகளின் ஆல்காக்சி கூறுகளுடன் கண்டிப்பாகப் பொருந்த வேண்டும்.
சோடியம் ஈத்தாக்சைடில் இருந்து உப்பு இரட்டை இடப்பெயர்ச்சி வினை மூலம் பல ஆல்காக்சைடுகள் தயாரிக்கப்படுகின்றன.
Remove ads
கட்டமைப்பு
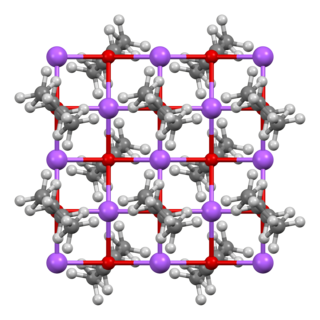
சோடியம் ஈத்தாக்சைட்டின் படிக அமைப்பு எக்சு-கதிர் படிகவியல் மூலம் தீர்மானிக்கப்பட்டுள்ளது. இக்கட்டமைப்பில் ஒவ்வோர் அடுக்கின் மேல் மற்றும் கீழ் பகுதியும் ஒழுங்கற்ற எத்தில் குழுக்கள் அடங்கிய Na+ மற்றும் O− மையங்கள் மாறி மாறி அமைந்துள்ள அடுக்குகளைக் கொண்டுள்ளது. எத்தில் அடுக்குகள் ஒன்றன் பின் ஒன்றாக அடுக்கி வைக்கப்பட்டு, தகடுகளால் ஆன ஓர் அமைப்பு ஏற்படுகிறது. சோடியம் மற்றும் எத்தனால் ஆகியவற்றின் வினை சில நேரங்களில் கரையும் CH3CH2ONa·2CH3CH2OH போன்ற பிற தயாரிப்புகளையும் உருவாக்குகிறது. இதன் படிக அமைப்பு தீர்மானிக்கப்பட்டுள்ளது, இருப்பினும் CH3CH2ONa/CH3CH2OH அமைப்பில் உள்ள மற்ற கட்டங்களின் அமைப்பு தெரியவில்லை.[8]
 |  |  |
| சோடியம் ஈத்தாக்சைடு பந்துக்குச்சி மாதிரி | CH3CH2ONa சேர்மத்தில் சோடியம் அணு ஒருங்கிணைப்பு வடிவியல் | ஆக்சிசனில் ஒருங்கிணைப்பு வடிவியல் |
நிலைப்புத்தன்மை
சோடியம் ஈத்தாக்சைடு காற்றில் உள்ள நீர் மற்றும் கார்பன் டை ஆக்சைடு இரண்டுடனும் வினைபுரியும் தன்மை கொண்டது.[9] இதனால் சேமிக்கப்பட்ட மாதிரிகள், திண்ம வடிவத்திலும் கூட, காலப்போக்கில் சிதைவடைய வாய்ப்பு உள்ளது. சிதைந்த மாதிரிகளின் இயற்பியல் தோற்றம் வெளிப்படையாகத் தெரியாமல் இருக்கலாம், ஆனால் சோடியம் ஈத்தாக்சைட்டின் மாதிரிகள் சேமிப்பின் போது படிப்படியாகக் கருப்பாக மாறும். புதிதாகப் பெறப்பட்ட வணிக ரீதியான சோடியம் ஈத்தாக்சைடும் கூட மாறுபட்ட அளவிலான சிதைவைக் காட்டுவதாகவும், சுசுகி வினைகளில் பயன்படுத்தப்படும்போது மறுஉற்பத்தி செய்ய முடியாததற்கு முக்கிய ஆதாரமாக இருப்பதாகவும் தெரிவிக்கப்பட்டுள்ளது.[9]
- புதிய புட்டியில் சிக்மா ஆல்டிரிச்சு மூலம் தயாரிக்கப்பட்ட சோடியம் ஈத்தாக்சைடு.
- புதிதாகத் திறக்கப்பட்ட சோடியம் ஈத்தாக்சைடு கொள்கலன், ஆக்சிசன் மற்றும் கார்பன் டை ஆக்சைடுக்கு மேல் சேமிக்கப்படும் போது சிதைவதால் ஏற்படும் நிறமாற்றத்தைக் காட்டுகிறது.
ஈரப்பதமான காற்றில், சோடியம் ஈத்தாக்சைடு விரைவாக நீராற்பகுப்பு அடைந்து சோடியம் ஐதராக்சைடு (NaOH) ஆக மாறுகிறது. இந்த மாற்றம் வெளிப்படையாகத் தெரியாது. மேலும் சோடியம் ஈத்தாக்சைடின் வழக்கமான மாதிரிகள் NaOH உடன் மாசுபட்டுள்ளன.
ஈரப்பதம் இல்லாத காற்றில், திண்ம சோடியம் ஈத்தாக்சைடு காற்றிலிருந்து கார்பன் டை ஆக்சைடை நிலைநிறுத்துவதன் மூலம் சோடியம் எத்தில் கார்பனேட்டை உருவாக்கும். மேலும் நடைபெறும் வினை பல்வேறு சோடியம் உப்புகள் மற்றும் டை எத்தில் ஈதராக சிதைவதற்கும் வழிவகுக்கும்.
இந்த உறுதியற்ற தன்மையை சோடியம் ஈத்தாக்சைடை ஒரு மந்தவாயுச் சூழலில் (எ.கா., N2) சேமிப்பதன் மூலம் தடுக்கலாம்
Remove ads
மேலும் காண்க
பாதுகாப்பு
சோடியம் ஈத்தாக்சைடு ஒரு வலுவான காரமாகும், எனவே இது அரிக்கும் தன்மை கொண்டது.
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads