பொட்டாசியம் சயனைடு
From Wikipedia, the free encyclopedia
Remove ads
பொட்டாசியம் சயனைடு (Potassium cyanide) என்பது KCN என்ற மூலக்கூறு வாய்ப்பாடு உடைய ஒரு வேதிச் சேர்மம் ஆகும். இந்த நிறமற்ற படிக உப்பின் தோற்றம் சர்க்கரையை ஒத்துள்ளது, நீரில் அதிகளவு கரையும் திறன் உடையது. தங்கச் சுரங்கம், கரிமச் சேர்மங்கள் தொகுத்தல், மற்றும் மின் முலாம் பூசுதல் இவற்றி்ல் பெருமளவில் KCN பயன்படுத்தப்படுகிறது. அணிகலன்களை வேதிக் கலவையில் மூழ்கி மெருகேற்றலிலும் இது பயன்படுத்தப்படுகிறது.[4]
பொட்டாசியம் சயனைடு மிகவும் நச்சுத்தன்மை உடையதாகும். ஈரப்பதமுள்ள திண்ம KCN ஐ நீரார்பகுக்கும் போது சிறிதளவு ஐதரசன் சயனைடு வெளிவருகிறது. இது கசப்பான வாதுமை மணமுடையது. அனைவராலும் இதனை அறியமுடிவதில்லை. இதனை அறிவது மரபணு சார்ந்த பண்பாக உள்ளது.[5]
பொட்டாசியம் சயனைடின் சுவை என்பது காரத்துடன், எரியும் உணர்வினை கொண்டதாக விவரிக்கப்படுகறது.[6]
Remove ads
உற்பத்தி
நீர்த்த பொட்டாசியம் ஐதராக்சைடு கரைசலுடன் ஐதரசன் சயனைடு சேர்த்து வெற்றிடத்தில் ஆவியாக்கப்பட்டு KCN உற்பத்தி செய்யப்படுகிறது.[7]
- HCN + KOH → KCN + H2O
அல்லது பொட்டாசியம் ஐதராக்சைடு உடன் பார்மமைடு சேர்க்கும் போது KCN பெறப்படுகிறது.:
- HCONH2 + KOH → KCN + 2H2O
சுமார் 50,000 டன் பொட்டாசியம் சயனைடு வருடாந்திர உற்பத்தி செய்யப்படுகிறது.[4]
வரலாற்று உற்பத்தி
கிபி 1900 ஆம் ஆண்டுக்கு முன்னர், காஸ்ட்னர் செயல்முறை கண்டுபிடிப்பதற்கு முன்பு, பொட்டாசியம் சயனைடு கார உலோக சயனைடுகளின் மிக முக்கியமான ஆதாரமாக இருந்தது.[4] இந்த வரலாற்று செயல்பாட்டில், பொட்டாசியம் பெரோ சயனைடை சிதைவடையச் செய்து பொட்டாசியம் சயனைடு உற்பத்தி செய்யப்பட்டது:[8]
K4[Fe(CN)6] → 4 KCN + FeC2 + N2
Remove ads
கட்டமைப்பு
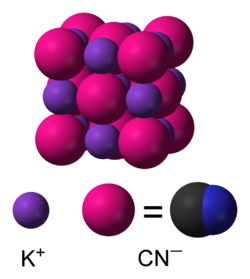
நீர்த்த கரைசலில் KCN, பொட்டாசியம் (K+) அயனிகளாகவும் மற்றும் சயனைடு (CN−) அயனிகளாகவும் பிரிகையடைகிறது. சுற்றுச்சூழல் அழுத்தம் மற்றும் வெப்பநிலையில் நிலையான திட வடிவத்தைப் பெற்ற KCN, சோடியம் குளோரைடு போன்றே கனசதுர படிக அமைப்பினைக் கொண்டு ஒவ்வொரு பொட்டாசியம் அயனிகளும் ஆறு சயனைடு அயனிகளால் சூழப்பட்டுள்ளது.சயனைடு அயனிகள் ஈரணு மூலக்கூறாக இருப்பினும், குளோரைடை விட குறைவான சமச்சீர் வடிவத்தைப் பெற்று, வேகமாக சுழற்சிக்கு உட்பட்டு கோள வடிவத்தைப் பெறுகிறது.குறை வெப்பநிலை மற்றும் உயர் அழுத்தத்தில், இந்த தடையற்ற சுழற்சி தடைசெய்யப்படுகிறது இதன் விளைவாக சயனைடு அயனிகள் குறைந்த சமச்சீர் படிக அமைப்பைப் பெறுகின்றன.[9][10]
Remove ads
பயன்பாடுகள்
- கரிமச் சேர்மங்கள் தொகுப்பு வினைகளில், நைட்ரைல்கள் மற்றும் கார்பாக்சிலிக் அமிலங்களை தயாரிப்பதற்கு பெருமளவு KCN மற்றும் சோடியம் சயனைடு (NaCN) பயன்படுத்தப்படுகின்றன. குறிப்பாக வான் ரிக்டர் வினைகளில் பயன்படுத்தப்படுகின்றன. ஐடன்டோன்சு (hydantoins) தொகுப்பு வினைகளில் அம்மோனியம் கார்பனேட்டு முன்னிலையில் ஆல்டிகைடு அல்லது கீட்டோடன் போன்ற கார்பனைல் சேர்மங்கள் வினைபுரிந்து பயன்மிக்க தொகுப்பு இடைநிலைப் பொருட்களைத் தருகின்றன.
- ஈரத்தட்டு கூழ்ம செயல்முறையில் புகைப்படத் திருத்தம் செய்வதற்கு KCN பயன்படுத்தப்படுகிறது.[11]. KCN மேம்படுத்திகளால் கரையாததாக தயாரிக்கப்படாததால் வெள்ளியில் கரைகிறது.நவீன ஈரத்தட்டு புகைப்படக்காரர்கள் குறைவான நச்சுக் கருவிகளைத் தேர்ந்தெடுக்கலாம்,பெரும்பாலும் குறைந்த நச்சுத்தன்மை உடைய சோடியம் தயோசல்பேட்டு தேர்வுசெய்யப்படுகிறது. ஆனால் KCN இன்றும் பயன்படுத்தப்படுகிறது.
பொட்டாசியம் தங்க சயனைடு
தங்க சுரங்கத்தில்,ஆக்சிஜன் (பொதுவாக சுற்றியுள்ள காற்று) மற்றும் தண்ணீர் முன்னிலையில் தங்க உலோகத்தில் இருந்து KCN நீரில் கரையக்கூடிய பொட்டாசியம் தங்க சயனைடு உப்பு (அல்லது தங்க பொட்டாசியம் சயனைடு) மற்றும் பொட்டாசியம் ஐதராக்சைடுகளைத் தருகிறது.
- 4 Au + 8 KCN + O2 + 2 H2O → 4 K[Au(CN)2] + 4 KOH
இம்முறையைப் போன்றே சோடியம் தங்க சயனைடு (NaAu(CN2)), NaCN லிருந்து தயாரிக்கப்படுகிறது.
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na[Au(CN)2] + 4 KOH
நச்சுத்தன்மை
பொட்டாசியம் சயனைடு என்பது செல்லுலார் சுவாசத்தினை தடைசெய்கிறது. இது மைட்டோகாண்ட்ரியல் சைட்டோக்ரோம் சி ஆக்சிடேசு மீது செயல்படுவதன் விளைவாக ஆக்சிசனேற்ற பாஸ்போரிலேசனை தடுக்கிறது. காற்றில்லா வளர்சிதை மாற்றத்தின் விளைவாக லாக்டிக் அசிடோசிஸ் உருவாகிறது. ஆரம்பத்தில், கடுமையான சயனைடின் நச்சுத்தன்மை பாதிக்கப்பட்டவருக்கு சிவப்பு அல்லது சிவப்பு நிறத்தை ஏற்படுத்துகிறது, ஏனெனில் திசுக்கள் இரத்தத்தில் ஆக்சிசன் பயன்படுத்த முடியாததேயாகும். பொட்டாசியம் மற்றும் சோடியம் சயனைடுகளின் விளைவுகள் ஒரே மாதிரியானவையாகும், மேலும் சயனைடை உட்கொண்ட ஒரு சில நிமிடங்களுக்குள்ளே நச்சு அறிகுறிகள் தோன்றி பாதிக்கப்பட்டவர் தனது நனவுநிலைைய இழந்து, இறுதியில் மூளை மரணம் ஏற்படுகிறது. இந்த காலகட்டத்தில் பாதிக்கப்பட்டவருக்கு வலிப்பு ஏற்படுகிறது. பெருமூளை இரத்தப்போக்கு காரணமாக மரணம் ஏற்படுகிறது.
பொட்டாசியம் சயனைடுக்கான மரண அபாயம் 200-300 மிகி ஆகும்.[12] இதனை உட்கொள்ளும்போது அதன் நச்சு வயிற்றின் அமிலத்தன்மையைப் பொறுத்தது. ஏனென்றால் அமிலத்துடன் ஐதரசன் சயனைடு வினைபுரிந்து, சயனைடு போன்ற கொடிய வடிவமாக மாறிவிடுகிறது. கிரிகோரி ரஸ்புடின் பிழைத்ததன் காரணம், பொட்டாசியம் சயனைடு நச்சுத்தன்மை உடையது எனினும், அவரது வயிற்று அமிலத்தன்மை அசாதாரணமாக குறைந்ததேயாகும்.[13]
இளம் பொசுனியா அமைப்பின் உறுப்பினர்கள், மற்றும் பிரபலமான பிரபலங்களான இர்வின் ரோமெல், இட்லரின் நீண்டகால தோழர் இவா பிரான், ஜோசப் கோயபெல்ஸ், ஐன்ரிச் இம்லர், எர்மன் கோரிங், இரண்டாம் உலகப் போரின் போது பிரித்தானிய உளவாளிகள் (தற்கொலை மாத்திரைகள் பயன்படுத்தினர்), கணினி அறிவியலாளர் அலன் டூரிங், பாலிமர் வேதியியலாளர் வாலஸ் கேராதர்சு, 19 ஆம் நூற்றாண்டின் செருமானிய வேதியியலாளர் விக்டர் மேயர்,[14] ஜோன் பி. மெக்லெமோ (S- நகரம் போட்காஸ்டின் பொருள்), மக்கள் கோயில் போன்ற பல்வேறு மத வழிபாட்டு தற்கொலைகள், தென்மார்க்கு எழுத்தாளர் குஸ்டாவ் வைட் மற்றும் விடுதலைப் புலிகள், ஆர்வர்டில் நோபல் பரிசு பெற்ற வேதியியலாளர் ஈ.ஜே.கோரி ஆய்வகத்தில் உள்ள மாணவரான ஜேசன் அல்ட்டோம் போன்ற பல முக்கிய நபர்கள் பொட்டாசியம் சயனைடு பயன்படுத்தி கொல்லப்பட்டனர் அல்லது தற்கொலை செய்து கொண்டனர்.
HCN புகை வெளிவந்த சில நொடிகளிலே பூச்சிகளால் உறிஞ்சப்பட்டு அவை கொல்லப்படுவதால் நிபுணத்துவம் வாய்ந்த நுண்ணுயிரியலாளர்களால் சாடிகளில் சேகரித்துப் பயன்படுத்தப்படுகிறது.
Remove ads
மேற்கோள்கள்
வெளி இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads