Acinetobacter baumannii
From Wikipedia, the free encyclopedia
Remove ads
Acinetobacter baumannii é unha especie bacteriana gramnegativa de forma curta e case arredondada (cocobacilos). Pode seu un patóxeno oportunista dos humanos, que afecta principalmente a persoas inmunocomprometidas, que se está a facer cada vez máis importante como causante de infeccións adquiridas en hospitais (nosocomiais). Aínda que outras especies do xénero Acinetobacter se atopan a miúdo en mostras do solo, A. baumannii non é un organismo habitual do solo, xa que se illa case exclusivamente en ambientes hospitalarios.[1] Aínda que ocasionalmente se ten illado en mostras medioambientais do solo e auga,[2] o seu hábitat natural aínda se descoñece. As bacterias deste xénero carecen de flaxelos, pero teñen unha motilidade ao retorcerse e sacudirse e presentan enxameamento. Isto pode deberse á actividade dos pili de tipo IV, que son estruturas como variñas que se poden retraer ou estender. A motilidade en A. baumannii pode deberse tamén á excreción de exopolisacáridos, que crean unha película de cadeas de azucres de alto peso molecular por detrás da bacteria para que esta se mova cara a adiante.[3] Os microbiólogos clínicos diferencian normalmente os membros do xénero Acinetobacter doutras Moraxellaceae realizando a proba da oxidase, xa que as Acinetobacter spp. son os únicos membros das moraxeláceas que carecen de citocromo c oxidases.[4] A. baumannii forma parte co complexo ACB (A. baumannii, A. calcoaceticus, e Acinetobacter especie xenómica 13TU). Os membros do complexo ACB son difíciles de determinar distinguindo as especies, e comprenden os membros clinicamente máis relevantes do xénero.[5][6] A. baumannii é pertence tamén ao grupo de patóxenos ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, e Enterobacter sp.), un grupo de patóxenos cun alto grao de resistencia a antibióticos que son responsables da maioría das infeccións nosocomiais.[7] Houbo unha epidemia significativa de cepas resistentes a antibióticos en instalacións sanitarias militares durante a guerra de Iraq.[8] As cepas resistentes a multifármacos de A. baumannii espalláronse tamén en hospitais civís.[3]
O nome da bacteria significa 'bacteria inmóbil de Baumann', do grego a, 'non', kineô, 'moverse', bakterion (neolatín bacteria), 'bastonciño (bacteria)', e en honor dos microbiólogos Paul e Linda Baumann.[9]
Remove ads
Factores e determinantes de virulencia
Moitos microbios, incluíndo A. baumannii, teñen varias propiedades que lles permiten ter máis éxito como patóxenos. Estas propiedades poden ser posuír factores de virulencia como toxinas ou sistemas de entrega de toxinas, que afectan directamente á céula hóspede. Poden tamén ser determinantes de virulencia, que son cualidades que contribúen á fitness do microbio e lle permiten sobrevivir no ambiente do hóspede, pero que non afectan ao hóspede directamente. As seguintes características son algúns dos factores que fan que A. baumannii sexa un patóxeno eficaz:
Illas de resistencia AbaR
As illas de patoxenicidade son estruturas xenéticas relativamente comúns en patóxenos bacterianos, que están compostas por dous ou máis xenes adxacentes que incrementan a virulencia do patóxeno. Poden conter xenes que codifican toxinas, coagulan o sangue, ou, como neste caso, permiten que a bacteria resista aos antibióticos. As illas e resistencia de tipo AbaR son típicas dos A. baumannii resistentes a fármacos, e poden estar presentes diferentes variantes nunha determinada cepa. Cada unha consiste nun esqueleto de transposón duns 16,3 Kb que facilita a transferencia horizontal de xenes. Os transposóns permiten que porcións do material xenético sexan escindidas dun lugar do xenoma e integradas noutro. Cando o material xenético é captado por unha nova bacteria, os transposóns permiten que a illa de patoxenicidade se integre no xenoma do novo microorganismo. Nese caso, garantiríase aos novos organismos o potencial de resistir certos antibióticos. Os AbaRs conteñen varios xenes para a resistencia a antibióticos, todos flanqueados por secuencias de inserción. Estes xenes proporcionan resistencia a aminoglicósidos, aminociclitois, tetraciclina, e cloranfenicol.[10][11]
Beta-lactamase
A. baumannii produce polo menos unha beta-lactamase, que é un encima responsable de clivar o anel lactama de catro átomos típico de antibióticos beta-lactámicos. Os antibióticos beta-lactámicos están estruturalmente relacionados coa penicilina, a cal inhibe a síntese da parede celular bacteriana. A clivaxe do anel lactámico fai que estes antibióticos sexan inofensivos para a bacteria. A beta-lactamase OXA-23 está flanqueada por secuencias de inserción, o que suxire que foi adquirida por transferencia horizontal de xenes.[12]
Formación de biopelículas
A. baumannii ten unha aparente capacidade de sobrevivir en superficies artificiais durante un longo período de tempo, o que lle permite persistir nos ambientes hospitalarios. Crese que isto se debe á súa capacidade de formar biopelículas.[13] Para moitas bacterias formadoras de biopelículas, o proceso está mediado polos flaxelos. Porén, en A. baumannii este proceso semella estar mediado polos pili. Ademais, a alteración de supostas chaperonas de pili e xenes acompañante csuC e csuE inhibe a formación de biopelículas.[14] A formación de biopelículas altera o metabolismo dos microorganismos dentro da biopelícula, e en consecuencia reduce a súa sensibilidade aos antibióticos. Isto pode deberse a que nas partes máis profundas das biopelículas hai unha menor dispoñibilidade de nutrientes. Un metabolismo máis lento pode impedir que a bacteria capte un antibiótico ou realice unha función vital o suficientemente rápido como para que un determinado antibiótico teña efecto. Tamén proporciona unha barreira física contra moléculas grandes e pode impedir o desecamento das bacterias.[2][15]
Cápsula
Moitas bacterias virulentas posúen a capacidade de xerar unha cápsula protectora arredor de cada célula. Esta cápsula, feita de longas cadeas de azucres, proporciona unha barreira física extra entre os antibióticos, anticorpos, e sistema do complemento. A asociación dun incremento da virulencia coa presenza dunha cápsula foi demostrada clasicamente no experimento de Griffith. Identificouse un clúster de xenes responsable da secreción da cápsula de polisacárido que inhibe o efecto antibiótico do complemento cando crecen en fluído da ascite. Demostrouse despois un decrecemento da mortalidade dos microorganismos asociada coa perda da produción da cápsula usando un modelo da virulencia na rata.[16][17]
Bombas de efluxo
As bombas de efluxo son máquinas proteicas que usan a enerxía para bombear fóra da célula antibióticos e outras pequenas moléculas que entran no citoplasma bacteriano e o espazo periplásmico. Ao bombearen constantemente os antibióticos fóra da célula, as bacterias poden incrementar a concentración dun determinado antibiótico necesaria para matalos ou inhibir o seu crecemento cando a diana do antibiótico está dentro da bacteria. A. baumannii ten dúas bombas de efluxo principais que diminúen a súa susceptibilidade aos antimicrobianos. O primeiro, o AdeB, é responsable da resistencia a aminoglicósidos.[18] O segundo, o AdeDE, é responsable do efluxo dun amplo rango de substratos, incluíndo tetraciclina, cloranfenicol, e varios carbapenems.[19]
ARN pequeno
Os ARNs pequenos bacterianos son ARN non codificantes que regulan varios procesos celulares. Tres ARNs pequenos, chamados AbsR11, AbsR25 e AbsR28, foron validados experimentalmente na cepa MTCC 1425 (ATCC15308), que é unha cepa con resistencia a multifármacos, que mostra resistencia a 12 antibióticos. O ARN pequeno AbsR25 podería exercer un papel na regulación da bomba de efluxo e a resistencia a fármacos.[20]
Proteína A da membrana externa (OMPA)
A adhesión pode ser un determinante crítico da virulencia para as bacterias. A capacidade de unirse ás células hóspede permite que as bacterias interaccionen con elas de varias maneiras, ou ben polo sistema de secreción de tipo III ou ben simplemente para manterse opoñéndose ao movemento prevalecente de fluídos. A proteína A da membrana externa (OMPA) está implicada na adherencia de A. baumannii a células epiteliais. Isto permite que a bacteria invada as células por medio dun mecanismo de cremalleira.[21] A proteína localízase nas mitocondrias das células epiteliais e causa necrose ao estimular a produción de especies reactivas do oxíxeno.[22]
Remove ads
Tratamento da infección
Como a maioría das infeccións son agora resistentes a múltiples fármacos, é necesario determinar que susceptibilidades que ten unha determinada cepa para que o tratamento sexa un éxito. Tradicionalmente, as infeccións eran tratadas con imipenem ou meropenem, pero detectouse un aumento constante de A. baumannii resistente a carbapenem.[23] Consecuentemente, os métodos de tratamento a miúdo recorren ás polimixinas, especiealmente a colistina.[24] A colistina é considerada un fármaco de último recurso porque a miúdo causa danos renais, entre outros efectos secundarios.[25] Os métodos de prevención en hospitais están enfocados en incrementar a limpeza das mans e procedementos de esterilizacións máis eficientes.[26]

Remove ads
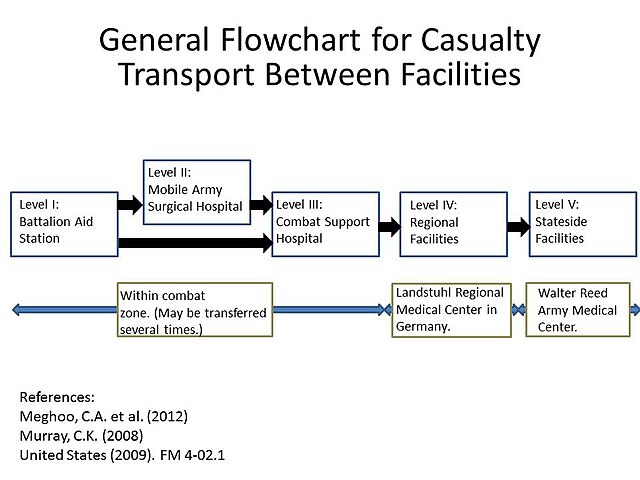
Infeccións en veteranos feridos en Iraq e Afganistán
Moitos soldados feridos nas guerras de Iraq e Afganistán sufriron infeccións por A. baumannii. Inicialmente, pensábase que a infección se producía no momento da ferida, pero os estudos posteriores indicaron que hai maior probabilidade de adquirila en instalacións médicas (infección nosocomial), debido á capacidade da bacteria de persistir moito tempo sobre superficies artificiais e tamén aos sucesivos traslados dos soldados feridos a diversas instalacións médicas durante o seu proceso de evacuación e atención.[27] As A. baumannii resistentes a multifármacos son un factor principal na complicación do tratamento e rehabilitación de soldados feridos, o que incrementa o número de mortes.[5][28][29]
Incidencia de A. baumannii en hospitais
A importación de A. baumannii e a subseguinte presenza en hospitais está ben documentada.[30] A. baumannii é xeralmente introducida nun hospital polo paciente colonizado. Debido á súa capacidade de sobrevivir en superficies artificiais e resistir ao desecamento, pode permanecer e posiblemente infectar novos pacientes durante algún tempo. O crecemento de A baumannii sospéitase que é favorecido en instalacións hospitalarias debido ao uso constante de antibióticos nos pacientes nos hospitais.[31] Acinetobacter pode transmitirse de persoa a persoa ou cando unha persoa contacta con superficies contaminados.[32] Nun estudo feito en unidades de coidados intensivos en Europa en 2009, A. baumannii era a responsable do 19,1% de casos de pneumonía asociados con respiración asistida.[33]
Remove ads
Notas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

