Factor IX
From Wikipedia, the free encyclopedia
Remove ads
O factor IX de coagulación (ou factor de Christmas) (EC 3.4.21.22) é unha das serina proteases do sistema de coagulación do sangue; pertence á familia das peptidases S1. A deficiencia desta proteína causa a hemofilia B. Foi descuberto en 1952 nun rapaz chamado Stephen Christmas que carecía deste factor e padecía hemofilia.[1]
 | |
| PDB 1pfx | |
F9 | |
| Identificadores | |
| Símbolo | F9 |
| Símbolos alt. | F9 p22, FIX, HEMB, P19, PTC, THPH8, factor de coagulación IX, factor de coagulación sanguínea IX, factor Christmas |
| Entrez | 2158 |
| OMIM | |
| RefSeq | NP_000124 |
| UniProt | P00740 |
| Outros datos | |
| Locus | Cr. X q27.1:(139.53 – 139.56 Mb) |
O complexo factor IX é unha das medicinas que aparecen na Lista modelo da OMS de Medicinas Esenciais, que son as medicinas máis importantes necesarias para un sistema de saúde básico.[2]
Remove ads
Fisioloxía
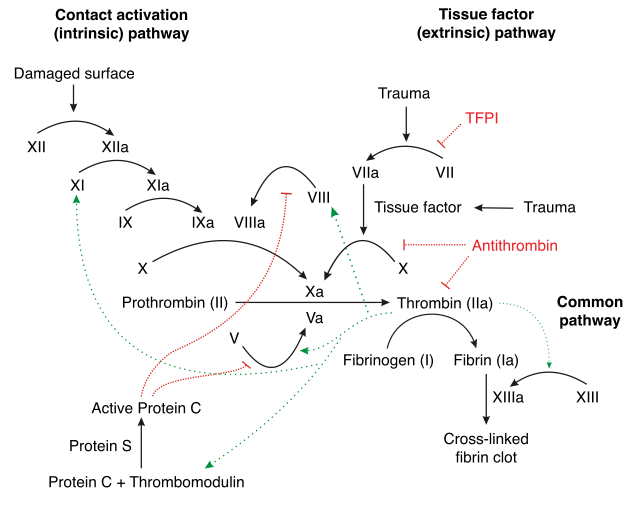
O factor IX é producido como un cimóxeno, un precursor inactivo. É procesado para eliminarlle o péptido sinal, é glicosilado e despois clivado polo factor XIa (da vía de contacto) ou polo factor VIIa (da vía do factor tisular) para orixinar unha forma de dúas cadeas na que as cadeas están ligadas por unha ponte disulfuro.[3][4] Cando é activado e pasa á forma factor IXa, en presenza de Ca2+, fosfolípidos de membrana e o cofactor factor VIII, hidroliza un enlace peptídico arxinina-isoleucina no factor X para formar o factor Xa.
O factor IX é inhibido pola antitrombina.[3]
A expresión do factor IX increméntase coa idade en humanos e ratos. Nos modelos de ratos as mutacións dentro da rexión promotora do xene do factor IX teñen un fenotipo dependente da idade.[5]
Remove ads
Arquitectura de dominios
Os factores VII, IX e X desempeñan papeis claves na coagulación do sangue e tamén comparten unha arquitectura de dominios común.[6] A proteína factor IX está composta de catro dominios proteicos: o dominio Gla, dúas copias en tándem do dominio EGF e un dominio peptidase C-terminal de tipo tripsina que leva a cabo a clivaxe catalítica.

O dominio EGF N-terminal é en pare responsable da unión do factor tisular.[6] Wilkinson et al. concluíron que os residuos 88 ao 109 do segundo dominio EGF median a unión a plaquetas e a ensamblaxe do complexo activador do factor X.[7]
Foron resoltas as estruturas dos catro dominios. Unha estrutura dos dous dominios EGF e o dominio de tipo tripsina foron determinados para a proteína do porco.[8] A estrutura do dominio Gla, que é responsable da unión de fosfolípidos dependente do Ca(II), foi tamén determinada por resonancia magnética nuclear.[9]
Resolvéronse varias estruturas de mutantes 'super-activos',[10] que revelan a natureza da activación do factor IX por outras proteínas no cadoiro da coagulación.
Remove ads
Xenética

O xene do factor IX está localizado no cromosoma X humano (Xq27.1-q27.2) e ten unha herdanza recesiva ligada ao X, polo que a mutación neste xene afecta máis a homes que a mulleres. Foi clonado en 1982 por Kotoku Kurachi e Earl Davie.[11]
A ovella transxénica clonada Polly, que levaba o xene humano do factor IX, foi producida polo Dr Ian Wilmut no Instituto Roslin en 1997. A ovella expresaba o factor IX no leite.[12]
Papel en enfermidades
A deficiencia do factor IX causa a enfermidade de Christmas ou hemofilia B.[1] Describíronse unhas 100 mutacións no factor IX; algunhas non causan síntomas, pero moitas orixinan un significativo trastorno hemorráxico. A mutación orixinal da enfermidade de Christmas foi identificada pola secuenciación do ADN conservado do paciente S. Christmas, e tratábase dun cambio de cisteína a serina.[13] O factor IX recombinante é utilizado para tratar a enfermidade de Christmas. As formulacións inclúen:
- nonacog alfa (nome comercial BeneFix)[14]
- albutrepenonacog alfa (nome comercial Idelvion)[15]
- eftrenonacog alfa (nome comercial Alprolix)[16]
Algunhas raras mutacións no factor IX teñen como resultado unha elevación na actividade coagulatoria, e pode orixinar enfermidades causadas por coágulos, como a trombose venosa profunda.[17]
A deficiencia de factor IX é tratada con inxeccións de factor IX purificado producido por clonación en diversos animais ou en células animais. O ácido tranexámico pode ser útil en pacientes que teñen que ser operados cirurxicamente e que herdaron a deficiencia de factor IX para reducir o risco perioperativo de hemorraxias.[18]
Unha lista de todas as mutacións no factor IX foi compilada na base de datos de mutacións no factor IX[19] mantida no University College London.
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
