トップQs
タイムライン
チャット
視点
ニオブ
原子番号41の元素 ウィキペディアから
Remove ads
ニオブ(英: niobium [naɪˈoʊbiəm] 独: Niob [niˈoːp, ˈniːɔp])は、原子番号41、元素記号Nbの元素である。かつてはコロンビウムと呼ばれていたこともあった。
Remove ads
名称
柔らかく灰色で結晶質の延性のある遷移金属であり、パイロクロアやコルンブ石といった鉱物としてしばしば産出し、後者に由来してかつてはコロンビウムと呼ばれていたこともあった。ニオブという名前はギリシア神話に由来し、タンタルの語源となったタンタロスの娘であるニオベーから来ている。この名前は、タンタルとニオブが物理的・化学的に非常によく似ており、区別を付けづらいという特徴を反映したものである[3]。
イングランドの化学者チャールズ・ハチェットが1801年に、タンタルに似た新元素を報告し、コロンビウムと名付けた。1809年にやはりイングランドの化学者ウイリアム・ウォラストンが誤ってタンタルとコロンビウムは同じものであると結論付けた。ドイツの化学者ハインリヒ・ローゼは1846年に、タンタルの鉱石にはもう1つの元素を含んでいると判断し、これにニオブという名前を付けた。1864年および1865年に、一連の科学的発見によりニオブと、かつてコロンビウムと呼ばれていたものは同じ元素であることが明らかになり、それから1世紀ほどの間にわたってニオブとコロンビウムという名前はどちらも同じものを指す言葉として使われてきた。1949年にニオブという名前が公式にこの元素の名前として採用されたが、その後もアメリカ合衆国では鉱業の分野において依然としてコロンビウムという名前が残っている。
コロンビウム(元素記号Cb)[4]は、1801年に初めてニオブが発見された際にハチェットが与えた名前であった[5]。この名前は、発見に用いられた鉱石標本がアメリカ(コロンビア)から送られたことにちなんだものであった[6]。アメリカの論文誌ではこの名前が使われ続け、アメリカ化学会がコロンビウムという名前をタイトルに含む最後の論文を公表したのは1953年のことであった。一方、ヨーロッパではニオブという名前が使われていた[7]。この混乱を終わらせるために、1949年にアムステルダムで開かれた第15回化学連合会議において41番元素の名前としてニオブが選択された[8]。歴史的にはコロンビウムという名前の方が先に用いられていたにもかかわらず、この翌年、100年間にわたる論争を経て、国際純正・応用化学連合 (IUPAC) により正式にニオブという名前が採択された[8]。これはある種の妥協であり[8]、IUPACは、ウォルフラムという名前より北アメリカで使用されているタングステンという名前を採用した代わりに、コロンビウムという名前よりヨーロッパで使用されているニオブという名前を採用した。アメリカ合衆国の多くの化学関連組織や政府組織では公式のIUPAC名を使用しているが、一部の冶金関係者や金属関連組織では依然としてアメリカの名前であるコロンビウムを使っている[9][10][11]。
Remove ads
歴史
要約
視点


ニオブはイングランドの化学者チャールズ・ハチェットにより、1801年に発見された[12][5][13]。ハチェットは、1734年にジョン・ウィンスロップがイングランドにアメリカ合衆国のコネチカット州から送ったサンプルの鉱物から新元素を発見し、アメリカ合衆国の詩的な名前であるコロンビアにちなみ、この鉱物をコルンブ石、新しい元素をコロンビウムと名付けた[14][15][16]。ハチェットが発見したコロンビウムは、おそらく新元素とタンタルの混合物であったと思われる[14]。
その後、コロンビウムと、それによく似たタンタルの違いについて、かなりの混乱があった[17]。1809年にイングランドの化学者ウイリアム・ウォラストンはコロンビウムの酸化物であるコルンブ石の密度(5.918 g/cm3)と、タンタルの酸化物であるタンタル石の密度(8 g/cm3以上)を比較し、密度がかなり違うにもかかわらずこの2つの酸化物は同じものであると結論付け、タンタルの方の名前を採用した[17]。この結論に対し、1846年にドイツの化学者ハインリヒ・ローゼは異論を唱え、タンタル石にはさらに2つの異なる元素が含まれていると主張して、タンタロスの子供にちなんで、ニオベーからニオブ、ペロプスからペロピウムと名付けた[18][19]。こうした混乱は、タンタルとニオブの間の観測された差異が非常に小さいことから生じていた。新しい元素だとされたペロピウム、イルメニウム、ダイアニウム[20]といったものは、実際にはニオブか、またはニオブとタンタルの混合物であった[21]。
タンタルとニオブの差異は、1864年にクリスチャン・ヴィルヘルム・ブロムストラント[21]やアンリ・サント=クレール・ドビーユらがはっきりと示し、1864年にはルイ・ジョゼフ・トローストがいくつかの化合物の構造式を決定し[21][22]、最終的にスイスの化学者ジャン・マリニャックが1866年に、含まれている元素は2種類だけであることを証明した[23]。しかしイルメニウムという元素に関する記事は1871年まで残っている[24]。
マリニャックは1864年に、水素雰囲気中でニオブの塩化物を熱して還元することにより初めてニオブの金属形態を得た[25]。マリニャックは1866年にはタンタルを含まないニオブを大規模に得ることに成功していたが、ニオブが初めて商業的な用途に用いられたのは、20世紀初めになってからのことで、白熱電球のフィラメントとして用いられた[22]。しかしこのニオブの用途は、より高い融点を持つタングステンによってすぐに代替され、時代遅れのものとなってしまった。鋼鉄の強度をニオブが改善することは1920年代になって初めて発見され、それ以来この用途が最大の用途であり続けている[22]。1961年にアメリカの物理学者ユージーン・クンツラーとベル研究所の共同研究者らは、ニオブスズが大きな電流や強い磁場の中でも超伝導を維持できることを発見し[注 1]、強力な磁石や大出力電気機械に必要とされる大きな電流や磁束に耐えられる初めての材料となった。この発見により20年後、回転機や粒子加速器、粒子検知器といった用途に用いられる大規模で強力な電磁石用のコイルを製作できる長い巻線を製造できるようになった[26][27]。
Remove ads
性質
要約
視点
物理的な特徴
ニオブは光沢のある灰色で、展延性があり、常磁性を持った周期表の第5族に属する金属であり、最外殻電子の配置は第5族としては変則的なものである(これは周期表上近傍にあるルテニウム (44)、ロジウム (45)、パラジウム (46) などに共通である)。
絶対零度から融点まで、体心立方格子構造を取ると考えられているものの、3結晶軸に沿った熱膨張の高解像度測定によれば、立方構造とは矛盾する異方性があることを明らかにしている[28]。そのため、この分野でのさらなる研究と発見が期待されている。
ニオブはごく低温において超伝導になる。大気圧では、元素の超伝導体としては最も高い臨界温度である9.2ケルビンで超伝導となる[29]。ニオブは全ての元素の中で最大の磁場侵入長を持つ[29]。これに加えて、バナジウムおよびテクネチウムと並んで、3つだけ存在する元素の第二種超伝導体でもある。超伝導特性は、金属ニオブの純粋度に強く依存している[30]。
非常に純度が高い金属ニオブは比較的柔らかく展延性があるが、不純物の存在により硬くなる[31]。
金属ニオブは、熱中性子の捕獲断面積が小さい[32]。そのため原子力産業において、中性子に透過的な構造が必要な場合に用いられる[33]。
化学的な特徴
ニオブは、室温で長期間空気にさらされると、青味がかった色を呈する[34]。元素としては高い融点(摂氏2,468度)を持つにもかかわらず、他の耐火金属に比べると密度が小さい。また、腐食耐性が高く、超伝導特性があり、誘電酸化物層を形成する。
ニオブは、原子番号が1つ小さいジルコニウムに比べるとわずかに陽性度が小さくよりコンパクトであるが、一方重いタンタルと比べると、ランタノイド収縮の結果ほとんど同じ大きさである[31]。結果として、ニオブの化学的特性は、周期表上でニオブの直下にあるタンタルととてもよく似ている[22]。ニオブの腐食耐性はタンタルほど優れているわけではないが、価格が安く豊富に入手可能であることから、化学工場におけるタンクの内張りなど、あまり厳しい要求ではない用途にはニオブが向いている[31]。
同位体
→詳細は「ニオブの同位体」を参照
地球の地殻に含まれるニオブの安定同位体は、93Nbのみである[35]。2003年までに、少なくとも32の放射性同位体が合成されており、その原子量は81から113に及ぶ。放射性同位体の中で最も安定なものは92Nbで、その半減期は3470万年に達する。不安定な同位体としては113Nbがあり、その推定半減期は30ミリ秒である。安定同位体の93Nbより軽い同位体は陽電子放出で崩壊する傾向にあり、安定同位体より重い同位体はベータ崩壊をする傾向にあるが、81Nb、82Nb、84Nbは遅延陽子放出の崩壊系列を持ち、91Nbは電子捕獲と陽電子放出し、92Nbは陽電子放出とベータ崩壊の両方の崩壊をするという例外がある[35]。
少なくとも25種類の核異性体が確認されており、その原子量は84から104に及ぶ。この範囲で、96Nb、101Nb、103Nbは核異性体を持たない。ニオブの核異性体の中で最も安定なものは93mNbで、半減期16.13年を持つ。最も不安定な核異性体は84mNbで、半減期103ナノ秒を持つ。ニオブの核異性体は全て核異性体転移またはベータ崩壊で崩壊するが、例外として92m1Nbは電子捕獲という系列を持つ[35]。
化合物
要約
視点
ニオブは多くの点でタンタルやジルコニウムに類似している。高温ではほとんどの非金属と反応する。フッ素とは室温で、塩素および水素とは摂氏200度で、窒素とは摂氏400度で反応し、得られる化合物は多くが侵入型で不定比である[31]。大気中では摂氏200度で酸化し始める[36]。王水、塩酸、硫酸、硝酸、リン酸など、アルカリや酸による腐食に耐える[31]。フッ化水素酸およびフッ化水素酸と硝酸の混合物には腐食される。
ニオブの酸化数は+5から-1までの全てを取りうるが、ニオブの化合物のほとんどではニオブの酸化数は+5を取る[31]。特徴として、+5より小さな酸化数を取る化合物ではニオブ-ニオブ結合を示す。
酸化物と硫化物
ニオブの酸化物は酸化数+5(Nb2O5)[37]、+4(NbO2)、+3(Nb2O3)[36]、そして珍しい酸化数として+2(NbO)がある[38]。最も一般的な酸化物は五酸化ニオブで、ほとんどのニオブの化合物や合金の前駆体となる[36][39]。ニオブ酸塩は、五酸化物を水酸化物イオンの溶液に溶かすか、アルカリ金属の酸化物に溶融させることで得られる。例としてニオブ酸リチウム(LiNbO3)やニオブ酸ランタン(LaNbO4)がある。ニオブ酸リチウムは三角形に歪められたペロブスカイト構造のような構造で、一方ニオブ酸ランタンは孤立したNbO3−
4イオンを持つ[36]。層状の硫化ニオブ (NbS2) も知られている[31]。
摂氏350度以上でニオブ(V)エトキシドを熱分解して、化学気相成長または原子層堆積により酸化ニオブの薄膜で材料をコーティングすることができる[40][41]。
ハロゲン化物


ニオブは、酸化数+5および+4で、様々な不定比化合物としてハロゲン化物を形成する[36][42]。五ハロゲン化ニオブ (NbX5) は八面体の中心にニオブが配置される構造を特徴とする。五フッ化ニオブ (NbF5) は融点が摂氏79度の白い固体である。五塩化ニオブ (NbCl5) は融点が摂氏203.4度の黄色い固体である。どちらも加水分解されて酸化物またはNbOCl3のようなオキシハロゲン化物を与える。五塩化ニオブは、二塩化ニオボセン ((C5H5)2NbCl2) のような有機金属化合物を生成するために使われる多用途の試薬である[43]。四ハロゲン化物 (NbX4) はNb-Nb結合を有する暗色のポリマーであり、たとえば黒く吸湿性のある四フッ化ニオブ (NbF4) や、茶色の四塩化ニオブ (NbCl4) がある。
ニオブのハロゲン化物の陰イオンは、五ハロゲン化物のルイスの酸性度も部分的に手伝って、よく知られている。最も重要なものは [NbF7]2− で、鉱石からニオブとタンタルを分離する過程の途中物質である[44]。この七フッ化物は、タンタル化合物よりも容易にオキソペンタフルオライドを形成する傾向がある。その他のハロゲン化物の錯体としては八面体状の[NbCl6]−などがある。
- Nb2Cl10 + 2 Cl− → 2 [NbCl6]−
原子番号の小さな他の金属と同様に、多くの還元ハロゲン化物のクラスターイオンが知られており、主な例としては[Nb6Cl18]4−がある[45]。
窒化物と炭化物
他に二元化合物として、低温で超伝導体となり、また赤外線検知器として用いられる窒化ニオブ (NbN) がある[46]。主な炭化ニオブはNbCで、非常に硬く耐熱性のあるセラミックス材料であり、商業的には切削加工のバイトに用いられる。
Remove ads
存在
ニオブは地球の地殻における存在量で34番目の元素であるとされており、およそ20 ppm含まれているとされる[47]。地球全体での存在度はより大きいと考えている者もおり、ニオブの高い密度のために地球のコアに濃縮されているとしている[10]。ニオブの単体は自然界では発見されておらず、他の元素と化合して鉱物中に含まれている[31]。ニオブを含む鉱物は、タンタルも含んでいることが多い。たとえば、コルンブ石 ((Fe,Mn)(Nb,Ta)2O6) やコルタン ((Fe,Mn)(Ta,Nb)2O6) といったものがある[44]。コルンブ石、タンタル石といった鉱物(最も一般的な種類はコルンブ石-(Fe)またはタンタル石-(Fe)[注 2])は、ペグマタイトの貫入やアルカリ性貫入岩の随伴鉱物として見つかることが最も多い。カルシウム、ウラン、希土類元素といったもののニオブ酸塩としても見つかる。こうしたニオブ酸塩の例としてはパイロクロア ((Na,Ca)2Nb2O6(OH,F)) (現在ではグループに与えられた名前となっており、その中で一般的なものはフルオロカルシオパイクロア[49][50])、ユークセン石(正確にはユークセン石-(Y)[51])((Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6) といったものがある。ニオブの大規模な鉱脈は、パイロクロアの構成物として、カーボナタイト(炭酸塩-ケイ酸塩火成岩)に関連して発見される[52]。
現時点で採掘されているパイロクロアの3大鉱床は、2つがブラジルに、1つがカナダにあり、どれも1950年代に発見され、なおもニオブ鉱石の主な供給源となっている[22]。最大の鉱床は、ブラジルのミナスジェライス州アラシャにあり、カーボナタイトの貫入物に随伴したもので、CBMM(ブラジル冶金鉱業会社)が保有している。もう1つのブラジルの採掘中鉱床はゴイアス州カタラン近郊にあり、やはりカーボナタイト貫入物に伴うもので、洛陽欒川モリブデンが保有している[53]。これら2つの鉱床で、世界全体の供給のおよそ88パーセントを生産している[54]。ブラジルにはほかにも、アマゾナス州サン・ガブリエウ・ダ・カショエイラ近郊に大規模だが未採掘の鉱床があり、ロライマ州にあるものなど、より小規模な鉱床もいくつかある[54]。
ニオブの3番目の供給源は、カナダのケベック州チクーチミ近郊サントノーレにあるニオベック鉱山で、やはりカーボナタイトに伴うもので、マグリス・リソーシズが保有している[55]。この鉱山では、世界全体の供給の7パーセントから10パーセント程度を生産している[53][54]。
Remove ads
生産
要約
視点

他の鉱石の分離処理を行うと、タンタル(五酸化タンタル Ta2O5)とニオブ(五酸化ニオブ Nb2O5)の酸化物の混合物が得られる。抽出処理の最初の段階は、この酸化物をフッ化水素酸と反応させることである[44]。
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
- Nb2O5 + 10 HF → 2 H2[NbOF5] + 3 H2O
ジャン・マリニャックが開発した最初の工業的分離処理では、ニオブのフッ化物の錯体(フッ化ニオブ酸カリウム一水和物 K2[NbOF5]·H2O)とタンタルのフッ化物の錯体(フッ化タンタル酸カリウム K2[TaF7])の水への溶解度の差を利用していた。新しい処理方法では、フッ化物を水溶液からシクロヘキサノンのような有機溶媒へ取り出す液液抽出を利用する[44]。ニオブとタンタルのフッ化物の錯体は、この有機溶媒から水に別々に抽出され、フッ化カリウムを加えてフッ化カリウムの錯体を形成して沈殿させるか、アンモニアを加えて五酸化物として沈殿させる[36]。
- H2[NbOF5] + 2 KF → K2[NbOF5]↓ + 2 HF
または:
- 2 H2[NbOF5] + 10 NH4OH → Nb2O5↓ + 10 NH4F + 7 H2O
還元して金属ニオブを得る方法としてはいくつかのものがある。フッ化ニオブ酸カリウム K2[NbOF5]と塩化ナトリウムの溶融塩を電気分解する方法、ナトリウムを使ってフッ化物を還元する方法などがある。この方法では比較的高い純度のニオブを得ることができる。大規模な生産では、五酸化ニオブ Nb2O5 は水素または炭素を用いて還元される[36]。アルミノテルミット反応では、鉄の酸化物とニオブの酸化物の混合物をアルミニウムと反応させる:
- 3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al2O3
この反応を促進させるために硝酸ナトリウムのような少量の酸化剤が添加される。得られるのは酸化アルミニウムと製鉄に用いられる鉄とニオブの合金であるフェロニオブである[56][57]。フェロニオブは60 - 70パーセントのニオブを含む[53]。酸化鉄なしでは、アルミノテルミット反応はニオブの生産にも用いられる。超伝導合金の水準に達するためにはさらなる精錬が必要である。ニオブの2大供給業者が用いている方法は、真空下での電子ビーム溶解法である[42][58]。
2013年時点、ブラジルのCBMMが世界のニオブ生産の85パーセントを占める[59]。アメリカ地質調査所は、ニオブの生産量は2005年の38,700トンから2006年の44,500トンへと増加したと推定している[60][61]。世界のニオブ資源量は440万トンであると推計されている[61]。1995年から2005年までの10年間では生産量は1995年の17,800トンから2倍以上に増加している[62]。2009年から2011年まで年間生産量は63,000トンでほぼ安定していたが[63]、2012年には50,000トンへと減少した[64]。
CBMMは2019年の世界需要を前年比10%増の13万トンと推測している。2018年秋に中華人民共和国で棒鋼の品質基準が引き上げられ、強度を増すため添加されるニオブの需要が急増した。CBMMは、リチウムイオン電池の正極材や負極材向けとしてニオブの需要が今後拡大するという展望を示している[2](「用途」で後述)。
マラウイのケニカ鉱脈にもいくらか発見されている。
Remove ads
用途
要約
視点

ニオブが商業的に初めて利用されたのは20世紀初めになってからであった。ニオブおよび、ニオブと鉄の合金(60-70パーセントがニオブ)であるフェロニオブの最大生産国はブラジルである。ニオブは主に合金として用いられ、ガスのパイプラインなどに用いられる特殊合金が最大の用途である。こうした合金は最大でも0.1パーセント程度のニオブを含有するだけであるが、このわずかなニオブにより鋼鉄の強度を増大させる。ニオブを含む超合金の温度安定性の高さから、ジェットエンジンやロケットエンジンといった用途が重要である。
ニオブは様々な超伝導材料に用いられる。こうした超伝導合金は、チタンやスズも含むものが、核磁気共鳴画像法 (MRI) の超伝導電磁石に広く用いられている。ニオブのその他の用途として、溶接、原子力産業、電子、光学、貨幣、宝飾といったものがある。貨幣と宝飾の用途では、毒性が低いことと、陽極酸化処理により虹色を呈することが、非常に望ましい特性として利用されている。
2006年に生産されたニオブ44,500トンのうち、推定で90パーセントは高級構造用鋼鉄の生産に用いられた。2番目の用途は超合金の生産である[66]。ニオブ合金による超伝導体や電気部品などでのニオブ消費は、世界のニオブ総生産量のほんのわずかな部分を占めるに過ぎない[66]。
鋼材
ニオブは鋼鉄にマイクロアロイ(少量を添加して性質改善を行う)を行う上で有用な材料であり、鋼材内では炭化ニオブや窒化ニオブを形成する[10]。こうした化合物は細粒化を改善し、再結晶化と析出硬化を遅らせる。こうした効果により、硬度・強度・成形性・溶接性などを改善する[10]。マイクロアロイを実施したステンレス鋼に含まれるニオブは少ないが(0.1パーセント以下[67])、現代の自動車に構造上広く用いられている高張力鋼にとって重要な添加剤である[10]。
超合金

多くのニオブがニッケル、コバルト、鉄をベースとした超合金に用いられており、その含有比率は6.5パーセントにも達する[67]。ジェットエンジン部品、ガスタービン、ロケット部品、ターボチャージャー装置、耐熱部品、燃焼設備などに用いられる。ニオブは超合金の粒状組織内において、γ''相の硬化を促進する[70]。
超合金の一例として、インコネル718があり、おおむね50パーセントのニッケル、18.6パーセントのクロム、18.5パーセントの鉄、5パーセントのニオブ、3.1パーセントのモリブデン、0.9パーセントのチタン、そして0.4パーセントのアルミニウムで構成されている[71][72]。こうした超合金はたとえば、ジェミニ計画における先進的な機体システムなどで用いられた。ニオブの合金は他に、アポロ司令・機械船のノズルにも用いられた。ニオブは摂氏400度以上になると酸化されるため、こうした用途では合金が脆くならないように保護コーティングが必要となる[73]。
ニオブ合金
C-103合金は1960年代初頭にワー・チャンとボーイングが共同で開発した。デュポン、ユニオンカーバイド、ゼネラル・エレクトリック他数社が、冷戦と宇宙開発競争を背景としてニオブ合金を同時期に開発していた。89パーセントのニオブ、10パーセントのハフニウム、1パーセントのチタンで構成されており、アポロ月着陸船のメインエンジンなど、液体燃料ロケットのスラスターノズルに使われている[73]。
スペースXがファルコン9の上段用に開発したマーリン・バキュームシリーズのロケットエンジンのノズルはニオブ合金で作られている[74]。
ニオブは、酸素との反応性のため、真空中または不活性気体中で加工する必要があり、生産の費用と難度を大きく上げる原因となっている。当時新規開発されていた真空アーク溶解または電子ビーム溶解により、ニオブやそのほか反応性の高い金属に関する開発が可能となった。C-103合金を開発したプロジェクトは1959年に始まり、ボタン状の金属を溶かして板金に圧延できる、256ものCシリーズ(おそらくコロンビウムの頭文字に由来する)の試作ニオブ合金を開発した。ワー・チャンは、原子力用ジルカロイを精製する過程で得られたハフニウムを在庫しており、これを商業用に利用したいと考えていた。Cシリーズ合金で103番目に試したニオブ89パーセント、ハフニウム10パーセント、チタン1パーセントの組み合わせが、成形性と高温特性の点で最適であった。ワー・チャンは1961年に、真空アーク溶解および電子ビーム溶解を用いて、最初のC-103合金500ポンド(約225キログラム)を製造し、インゴットから板金にした。意図されていた用途はガスタービンエンジンや液体金属用熱交換器であった。当時C-103に競合していたニオブ合金としては、ファンスティール冶金製のFS85(ニオブ61パーセント、タングステン10パーセント、タンタル28パーセント、ジルコニウム1パーセント)、ワー・チャンおよびボーイング製Cb129Y(ニオブ79.8パーセント、タングステン10パーセント、ハフニウム10パーセント、イットリウム0.2パーセント)、ユニオンカーバイド製Cb752(ニオブ87.5パーセント、タングステン10パーセント、ジルコニウム2.5パーセント)、およびスペリアー・チューブ製のニオブ99パーセント、ジルコニウム1パーセント合金であった[73]。
超伝導電磁石
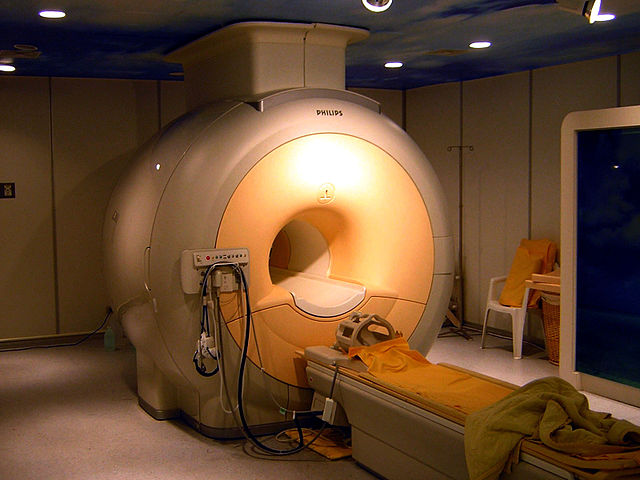
ニオブゲルマニウム、ニオブスズ、ニオブチタンなどの合金は、第二種超伝導体としてワイヤーにして超伝導電磁石を作るために用いられる[75][76]。こうした超伝導電磁石は、核磁気共鳴画像法 (MRI)、核磁気共鳴 (NMR) 装置、加速器といった用途に用いられる[77]たとえば、大型ハドロン衝突型加速器には600トンの超伝導撚線が用いられており、ITER(国際熱核融合実験炉)には推定で600トンのニオブスズの撚線と250トンのニオブチタンの撚線が用いられている[78]。1992年だけで、ニオブチタンの巻線を使った病院用のMRI装置がアメリカドルにして10億ドル以上製造された[26]。
その他の超伝導体

自由電子レーザーのFLASH(中止されたTESLA線形加速器プロジェクトの成果)やEuropean XFELに用いられている超伝導加速空洞は、純粋なニオブで作られている[79]。フェルミ国立加速器研究所のクライオモジュールチームは、同じFLASHプロジェクトに由来する超伝導加速技術を利用して、純粋なニオブ製の1.3 GHz 9セル超伝導加速空洞を開発した。この装置は国際リニアコライダーの30キロメートルに及ぶ線形加速器でも用いられることになっている[80]。同じ技術は、SLAC国立加速器研究所のLCLS-II計画、フェルミ研究所のPIP-II計画でも用いられることになっている[81]。
超伝導窒化ニオブで作られたボロメータは高い感度を持っており、テラヘルツ周波数帯における電磁放射の理想的な検知器である。この検知器はハインリッヒ・ヘルツサブミリ波望遠鏡、南極点望遠鏡、Receiver Lb Telescope、アタカマ・パスファインダー実験施設などで試験され、ハーシェル宇宙望遠鏡に搭載されてHIFI観測機器に用いられた[82]。
その他の利用
電子セラミックス
強誘電体であるニオブ酸リチウムは、携帯電話、光変調素子、表面弾性波デバイスの製造などに広く用いられている。タンタル酸リチウムやチタン酸バリウムなどと同じように、ペロブスカイト構造を取る強誘電体に属する[83]。ニオブコンデンサは、タンタルコンデンサの代替となりうるが[84]、依然としてタンタルコンデンサが支配的である。高い屈折率を持つガラスを製造するためにニオブが添加され、眼鏡のレンズを薄く軽くすることができる。
低刺激性用途:医療および宝飾
ニオブおよびニオブの合金は、生理学的に不活性でアレルギーを起こしにくい。このため、人工装具や心臓ペースメーカーのような埋め込みデバイスに用いられる[85]。水酸化ナトリウムで処理したニオブは多孔質層を形成し、オッセオインテグレーション(骨と金属の接合)に資する[86]。
チタン、タンタル、アルミニウムなどと同様に、ニオブは熱して陽極酸化処理をすることができ、多彩な玉虫色を呈して宝飾用にすることができる[87][88]。アレルギーを起こしにくい性質はこの点でも好ましいものとなっている[89]。
貨幣
ニオブは記念硬貨において、銀や金などとともに貴金属として利用される。たとえば、オーストリアは銀とニオブのユーロ硬貨のシリーズを2003年から開始し、その色は陽極酸化処理による薄い酸化層が光を回折して呈したものである[90]。2012年には、硬貨の中央に青、緑、茶、紫、黄など様々な色を呈する10種類の硬貨が入手可能であった。さらに、2004年のオーストリアの25ユーロゼメリング鉄道150周年記念硬貨[91]、2006年のオーストリアの25ユーロヨーロッパ測位衛星(ガリレオ)記念硬貨がある[92]。オーストリアの造幣局は2004年開始の同様の硬貨シリーズをラトビア向けに製造しており[93]、2007年にも1種類発行した[94]。2011年にはカナダ造幣局が5ドルのスターリングシルバーとニオブの「ハンターズ・ムーン」という名前の硬貨を製造開始し[95]、ニオブは選択的に酸化されているため、同じ硬貨が2つとないような独特の仕上げとなっている。
その他
ナトリウムランプの高圧発光管の密封材はニオブで作られており、場合によっては1パーセントのジルコニウムを含んだ合金となっている。発光管は、動作中のランプ内に含まれる熱い液体ナトリウムや気体ナトリウムによる化学的な反応や還元に耐えられる半透明材料となる、焼結されたアルミナのセラミックスで作られ、ニオブはこれと非常によく似た熱膨張係数を持っている[96][97][98]。
ニオブは、ある種の安定化ステンレス鋼に対するアーク溶接用の溶接棒として使われ[99]、またある種の水タンクにおけるカソード防蝕システムの陽極側に用いられる。この際、タンクは通常白金でメッキされる[100][101]。
ニオブは、プロパンの選択的酸化によりアクリル酸を生産する際に用いられる、高性能で不均一な触媒の重要な構成要素となる[102][103][104][105]。
太陽探査機「パーカー・ソーラー・プローブ」のコロナ微粒子捕獲モジュールの高電圧ワイヤを作成するためにニオブが用いられている[106]。
Remove ads
人体への影響
ニオブには生物学的な役割が見つかっていない。ニオブの細粉は目や肌に対する刺激物であり、また火災の危険もある。一方で、より大きなサイズの塊であれば、化学的に比較的安定で生体に対しても不活性である。また、生体に対してアレルギー反応を誘発しにくい。宝飾品によく用いられ、またある種の医学用の埋め込み物(インプラント)の試作もされてきた[107][108]。
多くの人にとって、ニオブを含む化合物に接することはまれであるが、毒性のあるものもあり注意して取り扱う必要がある。水溶性の化学物質であるニオブ酸塩や塩化ニオブについて、短期および長期の暴露がラットで実験されている。塩化ニオブまたはニオブ酸塩を単回投与されたラットの半数致死量 (LD50) は10 - 100 mg/kgであった[109][110][111]。経口投与では毒性はより弱く、ラットに対する実験では7日経過後のLD50は940 mg/kgであった[109]。
Remove ads
脚注
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



