トップQs
タイムライン
チャット
視点
染色体凝縮
ウィキペディアから
Remove ads
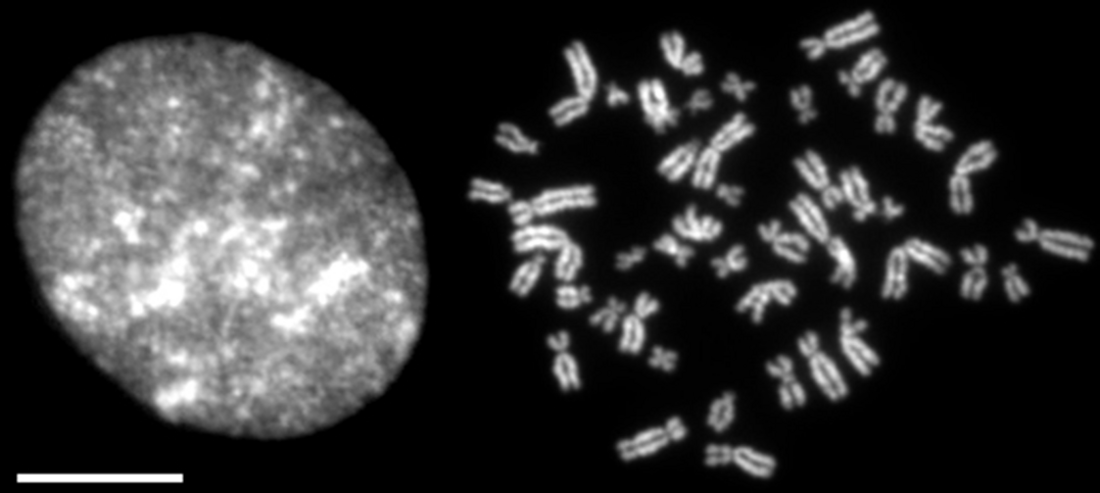
染色体凝縮(せんしょくたいぎょうしゅく:chromosome condensation)とは、間期の細胞核内に分散していたクロマチンが、細胞分裂期においてコンパクトな棒状の構造に変換する過程のことをいう(図1)[1][2][3][4]。

染色体凝縮は、生物学の分野では古くから使われてきた用語である。しかし、分裂期の染色体凝縮は、物理化学における凝縮(気体から液体への状態変化)や細胞生物学における生体分子凝縮体(biomolecular condensate)の形成とは異なるメカニズムによって起こることがはっきりしてきたため、「凝縮」という語を使うことは適切ではないという批判もある。そのため、染色体構築 (chromosome assembly) あるい染色体形成 (chromosome formation) という語で置き換えられることも多い。
Remove ads
染色体凝縮の素過程
要約
視点
DNAから染色体まで
ヒトの2倍体細胞内には22対(22x2)の常染色体、およびXXあるはXYの性染色体、計46本の染色体DNAが存在する。そこに含まれるDNAの全長は約2メートルに達する。DNAはまずヒストンと結合してヌクレオソーム構造をとり、さらに30 nmファイバーと呼ばれるクロマチン繊維に折り畳まれる。間期では、これが直径10-20 μmの細胞核内に収められている。分裂期では、クロマチンは棒状の構造体に変換され、個々の染色体の識別が初めて可能となる。この過程は、19世紀末、ドイツの細胞学者ヴァルター・フレミング(Walther Flemming)によって精密に記載された。元来、染色体とは、分裂期に観察される凝縮した構造体を指す用語であったが、近年ではその意味するところは広くなっている(染色体の項を参照)。
高等動物細胞の分裂期染色体では、DNAは約10,000分の一の長さにまで折り畳まれている計算となる。例えば、ヒト第8染色体には 50 mm長のDNAが含まれているが、分裂期にはこれがわずか 5 μm長の染色体に収められる。この作業は、東京スカイツリーの高さに匹敵する細い糸を乾電池サイズに折り畳む作業に匹敵する。
染色体凝縮の生理的意義


上記のように、間期において、DNAは既にクロマチン構造をとっているが、それらは細胞核内に分散しているため個々の染色体として観察されることはない。分裂前期にはいると、核膜周辺から凝縮が始まり、やがて繊維状の構造が観察されるようになる。前中期で核膜が崩壊すると、凝縮はさらに進行する。中期までに凝縮を完了した染色体では2本の姉妹染色分体が識別可能となる。この一連の過程を染色体凝縮と総称することが多いが、染色体の高次構造についての理解が進んでいないため、この語の定義は必ずしも明確ではない。
染色体凝縮の過程は、原理的には以下の3つのステップに分けて考えることが可能である(図2)[5]。
- 個別化(individualization): 核内に分散したクロマチンを個々の染色体ユニットに分解すること。
- 組織化(shaping/compaction): それぞれの染色体をコンパクトな棒状の構造にすること。
- 分割(resolution): それぞれの染色体の中で DNA 間の絡み合いを解き、2本の姉妹染色分体を識別可能にすること。
しかし、これらのステップは同時期にしかも相補いながら進行するため、すべて合わせて染色体凝縮という場合が多い。このように、染色体凝縮とは単に長さを縮めるための過程ではなく、ランダムコイル状のクロマチン繊維を組織的に折り畳んで棒状の構造体へ変換する過程と考えるほうがより適切である。さらに重要なことに、この過程の本質は、分裂後期における姉妹染色分体の分離(separation)を容易にすると共に、両極への移動に耐えるための強度を与えることにある (図3)[6]。染色体凝縮の欠損は染色体の分離異常を引き起こし、ひいてはゲノムの不安定化に繋がる。
Remove ads
染色体凝縮に関わるタンパク質とその制御
要約
視点
染色体凝縮に関わるタンパク質の同定
これまで、真核生物の染色体凝縮は多数のタンパク質が関与する極めて複雑な過程であると考えられてきた。しかし、最近の研究によれば、簡単な基質(精子核)と6種類の精製タンパク質(コアヒストン、3種のヒストン・シャペロン、トポイソメラーゼ II、コンデンシン I )を用いて、単一染色分体(複製過程を経ない一本の染色分体からなる染色体)を試験管内に再構成することができる[7][8]。3種類のヒストン・シャペロンの役割は、以下の通りである。
- Npm2 (Nucleoplasmin 2) は、精子核特有の塩基性タンパク質を精子クロマチンから除去する[9][10]。
- Nap1 (Nucleosome assembly protein 1) は、コアヒストン H2A-H2B を DNA に載せてヌクレオソームを形成する[11]。
- FACT (Facilitates Chromatin Transcription)[12] は、形成されたヌクレオソームを動的にすることによりトポイソメラーゼ II とコンデンシン I の働きを助ける。
これら3つのシャペロンは、その定義通り、再構成される最終産物上には残らない。言い換えれば、シャペロンの助けを借りて3種類の構造タンパク質(コアヒストン、トポイソメラーゼ II、コンデンシン I )を適切に機能させることで、分裂期染色体凝縮の素反応を試験管内に再現することができる。
それまでに独立のアプローチから得られていた証拠も上記の考えを強く支持する。例えば、ヒストンが分裂期染色体構成タンパク質の全重量の約半分を占めることは古くから知られていた。トポイソメラーゼ II とコンデンシン I は、分裂期染色体[13][14]および染色体スキャフォールド (chromosome scaffold) [15]の主要な構成タンパク質であることに加え、カエル卵抽出液を用いた機能アッセイ[13][14]および遺伝学的解析[16][17]から、分裂期染色体構築に必須の役割を果たすことが示されていた。
コンデンシン
→詳細は「コンデンシン」を参照
3種類の構造タンパク質の中で一番最後に発見されたのがコンデンシン (condensin) である[14][18]。しかし現在では、この巨大なタンパク質複合体が分裂期染色体構築の過程で最も中心的な役割を果たしていると考えられている[19]。多くの真核生物は2種類のコンデンシン(コンデンシン I とコンデンシン II )を有しているが、生物種や細胞種によってはコンデンシン I があれば充分である場合も多い。コンデンシンは、ATP 加水分解活性を持ち、そのエネルギーを用いて DNA ループを形成する。これまで提案されているループ形成のメガニズムのうち、現時点で最有力候補と位置づけられているのが、ループ押出し(loop extrusion)メカニズム[20][21]である。しかし、ループ押出しとは異なるメカニズム[22]あるいはより高次の機能[4]を有している可能性も示唆されている。
コンデンシンは、細胞周期の過程で細胞内局在を変化させる。脊椎動物細胞では、コンデンシン II が細胞周期を通じて核内あるいは染色体上に局在するのに対し、コンデンシン I は間期では細胞質に存在する。分裂前期核内での染色体凝縮は、コンデンシン II が担う。前中期にはいって核膜が崩壊すると、コンデンシン I は染色体と接触することができるようになる。前中期以後の染色体凝縮には、2つのコンデンシンが協調的に関わる[23][24]。
コンデンシンは数多くのの翻訳後修飾を受けるが、その中ではリン酸化による制御が一番良く研究されている。脊椎動物では、Cdk1 によるリン酸化がコンデンシン I のスーパーコイリング活性[25][26]および染色体構築活性[7]に必須であることが示されている。カエル卵抽出液を用いた実験からは、CAP-H サブユニットの N 末端のリン酸化が同じ領域によるコンデンシン I の活性抑制を解除するというメカニズムが提唱されている[27]。コンデンシン II では、CAP-D3 サブユニットの C 末端の Cdk1 によるリン酸化が活性抑制の解除に関わっている[28][29]。
トポイソメラーゼ II
トポイソメラーゼ II (topoisomerase II) は、DNA 2重鎖の一時的な切断と再結合反応を触媒することにより、DNA トポロジーを制御するタンパク質である[30][31]。この活性を用いて、姉妹染色分体間あるいは異なる染色体間の DNA の絡まりを「解消する」ことにより、コンデンシンの働きを助ける。一方、最近の研究によれば、個別化・分割化が完了した染色分体内部では、トポイソメラーゼ II が DNA の絡まりを「導入する」ことにより、その形態形成と安定化に寄与する[8][32][33]。すなわち、トポイソメラーゼ II は、染色体構築において、DNA の絡まりの「解消」と「導入」という2つの役割を果たしているらしい[4]。興味深いことに、後者の役割には、トポイソメラーゼ II の C 末端ドメイン(C-terminal domain [CTD])が必須である。一方、トポイソメラーゼ II は、その CTD と DNA に依存して液-液相分離 (liquid-liquid phase separation [LLPS]) を起こすことが報告されている[34]。こうした非酵素活性も染色体凝縮に関与しているのかもしれない。
トポイソメラーゼ II は、間期では細胞核内に局在し、分裂期になると染色体上に観察される。その結合状態は、コンデンシンのそれよりも動的である。トポイソメラーゼ II は数多くの翻訳後修飾を受けるが、その活性を分裂期特異的に制御する修飾があるかという問題については、必ずしもはっきりした解答は得られていない[30][35]。
ヒストン
→詳細は「ヒストン」を参照
ヒストン (histone) は、細胞周期を通じてクロマチン・染色体の主要な構成因子である。コアヒストン H3 やリンカーヒストン H1 が分裂期特異的にリン酸化を受けることは古くから知られており、染色体凝縮への関与が推測されていた[36]。しかし、これらのリン酸化が染色体凝縮を積極的に誘導するという証拠は、これまで得られていない。一方、最近になって、ヒストンの脱アセチル化が、相分離を介してこの過程に重要な貢献をしていることが報告されている[37]。
一方、驚くべきことに、カエル卵抽出液中ではヌクレオソーム形成を抑えた条件下においても、コンデンシンとトポイソメラーゼ II に依存して染色体に似た構造を作ることが可能である[38][8]。このヌクレオソームを持たない染色体は、コンデンシンが集中した中心軸とその周辺に大きく広がったループ構造から構成されていた。この観察は、コンデンシンが染色体の形作り(shaping)に対して本質的な役割を果たす一方、ヌクレオソームは染色体軸の周りに広がる DNA ループのコンパクション(compaction)に貢献していることを示唆している。
その他の制御因子
脊椎動物では、翻訳後修飾に加えて、外来性の制御因子の存在が知られている。
- クロモキネシン KIF4A は、コンデンシン I の正の制御因子として働く[39][40]。
- 小頭症責任タンパク質 MCPH1 は、コンデンシン II の負の制御因子として働く[41][42]。
- M18BP1(CENP-A のセントロメアへの積載に関わる Mis18 複合体のサブユニット)は、 MCPH1と競合することにより、コンデンシン II の正の制御因子として働く[43]。
- 核小体タンパク質 Ki-67 は、分裂期に入ると染色体の表面を覆い、染色体の個別化の完成に大きな役割を果たす[44][45]。
タンパク質因子の他にも、イオン環境が分裂期染色体の形態に大きな影響を与えることが知られている[46][47][48][49][50]。
Remove ads
分裂期染色体のモデルと新しい実験手法
要約
視点
クロマチン繊維が分裂期染色体の中でどのように折り畳まれているのかという問題は、いまだに解明されていない。古典的なモデルとしては、階層制折り畳みモデル(hierarchical folding model)[51]とラジアル(放射状)ループモデル(radial loop model)[52]が挙げられる。その後、ポリマーモデル(polymer model)[53]や階層制軸モデル(hierarchical folding, axial glue model)[54]が提唱されている。
この問題の理解が遅れている理由のひとつは、分裂期染色体の構造を形態学的に解析する手段が限られていたことにある。しかし最近では、以下に列挙する新技術が多面的な解析を可能にしつつある。
- Hi-C (High-throughput chromosome conformation capture)
- 単分子解析
- Magnetic tweezers[65]および optical tweezers[66] を用いた単分子DNAコンパクションの解析
- コンデンシンのモーター活性の解析[67]
- コンデンシンのループ押出し活性の解析[21]
- コンデンシンとトポイソメラーゼ IIの協調作用による単分子DNAコンパクションの解析[33]
- 生物物理学的手法
原核生物における染色体凝縮

真正細菌は、ヒストンをもたないが、複数種の低分子量タンパク質 (NAPs) が DNA と結合して核様体(真核生物の染色体に相当する)を形成する。さらに、DNAジャイレース (DNA gyrase) と呼ばれるトポイソメラーゼが負の DNA超らせん((-) plectonemic 型)を導入することにより、核様体 DNA のコンパクションに貢献している。一方、真核生物のゲノム DNA も全体として負の超らせん構造をもち、それは左巻き toroidal 型としてヌクレオソーム構造の中に収納されていると考えるのが適切である(下表参照)[78][79]。
古細菌はヒストンに似たタンパク質を有し、ある種の古細菌では、~60 bp 周期のヌクレオソーム様構造[80]あるいはポリマー様構造[81]を形成することが報告されている。より最近では、メタゲノミクス解析とタンパク質構造予測プログラムを組み合わせた研究によって、原核生物から多数のヒストン様タンパク質が発見され、その分類が進められている[82]。
多くの真正細菌と古細菌は、真核生物のコンデンシンに類似した複合体(SMC-ScpAB あるいは MukBEF)を有しており、それらは核様体の組織化に直接関わっている[83][84][85]。実際その機能を欠損させると、核様体の構造異常および分離異常が引き起こされる。すなわち、原核生物においても「染色体凝縮」に相当する過程が存在し、限られた空間内での染色体分離に大きな役割をはたしている(図4)。最近では、Hi-C 技術によって、バクテリア型コンデンシンに依存した核様体の構造変換の動態が、Caulobacter[86]、枯草菌[87]および大腸菌[88]において解析されている。
真核生物と原核生物の染色体構造の類似点と相違点を以下の表にまとめる。こうした比較は、染色体凝縮という過程を分子レベルでとらえ直し、さらに染色体高次構造を進化的視点から理解する上で重要な洞察を与えてくれる[79][19]。
Remove ads
関連項目
引用文献
参考図書
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads