சல்பூரிக் அமிலம்
From Wikipedia, the free encyclopedia
Remove ads
கந்தக அமிலம் (Sulfuric or sulphuric acid, H2SO4), ஒரு கடுமையான கரிமமற்ற காடி (மினரல் காடி). இது நீரில் எல்லா அளவிலும் (அடர்த்தியிலும்) கலந்து கரையக்கூடியது. கந்தகக் காடி பல்வேறு தொழிலகங்களில் மிகப் பயன்படும் ஒரு வேதியியற் பொருள். 2001 ஆண்டின் கணக்குப்படி ஏறத்தாழ $8 பில்லியன் அமெரிக்க டாலர் மதிப்புடைய 165 மில்லியன் டன் கந்தகக் காடி உற்பத்தி செய்யப்பட்டது. இதன் முக்கிய பயன்பாடுகள்: உரம் செய்தல், கனிமங்களைப் பிரித்தெடுத்தல், எரியெண்ணெய் தூய்மைப்படுத்துதல், தானுந்துகளில் பயன்படும் ஈயம்-காடி மின்கலங்கள் செய்தல், கழிவுநீர் தூய்மைப்படுத்தல், பல்வேறு வேதியியல் பொருள்கள் செய்தல், சாயம், நிறப்பூச்சுகளில் நிறப்பொருள்கள் செய்தல், மருந்துகள், வெடிமருந்துகள் செய்தல் ஆகியவை.
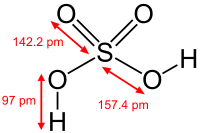
கந்தகக் காடி பார்ப்பதற்கு நிறமற்றதாக இருக்கும். இது அடர்த்தியான அரிப்புத்தன்மை மிக்க ஒரு வேதிப்பொருள். இதனை ஐதரசன் சல்பேட்டு (Hydrogen Sulfate) என்றும் கூறுவதுண்டு. இடைக்கால ஐரோப்பியாவில் இதனை ஆயில் ஆஃவ் விட்ரியோல் (Oil of Vitriol) என்றும் கூறினர், ஏனெனில் இக் காடியின் பயன்பாட்டால் பெறும் வெவ்வேறு சல்பேட்டு உப்புகள் பல நிறங்களில் கண்ணாடி போன்று காட்சி அளித்தன. கண்ணாடியின் இலத்தீன் மொழிச்சொல் விட்ரியசு (vitreus).
Remove ads
கிடைப்பு
தூய கந்தக் காடி நீர் ஈர்ப்புத்தன்மை (நீரில் எளிதில் கரையும் தன்மை) கொண்டதால் இயற்கையில் நிலவுலகில் கிடைப்பதில்லை. ஆனால் காடிநீர் மழையில் உள்ள காடிகளில் இதுவும் ஒன்று. காடிநீர் மழையில் உள்ள கந்தகக் காடி, வளிமண்டலத்தில் உள்ள நீர் மூலக்கூறுகளுடம் சேர்ந்து ஆக்சைடாகும் கந்தக-டை-ஆக்சைடால் நிகழ்கின்றது - அதாவது சல்பரசுக் காடி (கந்தசக் காடி) (H2SO3) ஆக்சைடாக்கத்தால் கந்தகக் காடி (H2SO4)ஆகின்றது. நிலக்கரி, எரியெண்ணெய் போன்ற கந்தகம் கலந்துள்ள பல்வேறு எரிபொருள்களை எரிப்பதால் விளைபொருளாக கந்தக-டை-ஆக்சைடு உருவாகின்றது.
இரும்பு சல்பைடு (iron sulfide) போன்ற கனிமங்களின் சல்பைடு ஆக்சைடாவதால் இயல்பாய் கந்தக் காடி உருவாகின்றது. இப்படிக் கனிமங்களின் சுரங்கங்களில் இருந்து வெளியாகும் நீர் மிகுந்த காடித்தன்மை கொண்டிருக்கும். இதனை சுரங்கக் காடிக்கழிவுநீர் (AMD, Acid Mine Drainage) அல்லது பாறைக் காடிக்கழிவுநீர் (ARD) என்பர். இந்தக் காடிநீர் சல்பைடு கலந்த கிட்டம் அல்லது கனிமமணலில் (ore) உள்ள மாழைகளை (உலோகங்களை)க் கரைககூடியது. அப்படிக் கரைத்து ஓடும் நீர் பளிச்சென்ற நிறத்தில் இருக்கும். இரும்பு சல்பைடு பைரைட்டு (FeS2) ஆக்சிசன் மூலக்கூறால் ஆக்சைடாக்கப்பட்டு இரும்பு (II) அல்லது Fe2+: .
Fe2+ மேலும் ஆக்சைடாக்கப்படு Fe3+ ஆகும், கீழ்க்காணுமாறு:
மேலும் உருவாகும் Fe3+ ஐதராக்சைடு அல்லது ஐதரசு ஆக்சைடு ஆக படிவிக்கலாம்.
இரும்பு(III) மின்மவணுவும் (ஃவெர்ரிக் அயர்ன் ("ferric iron") என்று பொதுப்படக் கூறப்படுவது) பைரட்டை (pyrite) ஆக்சைடாக்க இயலும். பைரைட்டின் இரும்பு(III)-ஆக்சைடாக்கத்தின் பொழுது அந்நிகழ்வு மிக விரைந்து நடக்ககூடும். பிஎச் (கார-காடித்தன்மை) மதிப்பு சுழிக்கும் கீழே சென்று எதிர்ம எண்ணாகக் கூட அமைவதை பாறைக் காடிநீரில் அளவிட்டு இருக்கின்றனர்.
வெள்ளியின் (கோள்) வளிமண்டலம்
வெள்ளியின் வளிமண்டலத்தின் மேற்பகுதிகளில் உள்ள கார்பன்-டை-ஆக்சைடு, சல்பர்-ஆக்சைடு நீராவி ஆகியவை கதிரவனின் ஒளிவேதியியல் வினைகளால் கந்தககக் காடி விளைவிக்கின்றது. 169 நானோமீட்டர் அலைநீளத்தை விட குறைவான புற ஊதாக்கதிர்கள் ஒளிச்சிதைவு வினைவழி கார்பன்-டை-ஆக்சைடை, பிரித்து கார்பன் மோனாக்சைடு, தனியணு ஆக்சிசன் ஆக மாற்றவல்லன.
தனியணு ஆக்சிசன் மிகவும் வீரியத்துடன் வினைப்படும். இது வெள்ளி வளிமண்டலத்தில் மிகமிகச் சிறிய இம்மியளவாக உள்ள சல்பர்-டை-ஆக்சைடை மாற்றி சல்பர்-டிரை-ஆக்சைடாக மாற்றி வெள்ளி வளிமண்டலத்தில் இம்மியளவாக உள்ள நீராவியுடன் இணைந்து கந்தகக் காடி உருவாகுகின்றது.
வெள்ளியின் வளிமண்டலத்தின் குளிர்ந்த மேல் மட்டங்களில், கந்தகக் காடி நீர்ம வடிவில் இருக்கும், இதனால் கந்தகக் காடி வெள்ளி "முகில்"கள் கீழே உள்ள பரப்ப்புகளை மறைக்கின்றன. கோளின் முதன்மையான முகில்கள் கோளின் பரப்புக்கு மேல் 45–70 கி.மீ. வரை இருக்கின்றன. அடர்த்தி குறைந்த முகில்கள் 30 கி.மீ. முதல் 90 கி.மீ. வரையும் இருக்கும்.
Remove ads
உற்பத்தி
கந்தகக் காடி நேரடி செய்முறை (contact process) என்னும் முறைப்படி கந்தகம், ஆக்சிசன்,நீர் ஆகியவற்றை வேதியியல் வினைவழி இணையச்செய்து உருவாக்கப்படுகின்றது.
இச் செய்முறையின் முதற்படியில், கந்தகத்தை எரியச்செய்து சல்பர்-டை-ஆக்சைடு உருவாக்கப்படுகின்றது
இது பின்னர் வனேடியம்(V) ஆக்சைடை வினையூக்கியாக பயன்படுத்தி ஆக்சிசனைப் பயன்படுத்தி சல்பர்-டிரை-ஆக்சைடாக மாற்ற ஆக்சைடாக்கப்படுகின்றது.
- (2) 2 SO2 + O2(வ,g) → 2 SO3(வ,g) (in presence of V2O5)
இப்படி உருவாக்கப்பட்ட சல்பர்-டிரை-ஆக்சைடு, 97-98% H2SO4 உக்குள் உள்வாங்கப்பட்டு ஓலியம் (oleum)(H2S2O7) ஆக மாறுகின்றது - இது புகையும் கந்தகக் காடி (fuming sulfuric acid) என்றும் அழைக்கப்படுகின்றது. இந்த ஓலியம் (oleum) நீருடன் கலந்து அடர்த்தியான கந்தகக் காடியாக மாறுகின்றது
- (3) H2SO4(நீ,l) + SO3 → H2S2O7(நீ,l)
- (4) H2S2O7(நீ,l) + H2O(நீ,l) → 2 H2SO4(நீ,l)
SO3 ஐ நேரடியாக நீரில் கலப்பது செயல்படுத்தக் கடினமான முறை, ஏனெனில் அவ் வேதியியல் வினை வெப்பம் உமிழ் வினை. இவ்வினையின் விளைவாக நீர்ம வடிவில் கந்தகக் காடி பெறுவதற்கு மாறாக, மிகவும் அரிப்புத்திறன் கொண்ட நீர்மத்துளிவளி (aerosol) உருவாவதால் அவற்றை பிரிப்பது கடினமாக உள்ளது.
- (5) SO3(வ,g) + H2O(நீ,l) → H2SO4(நீ,l)
1900 ஆண்டுக்கு முன்னர் , கநகக்க் காடியை ஈய அறை செய்முறை (சேம்பர் புரோசசு, chamber process) என்னும் முறையால் படைத்தனர்[1].
Remove ads
இயற்பியல் பண்புகள்
வேதியியல் பண்புகள்
அடர்த்தி மிக்க கந்தக்காடியை சக்கரையுடன் (சீனியுடன்) இயையச் செய்தால் (வேதி வினைவழி தொழிற்படச்செய்தால்), சக்கரையில் உள்ள ஆக்சிசன், ஐதரசனை நீக்கி (அதாவது "நீரகற்றி"), புரைமையுடைய (porous) தனிக் கரிமத்தைப் பிரித்தெடுத்து விடுகின்றது. இதில் கந்தக்காடி, சக்கரையைப் பிரிப்பதற்கு மட்டுமே உதவுகின்றது, மற்றபடி அது விளையும் பொருட்களில் கலப்பதில்லை. இந்த வேதி வினையில், நீர் (வளிமமாக, ஆவியாக) வெளிப்படுகின்றது (எனவே நீரகற்றி வினை), வெப்பமும் வெளிப்படுகின்றது. இந்த வேதிப் பிரிகையை கீழ்க்காணுமாறு காட்டலாம் (இதன் விளைபொருட்களில் கந்தக்காடியின் கூறுகள் ஏதும் இல்லை என்பதைக் காணலாம்) :
- C12H22O11 → 12C + 11H2O
Remove ads
பயன்பாடுகள்

கந்தகக்காடி தொழிலகங்களில் பயன்படும் மிக முக்கியமான ஒரு பொருள். ஒரு நாட்டின் தொழி வளர்ச்சியின் அளவு அல்லது வலிமையைக் கந்தகக்காடியின் அளவைக் கொண்டு அளவிடலாம் என்பர் .[2] கந்தகக் காடியின் படைப்பு ஏறத்தாழ ஆண்டுக்கு அமெரிக்க $ 8 பில்லியன். ஆண்டொன்றுக்கு படைக்கப்படும் ஏறத்தாழ 165 மில்லியன் டன்னில் பெரும்பகுதி (உலகளாவிய படைப்பளவில் 60%) பாசுப்பேட்டு உரம் தயாரிக்க உதவும் பாசுபாரிக் காடி படைக்கவும், துணிசோப்பு (detergent) செய்யத் தேவைபப்டும் டிரைசோடியம் பாசுப்பேட்டு (trisodium phosphate) படைக்கவும் பயன்படுகின்றது.
Remove ads
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads