கால்சியம் நைட்ரேட்டு
வேதிச் சேர்மம் From Wikipedia, the free encyclopedia
Remove ads
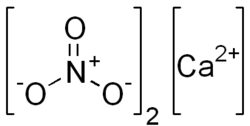
கால்சியம் நைட்ரேட் (Calcium nitrate) நோர்கெசல்பீட்டர் ( நோர்வே சால்ட்பீட்டர் ) என்றும் அழைக்கப்படுகிறது, இது Ca(NO3)2 என்ற மூலக்கூற்று வாய்ப்பாட்டை உடைய ஒரு கனிமச் சேர்மம் ஆகும். இந்த நிறமற்ற உப்பு காற்றில் இருந்து ஈரப்பதத்தை உறிஞ்சி பொதுவாக டெட்ராஐதரேட்டாகக் காணப்படுகிறது. இது முக்கியமாக உரங்களில் ஒரு அங்கமாகப் பயன்படுத்தப்படுகிறது, ஆனால் பிற பயன்பாடுகளையும் கொண்டுள்ளது. நைட்ரோகால்சைட் என்பது ஒரு நீரேற்றமடைந்த கால்சியம் நைட்ரேட் கனிமத்தின் பெயர் ஆகும். கால்சியம் அம்மோனியம் நைட்ரேட் டெகாஹைட்ரேட் மற்றும் கால்சியம் பொட்டாசியம் நைட்ரேட் டெகாஐதரேட்டு உள்ளிட்ட பல்வேறு தொடர்புடைய உப்புகள் அறியப்படுகின்றன.[2]
Remove ads
உற்பத்தி மற்றும் வினைத்திறன்
நோர்கெஸ்சால்ட்பீடர் 1905 ஆம் ஆண்டில் நார்வேயில் நோட்டோடென் எனுமிடத்தில் பிர்கலேண்டு-ஐட் முறை மூலம் தொகுக்கப்பட்டது. உலகின் பெரும்பாலான கால்சியம் நைட்ரேட் இப்போது போர்ஸ்ரூனில் தயாரிக்கப்படுகிறது.
நைட்ரிக் அமிலத்துடன் சுண்ணாம்புக்கல் (கால்சியம் கார்பனேட்) வினைப்படுத்துவதன் மூலமும் அதனைத் தொடர்ந்து அம்மோனியாவுடன் நடுநிலையாக்கப்படுவதன் மூலமும் இச்சேர்மம் தயாரிக்கப்படுகிறது:
- CaCO 3 + 2 HNO 3 → Ca (NO 3 ) 2 + CO 2 + H 2 O.
இது ஒடா செயல்முறையின் இடைநிலை விளைபொருளும் ஆகும்:
- Ca3(PO4)2 + 6 HNO3 + 12 H2O → 2 H3PO4 + 3 Ca(NO3)2 + 12 H2O
அம்மோனியம் நைட்ரேட் மற்றும் கால்சியம் ஐதராக்சைடு ஆகியவற்றின் நீர்க்கரைசலிலிருந்தும் இதை தயாரிக்கலாம்:
- 2 NH4 NO3 + Ca(OH)2 → Ca(NO3)2 + 2 NH4OH
தொடர்புடைய காரமண் உலோக நைட்ரேட்டுகளைப் போலவே, கால்சியம் நைட்ரேட் வெப்பமடையும் போது (500° செல்சியசில் தொடங்கி) சிதைவுற்று நைட்ரஜன் டை ஆக்சைடை வெளியிடுகிறது:[2]
- 2 Ca (NO 3 ) 2 → 2 CaO + 4 NO 2 + O 2 ΔH = 369 kJ / mol
Remove ads
பயன்பாடுகள்
விவசாயத்தில் பயன்பாடு
உர தரம் (15.5-0-0 + 19% Ca) பசுமைக்குடில் மற்றும் நீரியல் வளர்ப்பு வர்த்தகங்களில் பிரபலமானது; இது இரட்டை உப்பாக அம்மோனியம் நைட்ரேட் மற்றும் தண்ணீரைக் கொண்டுள்ளது. இது கால்சியம் அம்மோனியம் நைட்ரேட் என்று அழைக்கப்படுகிறது. அம்மோனியா இல்லாத மூலக்கூற்று வாய்ப்பாடுகளும் அறியப்படுகின்றன: Ca (NO3)2·4H2O (11.9-0-0 + 16.9 Ca) மற்றும் நீர்அற்ற கலவையாகவும் 17-0-0 + 23.6 Ca அறியப்படுகிறது. திரவ வடிவிலான ஒரு கலவையும் (9-0-0 + 11 Ca) நடைமுறையில் உள்ளது. ஒரு நீரற்ற, காற்றில் நிலைப்புத்தன்மை கொண்ட வழிப்பொருளான யூரியா அணைவுச் சேர்மமாகவும் Ca (NO3)2·4[OC(NH2)2] காணப்படுகிறது. இது கால்-யூரியா என விற்பனை செய்யப்படுகிறது.
கால்சியம் நைட்ரேட்டு சில தாவர நோய்களைக் கட்டுப்படுத்தவும் பயன்படுகிறது. உதாரணமாக, நீர்த்த கால்சியம் நைட்ரேட்டு மற்றும் கால்சியம் குளோரைடு தெளிப்பு ஆப்பிள் மரங்களில் கசப்புக் குழி மற்றும் தக்கைத் தடம் நோய்களைக் கட்டுப்படுத்தப் பயன்படுகிறது.[3]
கழிவு நீர் மேலாண்மை
கால்சியம் நைட்ரேட் கழிவு நீர் மேலாண்மையில் துர்நாற்றம் வெளியேற்றத் தடுப்பில் பயன்படுத்தப்படுகிறது. கழிவு நீர் பதப்படுத்துதலுக்கு முந்தைய நிலையில்கழிவு நீர் அமைப்பில் குறைவான அளவில் ஆக்சிசன் கரைந்த நீர் தொடர்பான உயிரியலை நிறுவுவதை அடிப்படையாகக் கொண்டது. நைட்ரேட் முன்னிலையில், சல்பேட்டுகளுக்கான வளர்சிதை மாற்றம் நிறுத்தப்படுகிறது, இதனால் ஐதரசன் சல்பைடு உருவாதலைத் தடுக்கிறது.[4] கூடுதலாக, எளிதில் சிதைக்கக்கூடிய கரிமப் பொருட்கள் நுகரப்படுகின்றன. அவ்வாறில்லையெனில் வளியில்லா நிலைமைகள் கீழ்நோக்கிச் செல்தலையும், அத்தோடு தானே துர்நாற்றம் உமிழும் நிலையையும் விளைவிக்கும். இந்த கருத்தியலானது மிகையான கழிவு மேலாண்மைக்கும் பொருந்தும்.[5]
கற்காரை
கற்காரைக் கலவைகளின் இறுகும் தன்மையை வேகப்படுத்த கால்சியம் நைட்ரேட்டு பயன்படுகிறது. கற்காரை மற்றும் காரையுடனான இந்த பயன்பர்ட இரண்டு விளைவுகளை அடிப்படையாகக் கொண்டது. கால்சியம் அயனியானது கால்சியம் ஐதராக்சைடின் உருவாக்கத்தை வேகப்படுத்துகிறது இதன் காரணமாக வீழ்படிவாதல் நிகழ்ந்து இறுகுதல் வேகப்படுத்தப்படுகிறது. இந்த விளைவானது, குளிர் பருவநிலை கற்காரை காரணிகள் மற்றும் சில ஒருங்கிணைந்த குழைவிப்பிகள் ஆகியவற்றிலும் பயன்படுகிறது.[6] நைட்ரேட்டு அயனி இரும்பு ஐதராக்சைடு உருவாதலுக்கும் வழிவகுக்கிறது. இதன் பாதுகாப்பு அடுக்கு அரிமானத்தைக் குறைத்து கற்காரை வலுப்படுத்துதலை அதிகரிக்கிறது.[7]
Remove ads
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads