Catálise encimática
incremento na velocidade dun proceso debido a unha encima From Wikipedia, the free encyclopedia
Remove ads
A catálise encimática é o incremento na velocidade dun proceso debido a unha biomolécula chamada "encima". A maioría dos encimas son proteínas, e a maioría deses procesos son reaccións químicas. Dentro do encima, a catálise xeralmente ten lugar nun sitio localizado chamado sitio activo.
A maioría dos encimas están constituídos predominantemente por proteínas, e poden constar dunha soa cadea proteica ou de moitas cadeas no caso dun complexo multisubunidades. Os encimas adoitan incorporar tamén compoñentes non proteicos, como ións metálicos ou moléculas orgánicas especializadas chamadas cofactores (por exemplo, o adenosín trifosfato). Moitos cofactores son vitaminas e o seu papel como vitaminas está ligado directamente ao seu uso na catálise de procesos biolóxicos do metabolismo. A catálise de reaccións bioquímicas na célula é vital porque practicamente todas as reaccións metabólicas esenciais teñen velocidades moi lentas se non están catalizadas. Un impulsor da evolución das proteínas é a optimización de tales actividades catalíticas, aínda que só os encimas máis fundamentais funcionan preto dos límites de eficiencia catalíticos, e moitos encimas están moi lonxe do óptimo. Importantes factores na catálise encimática son a catálise ácida e básica xeral, a dirección dos orbitais, a restrición entrópica, os efectos de orientación (é dicir, a catálise de chave e pechadura), así como os efectos de movemento propios da dinámica de proteínas.[1]
Os mecanismos da catálise encimática varían, mais son todos similares en principio a outros tipos de catálise química no sentido que o factor crucial é unha redución da(s) barreira(s) de enerxía que separan os reactivos (ou os substratos) dos produtos. A redución da enerxía de activación (Ea) incrementa a fracción de moléculas reactantes que poden superar esta barreira e formar o produto. Un importante principio é que como só reducen as barreiras de enerxía entre produtos e reactivos, os encimas sempre catalizan reaccións en ambas as direccións e non poden impulsar unha reacción cara a adiante ou afectar a posición do equilibrio e só afectan a velocidade con que se chega a este. Igual que acontece con outros catalizadores, o encima non se consome nin cambia pola reacción (como si o fai o substrato) senón que se recicla de tal maneira que un só encima pode realizar moitas roldas de catálise.
Os encimas adoitan ser moi específicos e actuan soamente sobre certos substratos. Algúns encimas son absolutamente específicos, o que significa que actúan soamente sobre un substrato, mentres que outros mostran unha especificidade de grupo e poden actuar sobre grupos químicos similares pero non idénticos, como o enlace peptídico en diferentes moléculas. Moitos encimas teñen especificidade estereoquímica e actúan sobre un estereoisómero pero non sobre outro.[2]
Remove ads
Axuste inducido

O modelo clásico da interacción encima-substrato é o modelo de axuste inducido.[3] Este modelo propón que a interacción inicial entre o encima e o substrato é relativamente débil, pero que estas débiles interaccións inducen rapidamente cambios conformacionais no encima que reforzan a unión.
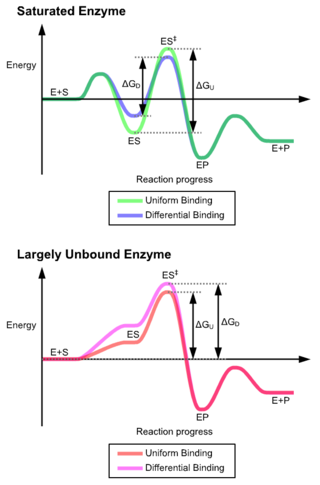
As vantaxes do mecanismo de axuste inducido débense ao efecto estabilizador da unión forte do encima. Hai dous mecanismos de unión do substrato: a unión uniforme, que ten unha unión forte do substrato, e a unión diferencial, que ten unha unión do estado de transición forte. O efecto estabilizador da unión uniforme incrementa a afinidade tanto do substrato coma do estado de transición, mentres que a unión diferencial incrementa só a afinidade de unión do estado de transición. Os encimas poden usar ambos e escolléronse evolutivamente para minimizar a enerxía de activación da reacción. Os encimas que están saturados, é dicir, que teñen unha alta afinidade de unión do substrato, requiren a unión diferencial para reducir a enerxía de activación, mentres que encimas con substrato pequeno non unido poden usar a unión diferencial ou a uniforme.[4]
Estes efectos levaron a que a maioría das proteínas usen o mecanismo de unión diferencial para reducir a enerxía de activación, así a maioría dos substratos teñen unha alta afinidade polo encima, mentres están no estado de transición. A unión diferencial é levada a cabo polo mecanismo de axuste inducido: o substrato únese primeiro feblemente, despois o encima cambia a conformación incrementando a afinidade do estado de transición e estabilizándoo, reducindo así a enerxía de activación necesaria para alcanzalo.
Porén, é importante aclarar que o concepto de axuste inducido non se pode usar para racionalizar a catálise. É dicir, a catálise química defínese como a redución de Ea‡ (cando o sistema está xa no ES‡) en relación á Ea‡ da reacción non catalizada en auga (sen o encima). O axuste inducido só suxire que a barreira é máis baixa na forma pechada, pero non nos di nada sobre a razón pola que se produciu esta redución da barreira.
O axuste inducido pode ser beneficioso para a fidelidade do recoñecemento molecular en presenza de competición e ruído por medio do mecanismo de corrección de probas conformacional.[5]
Remove ads
Mecanismos de rutas de reacción alternativas
Estes cambios conformacionais tamén aproximan residuos catalíticos do sitio activo para que queden preto dos enlaces químicos dos substratos que serán alterados na reacción. Despois de que se produce a unión, un ou máis mecanismos de catálise rebaixan a enerxía do estado de transición da reacción, ao promoveren unha vía química alternativa para a reacción. Hai seis posibles mecanismos de catálise "por riba da barreira" e un mecanismo "a través da barreira", que son os seguintes:
Proximidade e orientación
As interaccións encima-substrato deixan aliñados os grupos químicos reactivos e mantéñenos moi xuntos nunha xeometría óptima, que incrementa a velocidade da reacción. Isto reduce a entropía dos reactantes e así fai que as reaccións de adición ou transferencia sexan menos desfavorables, de aí a redución na entropía global cando os dous reactantes se converten nun só produto. Porén, isto é un efecto xeral e dáse en reaccións de non adición ou de transferencia nas que isto ocorre debido a un incremento na "concentración efectiva" dos reactivos. Isto compréndese cando se considera como os incrementos na concentración orixinan un aumento da velocidade da reacción: esencialmente cando os reactantes están máis concentrados, colisionan con máis frecuencia e por iso reaccionan máis a miúdo. Na catálise encimática, a unión dos reactivos ao encima restrinxe o espazo conformacional dos reactantes, manténdoos na "orientación axeitada" e moi próximos entre si, así que coliden máis frecuentemente, e coa xeometría correcta, facilitan a reacción desexada. A "concentración efectiva" é a concentración que tería que haber do reactante, libre en solución, para que experimente a mesma frecuencia colisional. A miúdo esas concentracións efectivas teóricas son imposibles fisicamente e irrealizables na práctica, o cal é un testemuño do gran poder catalítico de moitos encimas, que causan un incremento masivo na velocidade respecto do estado non catalizado.
| Por exemplo: |
| Ocorrerán reaccións similares moito máis rápido se a reacción é intermolecular. |
 |
| A concentración efectiva do acetato na reacción intramolecular pode estimarse como k2/k1 = 2 x 105 Molar. |
Porén, a situación podería ser máis complexa, porque os estudos computacionais modernos estableceron que os exemplos tradicionais de efectos de proximidade non poden ser relacionados directamente con efectos entrópicos encimáticos.[6][7][8] Ademais, atopouse que a proposta entrópica orixinal[9] sobreestimou en gran medida a contribución da entropía da orientación á catálise.[10]
Doantes ou aceptores de protóns
Os doantes e aceptores de protóns, é dicir, os ácidos e bases poden doar e aceptar protóns para estabilizaren o desenvolvemento de cargas no estado de transición. Isto está relacionado co principio de catálise global, o da redución das barreiras de enerxía, xa que os estados de transición xerais son estados de alta enerxía, e ao estabilizalos, esta alta enerxía redúcese, rebaixando a barreira. Unha característica clave da catálise encimática de moitas catálises non biolóxicas é que tanto a catálise ácida coma a básica poden combinarse na mesma reacción. En moitos sistemas abióticos, os ácidos (a gran [H+]) ou bases (a gran concentración de H+ faise mínima, ou especies con pares de electróns) poden incrementar a velocidade da reacción; pero, por suposto, o ambiente só pode ter un pH global (medida da acidez ou basicidade (alcalinidade)). Porén, como os encimas son moléculas grandes, poden situar tanto os grupos ácidos coma básicos no seu sitio activo para interaccionaren cos seus substratos, e empregan ambos os modos independentemente do pH.
A miúdo a catálise xeral ácida ou básica emrégase para activar nucleófilos e/ou grupos electrófilos, ou para estabilizar os grupos saíntes. Moitos aminoácidos con grupos ácidos e básicos empréganse no sitio activo, como o ácido glutámico, ácido aspártico, histidina, cisteína, tirosina, lisina e arxinina, así como a serina e treonina. Ademais, emprégase a miúdo o esqueleto molecular do péptido, cos grupos con N carbonilo e amida. A cistina e a histidina están implicadas con moita frecuencia, xa que ambas as dúas teñen unha pKa próxima ao pH neutro e poden ambas, polo tanto, aceptar e doar protóns.
Moitos mecanismos de reacción que implican a catálise ácida/básica supoñen un pKa substancialmente alterado. Esta alteración do pKa é posible por medio do ambiente local do residuo [Cómpre referencia].
O pKa pode tamén ser influenciado significativamente polo ambiente que o rodea, ata o punto de que os residuos que son básicos en solución poden actuar como doantes de protóns e viceversa.
| Por exemplo: |
| Tríade catalítica dunha serina protease |
 |
| O paso inicial do mecanismo catalítico da serina protease implica que a histidina do sitio activo acepta un protón do residuo de serina. Isto prepara a serina como nucleófilo para atacar o enlace amida do substrato. Este mecanismo inclúe a doazón dun protón da serina (unha base, pKa 14) á histidina (un acido, pKa 6), o que é posible debido ao ambiente local das bases. |
A modificación dos pKa é unha parte do mecanismo electrostático.[11] O efecto catalítico do exemplo de arriba está asociado principalmente coa redución do pKa do oxianión e o incremento no pKa da histidina, mentres que a transferencia de protóns desde a serina á histidina non está catalizado significativamente, xa que non é a barreira limitante da velocidade.[12] Nótese que no exemplo mostrado, o ácido conxugado da histidina actúa como catalizador ácido xeral para a subseguinte perda da amina dun intermediario tetraédrico. Porén, as evidencias que apoian este mecanismo proposto (Figura 4 da seguinte referencia)[13] foron controvertidas.[14]
Catálise electrostática
A estabilización de estados de transición cargados pode tamén producirse por residuos do sitio activo que forman enlaces iónicos (ou interaccións de cargas iónicas parciais) co intermediario. Estes enlaces poden proceder de cadeas laterais ácidas ou básicas atopadas en aminoácidos como a lisina, arxinina, ácido aspártico ou ácido glutámico ou procederen de cofactores metálicos como o cinc. Os ións metálicos son especialmente efectivos e poden reducir o pKa da auga o suficiente para facer que sexa un nucleófilo efectivo.
Estudos de simulación por computador sistemática estableceron que os efectos electrostáticos proporcionan, con gran diferenza, a maior contribución á catálise.[11] Isto pode incrementar a velocidade da reacción nun factor de ata 107.[15] En concreto, viuse que o encima proporciona un ambiente que é máis polar que a auga, e que os estados de transición iónica están estabilizados por dipolos fixos. Isto é moi diferente da estabilización do estado de transición na auga, onde as moléculas de auga deben pagar cunha "enerxía de reorganización"[16] para estabilizaren os estados iónicos e cargados. Así, a catálise está asociada co feito de que os grupos polares do encima están preorganizados[17]
A magnitude do campo electrostático exercido polo sitio activo do encima nunca mostrou estar altamente correlacionado coa mellora da velocidade catalítica do encima.[18]
A unión do substrato xeralmente exclúe a auga do sitio activo, rebaixando dese xeito a constante dieléctrica local á dun solvente orgánico. Isto reforza as interaccións electrostáticas entre os substratos cargados polares e os sitios activos. Ademais, a distribución de cargas nos sitios activos está disposta de modo que estabilice os estados de transición das reaccións catalizadas. En varios encimas estas distribucións de cargas serven para guiar os substratos polares cara aos seus sitios de unión para que as velocidades destas reaccións encimáticas sexan maiores que os seus límites controlados pola difusión aparente.[Cómpre referencia].
| Por exemplo: |
| Mecanismo catalítico da carboxipeptidase |
 |
| O intermediario tetraédrico está estabilizado por un enlace iónico parcial entre o ión Zn2+ e a carga negativa sobre o oxíxeno. |
Catálise covalente
A catálise covalente supón que o substrato forma un enlace covalente transitorio con residuos do sitio activo do encima ou cun cofactor. Isto engade un intermediario covalente adicional á reacción, e axuda a reducir a enerxía de estados de transición posteriores da reacción. O enlace covalente debe romper nun estado posterior da reacción para rexenerar o encima. Este mecanismo é utilizado pola tríade catalítica de encimas como as proteases, como a quimotripsina e a tripsina, nas que se formou un intermediario acil-encima. Un mecanismo alternativo é a formación dunha base de Schiff usando a amina libre dun residuo de lisina, como se observa no encima aldolase durante a glicólise.
Algúns encimas utilizan cofactores non aminoácidos como o fosfato de piridoxal (PLP) ou o pirofosfato de tiamina (TPP) para formaren intermediarios covalentes con moléculas reactantes.[19][20] Tales intermediarios covalentes funcionan reducindo a enerxía de estados de transición posteriores, de xeito similar a como os intermediarios covalentes formados con residuos de aminoácidos do sitio activo permiten a estabilización, pero as capacidades dos cofactores permiten que os encimas leven a cabo reaccións que os residuos laterais de aminoácidos por si sós non poderían realizar. Entre os encimas que utilizan ditos cofactores están o encima dependente de PLP aspartato transaminase e o encima dependente de TPP piruvato deshidroxenase.[21][22]
En vez de rebaixar a enerxía de activación para unha vía de reacción, a catálise covalente proporciona unha vía alternativa para a reacción (por medio dun intermediario covalente) e, polo tanto, é distinta dunha verdadeira catálise.[11] Por exemplo, a enerxética do enlace covalente cunha molécula de serina na quimotripsina debería compararse co enlace covalente ben coñecido co nucleófilo nunha reacción en solución non catalizada. Unha verdadeira proposta de catálise covalente (na cal a barreira é menor que a correspondente barreira en solución) requiriría, por exemplo, un enlace covalente parcial co estado de transición por un grupo do encima (por exemplo, un enlace de hidróxeno moi forte), e tales efectos non contribúen significativamente á catálise.
Catálise de ión metálico
Un ión metálico no sitio activo participa na catálise ao coordinar a estabilización de carga e o apantallamento. Debido á carga positiva do metal, soamente se poden estabilizar cargas negativas por medio de ións metálicos.[23] Con todo, os ións metálicos son vantaxosos na catálise biolóxica porque non son afectados polos cambios no pH.[24] Os ións metálicos poden tamén actuar ionizando a auga ao funcionaren como un ácido de Lewis.[25] Os ións metálicos tamén poden ser axentes de oxidación e redución.[26]
Tensión de enlace
Este é o efecto principal da unión por axuste inducido, no cal a afinidade do encima polo estado de transición é maior que o do propio substrato. Isto induce redistribucións estruturais na molécula que tensionan enlaces do substrato nunha posición máis próxima á conformación do estado de transición, rebaixando así a diferenza de enerxía entre o substrato e o estado de transición e axudan a catalizar a reacción
Porén, o efecto de tensión, de feito, é máis ben un efecto de desestabilización do estado fundamental, que un efecto de estabilización do estado de transición.[11][27] Por outra parte, os encimas son moi flexibles e non poden aplicar un grande efecto de tensión.[28]
Ademais da tensión de enlace exercida sobre o substrato, esta pode inducirse tamén no propio encima para activar residuos do sitio activo.
| Por exemplo: |
| Conformacións do substrato, substrato unido e estado de transición do encima lisocima. |
| O substrato, ao unirse, é distorsionado desde a súa conformación de media cadeira do anel de hexosa (debido aos impedimentos estéricos con aminoácidos da proteína que forzan o C6 ecuatorial a estar na posición axial) á conformación de cadeira,[29] o cal é similar en forma ao estado de transición. |
Efecto túnel cuántico
Estes mecanismos tradicionais "por riba da barreira" foron postos en dúbida nalgúns casos por modelos e observacións de mecanismos "a través da barreira" (o efecto túnel cuántico). Algúns encimas operan con cinéticas que son máis rápidas do que se prediría polo clásico ΔG‡. Nos modelos "a través da barreira", un electrón ou un protón poden tunelizarse a través de barreiras de activación.[30][31] O efecto túnel cuántico de protóns foi observado na oxidación da triptamina por unha amina aromática deshidroxenase.[32]
O efecto túnel cuántico non parece proporcionar unha vantaxe catalítica importante, xa que as contribucións do efecto túnel son similares nas reaccións catalizadas e non catalizadas en solución.[31][33][34][35] Porén, a contribución do efecto túnel (normalmente aumentando as constantes de velocidade nun factor de ~1000[32] comparadas coa velocidade de reaccións na ruta clásica "por riba da barreira") é probablemente crucial para a viabilidade dos organismos biolóxicos. Isto salienta a importancia xeral das reaccións de efecto túnel en bioloxía.
En 1971-1972 formulouse un dos primeiros modelos de mecánica cuántica da catálise encimática.[36][37]
Encima activo
A enerxía de unión do complexo encima-substrato non se pode considerar como unha enerxía externa que é necesaria para a activación do substrato. O contido de alta enerxía do encima pode transferirse primeiramente a algún grupo enerxético específico X1 desde o sitio catalítico do encima ao sitio final do primeiro reactante unido, despois debe transferirse outro grupo X2 do segundo reactante (ou do segundo grupo do reactante único) ao sitio activo para finalizar a conversión do substrato en produto e a rexeneración do encima.[38]
Podemos presentar a reacción encimática completa como dúas reaccións acopladas:
-
S
1 + EX
1 → S
1EX
1 → P
1 + EP
2(1)
-
S
2 + EP
2 → S
2EP
2 → P
2 + EX
2(2)
Pode verse na reacción (1) que o grupo X1 do encima activo aparece no produto debido á posibilidade dunha reacción de intercambio dentro do encima para evitar a inhibición electrostática e a repulsión de átomos. Así, representamos o encima activo como un poderoso reactante da reacción encimática. A reacción (2) mostra a conversión incompleta do substrato porque o seu grupo X2 permanece dentro do encima. Este enfoque foi proposto anteriormente como idea que dependía das conversións encimáticas hipoteticamente extremadamente altas (encima cataliticamente perfecto).[39]
O punto esencial para a verificación do presente enfoque é que o catalizador debe ser un complexo do encima co grupo de transferencia da reacción. Este aspecto químico é apoiado polos mecanismos ben estudados das diversas reaccións encimáticas. Consideremos a reacción da hidrólise do enlace peptídico catalizada por unha proteína pura como a α-quimotripsina (un encima que actúa sen cofactor), o cal é un membro ben estudado da familia das serina proteases, ver.[40]
Presentamos os resultados experimentais desta reacción como dous pasos químicos:
-
S
1 + EH → P
1 + EP
2(3)
-
EP
2 + H−O−H → EH + P
2(4)
onde S1 é un polipéptido, P1 e P2 son produtos. O primeiro paso químico (3) comprende a formación dun intermediario acil-encima covalente. o segundo paso (4) é o paso de desacilación. É importante sinalar que o grupo H+, atopado inicialmente no encima, pero non na auga, aparece no produto antes do paso de hidrólise; polo tanto, pode considerarse como un grupo adicional da reacción encimática.
Así, a reacción (3) mostra que o encima actúa como un poderoso reactante da reacción. De acordo co concepto proposto, o transporte de H desde o encima promove a primeira conversión de reactante, a rotura do primeiro enlace químico inicial (entre os grupos P1 e P2). O paso de hidrólise causa a rotura do segundo enlace químico e a rexeneración do encima.
Os mecanismos químicos propostos non dependen da concentración dos substratos ou produtos no medio. Porén, un cambio nas súas concentraccións causa principalmente cambios na enerxía libre no primeiro e no último pasos das reaccións (1) e (2) debido aos cambios no contido de enerxía libre de cada molécula, sexa S ou P, en solución acuosa. Esta estratexia está de acordo co seguinte mecanismo da contracción muscular. O paso final da hidrólise do ATP no músculo esquelético é a liberación do produto causada pola asociación das cabezas de miosina coa actina.[41] O peche da fenda de unión da actina durante a reacción de asociación está acoplada estruturalmente coa apertura do peto de unión do nucleótido no sitio activo da miosina.[42]
Os pasos finais da hidrólise do ATP inclúen a liberación rápida de fosfato e a liberación lenta de ADP.[43][44] A liberación dun anión fosfato do anión ADP unido en solución acuosa pode ser considerada como unha reacción exergónica porque o anión fosfato ten unha baixa masa molecular.
Así, chegamos á conclusión de que a liberación primaria do fosfato inorgánico H2PO4− causa a transformación dunha parte significativa da enerxía libre da hidrólise de ATP na enerxía cinética do fosfato solvatado, producindo streaming activo (fluxo de subestruturas celulares causado pola miosina e actina como o da ciclose, neste caso o deslizamento de filamentos na fibra muscular). Esta suposición dunha transdución mecano-química local está de acordo co mecanismo de Tirosh da contracción muscular, na cal a forza muscular deriva dunha acción integrada de streaming activo creado pola hidrólise de ATP.[45][46]
Remove ads
Exemplos de mecanismos catalíticos
En realidade, a maioría dos mecanismos encimáticos implican unha combinación de varios tipos de catálise.
Triosa-fosfato isomerase
A triosa-fosfato isomerase (EC 5.3.1.1) cataliza a interconversión reversible das dúas triosas fosfato isómeras dihidroxiacetona fosfato e D-gliceraldehido 3-fosfato. O mecanismo catalítico implica a formación dun intermediato "enediol".
Tripsina
A tripsina (EC 3.4.21.4) é unha serina protease que cliva substratos proteicos despois de residuos de lisina ou arxinina usando unha tríade catalítica para realizar unha catálise covalente, e un burato oxianión para estabilizar a acumulación de carga nos estados de transición.
Aldolase
A aldolase (ou frutosa-bisfosfato aldolase EC 4.1.2.13) cataliza a rotura dunha frutosa 1,6-bisfosfato (F-1,6-BP) en gliceraldehido 3-fosfato e dihidroxiacetona fosfato (DHAP). Forma un intermediario base de Schiff protonado unido a unha lisina do sitio activo moi conservada co carbono carbonilo da DHAP. Adicionalmente, os residuos de tirosina son cruciais neste mecanismo porque actúan como aceptores de hidróxeno estabilizantes.
Difusividade encimática
A aparición de estudos dunha soa molécula na década de 2010 levou á observación de que o movemento de encimas non fixados increméntase co aumento da concentración de substrato e aumenta a entalpía de reacción.[47] Posteriores observacións suxiren que este incremento en difusividade é impulsado polo desprazamento transitorio do centro de masas do encima, resultando nun "efecto de retroceso que propulsa o encima".[48]
Remove ads
Semellanza da reacción
A semellanza entre reaccións encimáticas (EC) pode calcularse usando datos dos cambios de enlaces, os centros de reacción ou as métricas de subestruturas (EC-BLAST Arquivado 30 de maio de 2019 en Wayback Machine.).[49]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
