Timeline
Chat
Prospettiva
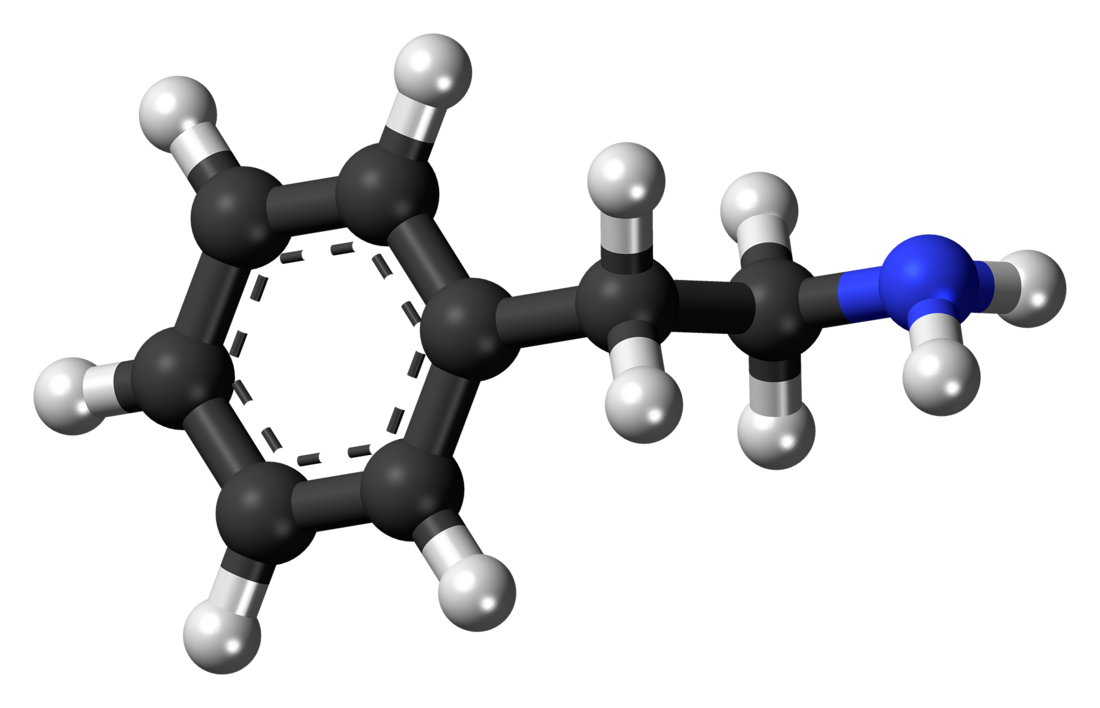
2-feniletilammina
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
La 2-feniletilammina (PEA) è un composto chimico di formula C8H11N che in condizioni standard si presenta come un liquido incolore e lievemente giallastro,[7] dall'odore di pesce.[8]
Remove ads
Storia
Dal gennaio 2015 il composto è incluso nella Lista delle sostanze proibite dell'Agenzia mondiale antidoping (WADA).[9]
Caratteristiche strutturali e fisiche
Strutturalmente si tratta di una etilammina, CH3CH2NH2, con uno degli atomi di idrogeno sul secondo atomo di carbonio sostituito da un gruppo fenilico. Viene classificata come ammina aromatica,[10] ammina primaria,[11] alcaloide e aralchilammina.[12]
Il composto risulta:
- molto solubile in etanolo ed etere;[13]
- solubile in tetracloruro di carbonio,[13] acqua e alcol.[14]
Per decomposizione termica produce fumi contenenti ossidi di carbonio e ossidi di azoto.[15]
| N. di atomi pesanti | 9 |
| N. di donatori di legami a idrogeno | 1 |
| N. di accettori di legami a idrogeno | 1 |
| N. di legami ruotabili | 2 |
| Massa monoisotopica | 121,089149355 u |
| Superficie polare | 26 Ų |
| Sezione d'urto | 117,85 Ų [M+H-NH3]+ |
| Gravità specifica[7] | 0,96 a 15 °C |
| Gravità specifica del vapore[7] | 4,18 |
| Pressione di vapore[18] | 31 Pa o 0,23 mm Hg a 20 °C |
Remove ads
Abbondanza e disponibilità
Il composto è naturalmente presente in:
- scarabeo del fagiolo messicano (E. varivestis)[19]
- cuscino di Lyallia (L. kerguelensis)[20]
- A. maurorum[21]
- genere Lissoclinum[22] e Symploca[23]
- crescione d'acqua (N. officinale)[24]
- giglio di mare (P. biflorum)[25]
- alcune specie delle Prosopis (P. alba,[26] P. alpataco, P. argentina, P. chilensis, P. flexuosa, P. pugionata[27])
- P. semilanceata[28]
- R. fraxinea[29]
- alcune specie delle crassulacee (S. album, S. lydium, S. meyeri-johannis)[30]
- alcune specie delle cactaceae (T. lophophoroides, T. pseudomacrochele, T. pseudopectinatus, T. schmiedickeanus)[31]
- T. ruticarpum[32]
- alcune specie di acacia: A. harpophylla, A. kettlewelliae,[33] S. berlandieri,[34] V. rigidula[35]
- sarivan (P. gangeticus)[36]
- desmodio (G. triflora)[37]
- H. fasciculare[38]
- tabacco (N. tabacum)[39]
- A. pseudalhagi[21]
- canapa (C. sativa)[40]
- vite comune (V.vinifera)[41]
La PEA è contenuta anche in diversi alimenti, tra i quali spiccano il cioccolato (3,5 - 8,02 μg/g),[42] i vini[43] e gli alimenti che subiscono fermentazione microbica come i formaggi.[44]
Sintesi
Il composto può essere sintetizzato:
- riducendo il cianuro di benzile con sodio e alcol[45] o con nichel Raney;[46]
- da alcol 2-feniletilico e ammoniaca sotto pressione.[14]
Reattività e caratteristiche chimiche
Si tratta della base coniugata del 2-feniletilammonio[12] e di una base forte. Il composto è in grado di assorbire l'anidride carbonica dall'aria.[47] Il composto è incompatiile con forti agenti ossidanti, rame, leghe di rame, acidi forti e ottone.[15] Il pH del composto in soluzione acquosa è pari a 11,5 a 20 °C.[48]
| Standard apolare | 1.069,9, 1.115, 1.098, 1.133, 1.120, 1.125, 1.100, 1.079, 1.111 |
| Semi-standard apolare | 1.100,7 , 1.103 |
| Standard polare | 1.605, 1.622, 1.638 |
Spettri analitici
Derivati
Le feniletilammine sostituite rappresentano una ampia e variegata classe di composti con diversi ruoli ed effetti fisiologici, alcuni dei quali sono sfruttati in farmacologia. Sono inclusi neurotrasmettitori, ormoni, sostanze stimolanti, allucinogeni e altre sostanze psicoattive, anoressizzanti, broncodilatatori e antidepressivi.[58]
Remove ads
Biochimica
Riepilogo
Prospettiva
Il composto è un metabolita prodotto da E. coli[59] e S. cerevisiae.[60] Risulta particolarmente concentrato nelle urine degli animali carnivori, mentre in quelli degli erbivori i suoi livelli risultano inferiori.[61] Nei topi esistono dei recettori specifici (TAAR4) in grado di recepire anche livelli minimi del composto che permettono all'animale di evitare i predatori.[11][61]
La 2-feniletilammina è un costituente endogeno del cervello umano ed è implicata nella trasmissione degli impulsi cerebrali (neuromodulatore).[62] Si trova in tracce nel cervello con una distribuzione eterogenea: i valori più elevati si riscontrano nelle strutture mesolimbiche. In particolare, essa influenza in maniera significativa l'assorbimento e la secrezione di noradrenalina, dopamina e serotonina, nonché può interagire direttamente con i recettori di diverse monoammine (es. agonista diretto dei recettori della dopamina).[42]
Biosintesi
Viene sintetizzata nel cervello tramite decarbossilazione enzimatica della fenilalanina[63] in neuroni dopaminergici e rapidamente metabolizzata.[42]
Patologie associate
Il composto è stato implicato nella patogenesi dell'emicrania.[64] La ricerca ha inoltre evidenziato il legame tra bassi livelli del composto con la depressione e stati maniacali.[42]
Remove ads
Farmacologia e tossicologia
Riepilogo
Prospettiva
Farmacocinetica
La farmacocinetica plasmatica della feniletilamina può essere descritta da una cinetica del primo ordine, con un'emivita stimata di circa 5-10 minuti.[65] La 2-feniletilammina viene metabolizzata attraverso una serie di reazioni enzimatiche: la prima è catalizzata dalla monoammino ossidasi B (MAO-B) che converte il composto in fenilacetaldeide (un intermedio reattivo), seguita dall'ossidazione ad opera dell'aldeide idrogenasi, in misura minore anche dalla xantina ossidasi e dall'aldeide ossidasi, che trasformano l'aldeide in acido fenilacetico.[62] Il composto viene escreto attraverso le urine.[47]
Farmacodinamica
Dal punto di vista farmacologico assomiglia all'amfetamina.[10] Nei ratti la somministrazione sistemica di β-feniletilammina causa una sindrome comportamentale coerente con l'attivazione dei recettori della serotonina nel sistema nervoso centrale. La riduzione dei livelli endogeni di serotonina non ha impedito la comparsa della sindrome. La metisergide e la mianserina, hanno bloccato gli effetti della beta-fenetilamina. La β-fenetilamina esercita effetti serotoninergici attraverso un'azione diretta da agonista della serotonina.[18]
Effetti del composto e usi clinici
Non si ritiene che, assunta per via alimentare, possa avere effetti psicoattivi,[66] tuttavia essa rappresenta la struttura fondamentale di numerosi farmaci con proprietà stimolanti.[9] Viene inoltre utilizzata per la preparazione di farmaci antidepressivi e antidiabetici.[48]
Tossicologia
Il composto è un irritante cutaneo e una neurotossina.[10] In uno studio effettuato sui topi ha dimostrato che il composto causa l'inibizione dell'NADH:ubichinone ossidoreduttasi (complesso I mitocodriale) portando alla formazione di radicali idrossilici e alla deplezione delle ammine biogene del corpo striato con conseguenti disfunzioni psico-motorie.[67]
Le intossicazioni da PEA possono essere gravi nei giovani e negli individui sani. I sintomi più frequentemente riportati includono:[18]
- ansia e allucinazioni (49%),
- midriasi e mal di testa (41%),
- tachicardia (40%),
- ipertensione (15%).
Sono state osservate anche complicazioni come: convulsioni (7%), arresto cardiaco (5%), miocardite tossica (1%) e ictus emorragico (1%). La PEA è risultata teratogena a concentrazioni osservate negli individui affetti da fenilchetonuria.[18] A contatto con la pelle provoca ustioni. Se inalato può provocare corrosione delle alte vie respiratorie. Risulta tossico se ingerito.[47]
L'esposizione professionale alla 2-feniletilammina può avvenire per inalazione e contatto dermico con questo composto nei luoghi di lavoro dove viene prodotto o utilizzato. I dati di monitoraggio indicano che la popolazione generale potrebbe essere esposta alla 2-feniletilammina tramite ingestione di alimenti contenenti questa sostanza chimica.[18]
Remove ads
Applicazioni
Il composto viene utilizzato:
Impatto ambientale
Riepilogo
Prospettiva
Se rilasciato nell'aria, sulla base del valore della pressione di vapore, la 2-feniletilammina esisterà esclusivamente come vapore nell'atmosfera dove verrà degradata tramite reazioni con radicali idrossilici prodotti fotochimicamente. L'emivita media di questa reazione è stimata in 10 ore. La 2-feniletilammina non contiene cromofori che assorbono a lunghezze d'onda superiori a 290 nm e, pertanto, non è previsto che sia soggetto a fotolisi diretta da parte della luce solare.[18]
Se rilasciato nel suolo, il 2-feniletilammina dovrebbe avere un'elevata mobilità sulla base di un coefficiente di ripartizione organico-carbonio (Koc) calcolato di 120. Il pKa del composto indica che questo esisterà quasi interamente in forma cationica e che tenderà ad adsorbirsi più fortemente ai suoli contenenti carbonio organico e argilla rispetto alle loro controparti neutre. La volatilizzazione dal suolo umido non è prevista poiché il composto esiste come catione e i cationi non volatilizzano. La 2-feniletilammina non dovrebbe volatilizzare dalle superfici del suolo asciutto sulla base della sua pressione di vapore.[18]
Utilizzando il test MITI giapponese, è stato raggiunto il 58% della DBO teorica in 2 settimane, indicando che la biodegradazione potrebbe essere un importante processo di destino ambientale nel suolo e nell'acqua. Se rilasciata in acqua, la 2-feniletilammina dovrebbe adsorbirsi a solidi sospesi e sedimenti sulla base del Koc. La volatilizzazione dalle superfici dell'acqua non è prevista come un processo di destino importante sulla base del pKa. Un BCF stimato di 4 suggerisce che il potenziale di bioconcentrazione negli organismi acquatici è basso. L'idrolisi non è prevista come un importante processo di destino ambientale poiché questo composto non ha gruppi funzionali che idrolizzano nelle condizioni ambientali (pH 5-9).[18]
Note
Voci correlate
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads