Timeline
Chat
Prospettiva
Solfolene
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
Il solfolene, o butadiene solfone è un composto organico ciclico contenente un gruppo funzionale solfone. È un solido cristallino bianco e inodore, è conservabile indefinitamente, e si dissolve in acqua e diversi solventi organici.[1] Il composto è usato come fonte di butadiene.[2]
Remove ads
Produzione

Il solfolene è formato dalla reazione cheletropica di butadiene e diossido di zolfo. Questa reazione è solitamente condotta all'interno di un contenitore autoclave. Sono aggiunte piccole dosi di idrochinone o pirogallolo per inibire la polimerizzazione del diene. La reazione a temperatura ambiente procede nel corso di alcuni giorni, mentre a 130°C impiega solo 30 minuti.[3] Una procedura analoga produce il solfone derivato dall'isoprene.[4]
Remove ads
Reazioni
Riepilogo
Prospettiva
Reattività con acidi e basi
Il solfolene non è attaccato dagli acidi: può perfino essere ricristallizzato in acido nitrico concentrato.[5][6]
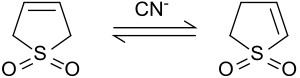
In condizioni alcaline e in presenza di ossido di deuterio, i protoni nelle posizioni 2 e 5 vengono rapidamente sostituiti dal deuterio.[7] Il cianuro di sodio catalizza questa reazione.[8]
Isomerizzazione in 2-solfolene
In presenza di una base o di un cianuro, il 3-solfolene si isomerizza in un equilibrio di 2-solfolene e 3-solfolene.[8]
A 50°C l'equilibrio ottenuto contiene il 42% di 3-solfolene e il 58% di 2-solfolene.[9] Scaldando la miscela di isomeri per diversi giorni a 100°C, è possibile isolare il 2-solfolene, più termodinamicamente stabile, come sostanza pura sottoforma di placche bianche (Tf = 48-49°C); questo per via della decomposizione del 3-solfolene a temperature superiori a 80°C.[10]
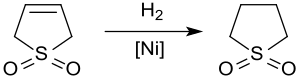
Idrogenazione
L'idrogenazione catalitica produce solfolano, un solvente utilizzato nell'industria petrolchimica per l'estrazione dei composti aromatici dagli altri idrocarburi. L'idrogenazione del 3-solfolene sul nickel Raney a circa 20bar e 60°C produce solfolano con una rendita fino al 65% per via dell'avvelenamento del catalizzatore causato da composti sulfurei.[11]
Alogenazione
Il 3-solfolene reagisce in soluzione acquosa col bromo, producendo 3,4-dibromotetroidrotiofene-1,1-diossido, che può essere deidroalogenato in tiofene-1,1-diossido tramite carbonato d'argento.[5]
Il tiofene-1,1-diossido, specie molto reattiva, può essere prodotta anche tramite la formazione di 3,4-bis(dimetilammino)tetraidrotiofene-1,1-diossido con successiva doppia quaternizzazione con ioduro di metile, ed eliminazione di Hofmann con idrossido d'argento.[10] Una sintesi meno complicata in due passaggi consiste nella doppia deidrobromurazione del 3,4-dibromotetraidrotiofene-1,1-diossido con idrossido di sodio in polvere in tetraidrofurano (THF)[12] o con potassio metallico disperso ultrasonicamente.[13]
Reazioni di Diels-Alder
Il 3-solfolene è principalmente usato come fonte di butadiene.[1][2] La produzione in situ e l'immediato consumo dell'1,3-butadiene evitano in larga parte il contatto col butadiene, che è un gas a temperatura ambiente. Un impatto, oltre che sui costi, è dato dal diossido di zolfo che può indurre reazioni collaterali in sostanze sensibili agli acidi.
La reazione di Diels-Alder tra 1,3-butadiene e dienofili a bassa reattività richiede solitamente temperature superiori a 100°C per tempo prolungato. Queste procedure sono altrimenti piuttosto pericolose: se è usato il puro butadiene, sono richieste delle strumentazioni speciali per funzionare a pressioni elevate. Usando il solfolene non è previsto nessun incremento di pressione per via del butadiene: appena liberato, il diene viene immediatamente consumato nella cicloaddizione, e l'equilibrio della reazione reversibile agisce come "valvola di sicurezza" interna.[14]
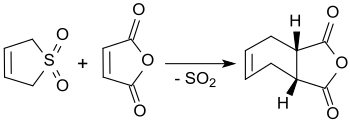
Il 3-solfolene reagisce con l'anidride maleica in xilene bollente producendo anidride cis-4-cicloesene-1,2-dicarbossilica, con rendite fino al 90%.[2]
Il 3-solfolene reagisce anche con i dienofili in configurazioni trans (come il dietil fumarato) a 110°C con eliminazione di SO2 producendo trans-4-cicloesene-1,2-dicarbossil dietil estere con rendite del 66–73% .[15]
Il 6,7-dibromo-1,4-epossi-1,4-diidronaftalene (6,7-dibromonaftalene-1,4-endossido, ottenibile tramite debromurazione dell'1,2,4,5-tetrabromobenzene con un equivalente di n-butillitio e una reazione di Diels-Alder in furano con una rendita del 70%[16]) reagisce col 3-solfolene in xilene bollente producendo un addotto triciclico. Questo precursore produce, dopo un trattamento con acido perclorico, un dibromo diidroantracene, che è deidrogenato in un ultimo passaggio con 2,3-dicloro-5,6-diciano-1,4-benzochinone (DDQ) in 2,3-dibromoantracene.[17]
L'1,3-butadiene reagisce col deidrobenzene (benzino, ottenuto tramite la decomposizione termica del benzenediazonio-2-carbossilato) in una reazione di Diels-Alder con una rendita del 9% di 1,4-diidronaftalene.[18]
2- e 3-solfolene come dienofili
In presenza si dieni molto reattivi (come l'1,3-difenilisobenzofurano), il solfolene si comporta come un dienofilo e forma i corrispettivi addotti di Diels-Alder.[19]
Nel 1938 Kurt Alder e colleghi scoprironogli addotti di Diels-Alder ottenuti dall'isomero 2-solfolene con 1,3-butadiene e 2-solfolene con ciclopentadiene.[20]
Altre cicloaddizioni
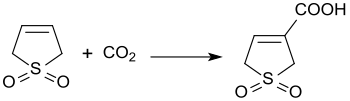
La reazione catalizzata da basi di 3-solfolene e diossido di carbonio a 3 bar di pressione produce acido 3-solfolene-3-carbossilico con rendita del 45%.[21]
Col diazometano, il 3-solfolene forma un cicloaddotto 1,3-dipolare:[22]
Polimerizzazione
Nel 1935, H. Staudinger e colleghi scoprirono che la reazione tra butadiene e anidride solforosa a temperatura ambiente produce anche un secondo prodotto oltre al 3-solfolene. Questo secondo prodotto è un polimero solido amorfo. Tramite polimerizzazione a radicale libero del 3-solfolene in dietil etere contenente perossidi, fu ottenuto fino al 50% di poli-solfolene insolubile ad alta massa molecolare. Il polimero resiste alla degradazione di acido solforico e nitrico.[6]
In seguenti studi, la polimerizzazione del 3-solfolene fu iniziata oltre i 100°C col radicale iniziatore azobis(isobutironitrile) (AIBN).[23] Il 3-solfolene non copolimerizza con composti vinili. Al contrario, il 2-solfolene non omopolimerizza, ma forma copolimeri con composti vinili, come l'acrilonitrile e l'acetato di vinile.
Il Solfolene come solvente riciclabile
La reversibilità della conversione del 3-solfolene in 1,3-butadiene e diossido di zolfo ne suggerisce un possibile uso come solvente dipolare aprotico riciclabile, sostituendo il dimetilsolfossido (DMSO), frequentemente usato ma difficile da separare e riciclare.[24] La reazione tra azide di benzile e cianuro di acido toluensolfonico, avente come prodotto l'1-benzil-5-(4-toluensolfonil)tetrazolo, fu studiata come modello. La formazione del tetrazolo può anche essere svolta in un unico contenitore, senza isolare l'azide di benzile, portando a una rendita del 72%.
Dopo la reazione, il 3-solfolene usato come solvente può essere decomposto a 135°C rilasciando come gas il butadiene (T e = -4.4°C) e il diossido di zolfo (Te = -10.4°C) raccogliendoli in una trappola a freddo caricata con diossido di zolfo in eccesso a -76°C. Dopo aver aggiunto dell'idrochinone per inibire la polimerizzazione, si può riottenere il solfolene riscaldando a temperatura ambiente. È dubbio che il solfolene, con una fase liquida utile da 64° a un massimo di 100°C , possa sostituire il DMSO (facile da maneggiare, a basso costo e compatibile con l'ambiente) negli usi indistriali.
Remove ads
Usi
Oltre che nei molteplici usi sintetici (vedi sopra), il solfolene trova impiego come additivo nella fluorurazione elettrochimica. Esso può incrementare la rendita di fluoruro di perfluoroottanosolfonile circa del 70%.[25] In acido fluoridrico anidro, il solfolene è "altamente solubile e aumenta la conduttività della soluzione di elettroliti".[25] In questa applicazione, il solfolene subisce un'apertura dell'anello e forma fluoruro di perfluorobutansolfonile.
Note
Bibliografia
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads