トップQs
タイムライン
チャット
視点
中心体
ウィキペディアから
Remove ads
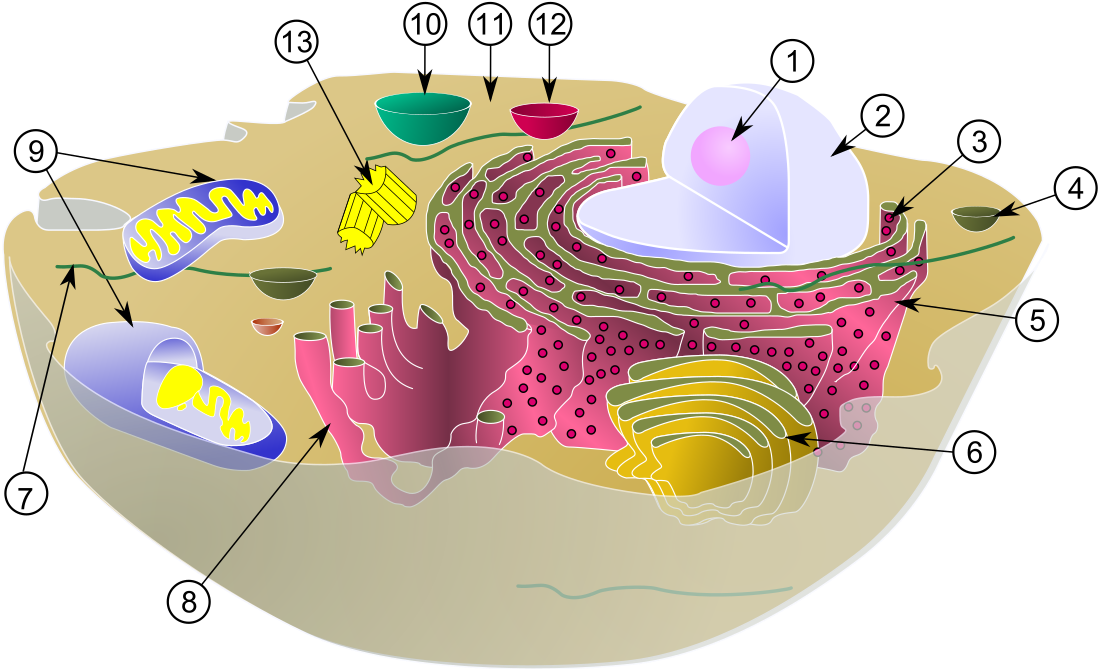
中心体(ちゅうしんたい、英: centrosome)は、動物細胞における主要な微小管形成中心(MTOC)、そして細胞周期の進行の調節因子として機能する細胞小器官である。中心体は真核生物の後生動物系統のみで進化したものであると考えられている[1]。真菌や植物には中心体は存在せず、そのため微小管の組織化には他の構造体が用いられている[2][3]。中心体は動物細胞において有糸分裂の効率的進行に重要な役割を果たしているが、特定種のハエや扁形動物では必要不可欠なものではない[4][5][6]。
中心体は互いに直交するよう配置された2つの中心小体から構成され、中心体マトリックス(中心体周辺物質、PCM)と呼ばれる濃密で高度に構造化されたタンパク質の塊に取り囲まれている[7]。PCMには微小管の核形成や係留を担うタンパク質(γ-チューブリン、ペリセントリン、ニネインなど)が含まれている[8]。一般的に、各中心小体は9個の三連微小管が車輪型(カートホイール)に組み立てられた構造をしており、セントリン、Cenexin、テクチンが含まれている[9]。多くの細胞種では、細胞が分化した際には中心体は繊毛へ転換される。しかし細胞分裂が開始されると、繊毛は再び中心体へ変換される[10]。
Remove ads
歴史
中心体は、1875年にヴァルター・フレミングによって[11]、そして1876年にEdouard Van Benedenによって[12]それぞれ独立に発見された[13]。その後、1888年にテオドール・ボヴェリによって"centrosome"という語が導入された[14]。
機能
→詳細は「中心体周期」を参照

有糸分裂の前期の段階では、中心体は核膜と結合している。有糸分裂の過程で核膜は解体され、中心体を核として形成された微小管が染色体と相互作用して紡錘体を形成する。
対を形成している2つの中心小体のうちの古い方である母中心小体は、繊毛や鞭毛の形成においても中心的役割を果たしている[9]。
中心体は各細胞周期に一度だけ複製され、娘細胞は中心体を1つずつ受け継ぐ。中心体の複製は細胞周期のS期の間に行われる。有糸分裂の前期の段階で、中心体は細胞の両極に移動する。その後、2つの中心体の間に紡錘体が形成され、細胞分裂に伴って娘細胞は中心体を1つずつ受け取ることとなる。細胞内の中心体数の異常はがんと関連している。中心体の複製とDNA複製は、その過程が半保存的である、そしてCDK2が調節因子として作用する、という2つの点で類似している[15]。しかしながら、中心体の複製はDNA複製のように鋳型を読み取って組み立てが行われる過程ではなく、本質的に異なる過程である。母中心小体は娘中心小体の組み立てに必要な物質の蓄積を補助するだけである[16]。

中心体は、有糸分裂の進行に重要であるものの必要不可欠であるわけではない。中心小体へレーザー照射を行って破壊した場合でも有糸分裂は正常に進行し、形態的に正常な紡錘体が形成される。さらに、ショウジョウバエは中心小体の複製に必要な遺伝子の変異によって中心体や中心小体が存在しない場合でも、ほぼ正常な発生が行われる[17]。しかしながら、こうしたハエは繊毛や鞭毛が存在しないために出生直後に致死となる[17]。中心小体が存在しない場合、紡錘体微小管はモータータンパク質によって組織化され、双極型の紡錘体の形成が可能となる。多くの細胞は中心小体が存在しない場合でも間期は完全に進行する[9]。
このように中心小体や中心体は紡錘体形成に必要不可欠であるわけではないものの、中心体を欠く細胞は星状体微小管を欠いており、そのため細胞分裂時の細胞形状の変化に際して長軸に直交するように紡錘体を再配置することができず、細胞質分裂が失敗することが多い。このように中心体の機能は細胞分裂の効率を大きく高めており、その正確性を保証していると考えられている[9]。
Remove ads
がん細胞における中心体の変化
要約
視点
テオドール・ボヴェリは1914年に、がん細胞にみられる中心体の異常について記載した。その後、中心体の異常は多くの種類のヒト腫瘍で確認された[19]。がん細胞における中心体の異常は構造異常と数的異常の2つに分類されるが、腫瘍内で双方が同時に観察される場合もある。
構造異常
多くの場合、構造異常は中心体の構成要素の無制御な発現、または構成要素に不適切な翻訳後修飾(リン酸化など)が行われることが原因となっている。こうした変化によって中心体のサイズの変化(過剰なPCMの存在によって巨大化していることが多い)が生じる可能性がある。さらに、中心体タンパク質は凝集体を形成する傾向があるため、centrosome-related body(CRB)と呼ばれる構造体が異所的に形成されていることが観察されることが多い[20]。こうした大きな中心体やCRBは腫瘍内で観察されるほか[21]、C-Nap1やNlpなど特定の中心体タンパク質を過剰発現することで培養細胞でも誘導することができる[20][22]。これらの構造体の外観は互いに非常に類似しているが、より詳細な研究ではそのタンパク質組成によって非常に異なる性質を有している可能性が明らかにされている。一例として、これらにはγ-TuRC(γ-チューブリン環複合体)の取り込み能力に大きな差がみられる場合があり、そのため微小管核形成能力も異なり[21]、腫瘍細胞の形状、極性、運動性に異なる影響を及ぼす場合がある。
数的異常
不適切な数の中心体の存在は、ゲノム不安定性の出現や組織分化の喪失と関連していることが非常に多い[21][23]。最も一般的に行われている蛍光顕微鏡を用いた検査では互いに非常に近接して存在する中心小体を見分けるだけの分解能は得られないため、中心体の計数法は必ずしも正確性が高いわけではない。しかしながら、過剰な中心体の存在がヒトの腫瘍に広くみられる現象であることは明らかである。がん抑制因子であるp53の喪失は、BRCA1やBRCA2などヒトのがんと関連したタンパク質の調節異常をもたらすだけでなく、余剰な中心体を生み出すことが観察されている[19][24]。中心体の特異的な再複製、細胞分裂時の細胞質分裂の失敗(染色体数の増加も生じる)、細胞の融合(特定のウイルスの感染時など)、中心体のde novo形成といった、大きく異なる機構によって余剰な中心体が生み出される場合がある。これらの機構がin vivoでどれだけ広く生じているのかについて十分な情報は得られていないが、細胞分裂時の失敗による中心体数の増加はより高頻度で生じている可能性がある。細胞周期の調節不全、DNAやクロマチン代謝の欠陥、紡錘体チェックポイントの欠陥など、細胞分裂の失敗をもたらす一次的要因となる欠陥は多く存在しており、その二次的影響として多倍体や中心体の増加が生じている可能性があるためである[25][26]。
進化
中心体と中心小体に関する進化的歴史に関しては、セントリンのような、中心体を特徴づけるいくつかのシグネチャー遺伝子の追跡が行われている[1]。セントリンはカルシウムシグナリングに関与し、中心小体の複製に必要である[27]。セントリンには2つの主要なサブファミリーが存在し、そのどちらも早期に分岐した真核生物であるランブル鞭毛虫Giardia intestinalisに存在する。そのため、セントリンは真核生物の共通祖先に存在していたと考えられる。反対に、古細菌や細菌には明確なホモログは存在せず、真核生物を特徴づけるシグネチャー遺伝子の一部となっている。中心体や中心小体の進化に関する研究は行われているものの[1][28]、PCMの進化に関する研究は発表されていない。
モデル生物であるキイロショウジョウバエDrosophila melanogaster と線虫Caenorhabditis elegansでは、中心体の一部に関して大きな分岐が生じている。一例として、どちらの種も中心小体の複製と関連するセントリンサブファミリーの1つを喪失している。中心体を喪失したキイロショウジョウバエは形態学的に正常な発生を行うが、感覚ニューロンが繊毛を欠いているため出生直後に致死となる[17]。このように一部のハエは中心体に依存しない、機能的に冗長的な装置を進化させている。
Remove ads
ヌクレオチドの結合
2006年に発表された研究では、貝類の一種Spisula solidissimaの卵母細胞から単離された中心体にRNAが含まれていることが示された。このRNAの配列は細胞内の他の部位ではほとんど、もしくは全く検出されず、既存のゲノムデーターベースにもみられないものであった。同定されたRNA配列の1つにはRNA依存性RNAポリメラーゼと推定される配列が含まれており、中心体内にRNAを基盤とした独自のゲノムが存在するという仮説が提唱された[29]。その後の研究では、中心体にはDNAを基盤としたゲノムは存在しないことが示された。またRNA分子が中心体と結合していることは確認されたものの、その配列は核内に存在するものであった。さらに、中心体はレーザー照射によって正常細胞から除去した後にde novoに形成される場合があり[28]、半自律的な細胞小器官ではない。
出典
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads