トップQs
タイムライン
チャット
視点
微小管
ウィキペディアから
Remove ads
微小管(びしょうかん、英: microtubule、マイクロチューブル)は、細胞骨格の一部を構成し、真核細胞に構造と形状をもたらしているチューブリン重合体である。微小管の長さは50 μmにもなり、管構造の外径は23–27 nm[2]、内径は11–15 nmである[3]。微小管内では、2つの球状タンパク質α、β-チューブリンからなるヘテロ二量体が直列に並んでプロトフィラメント(protofilament)を形成しており、プロトフィラメントどうしの横方向の相互作用によって中空の管構造が形成されている[4]。微小管の最も一般的な形態は、13個のプロトフィラメントからなる管状構造である。

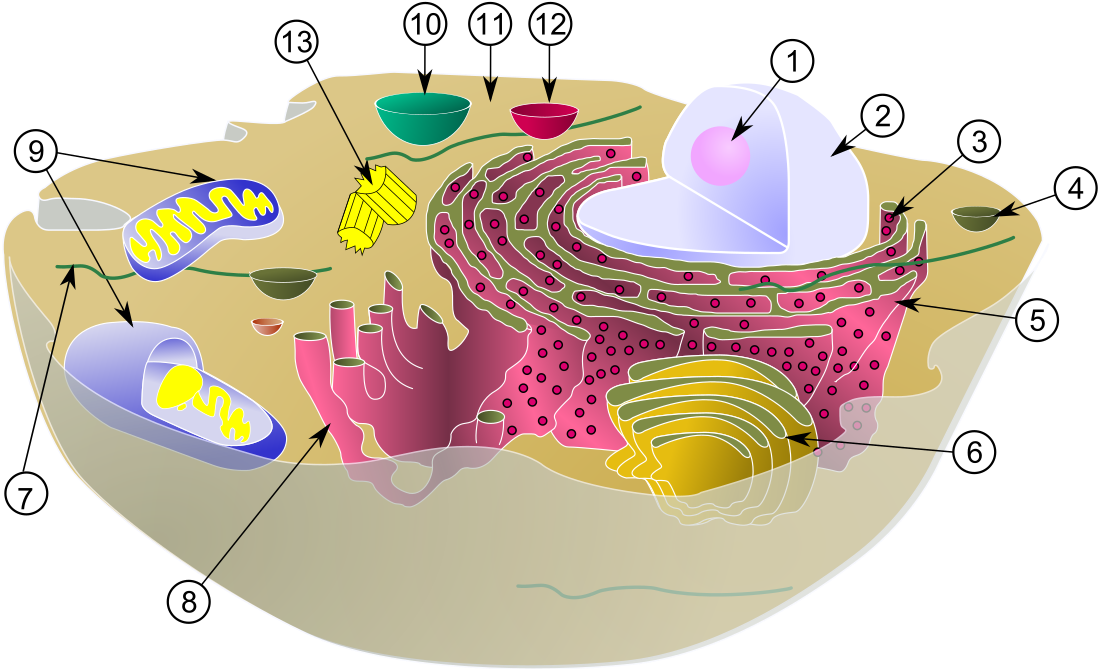
微小管は細胞の構造の維持に関与しており、マイクロフィラメントや中間径フィラメントとともに細胞骨格を形成しているほか、繊毛や鞭毛の内部構造を構成している。また細胞内輸送のための基盤となり、分泌小胞、細胞小器官、細胞内高分子複合体の移動など、さまざまな細胞過程に関与している[5]。細胞分裂(有糸分裂と減数分裂)にも関与しており、複製された染色体を引き離すために用いられる紡錘体の主要な構成要素である。
微小管は、多くの動物細胞の中心にみられる中心体や、繊毛や鞭毛の基底小体、大部分の真菌にみられる紡錘極体などの微小管形成中心(MTOC)において核形成と組織化が行われる。
微小管に結合するタンパク質には、ダイニンやキネシンなどのモータータンパク質、カタニンのような微小管切断タンパク質、その他微小管のダイナミクスの調節に重要なタンパク質など多くの種類が存在する[6]。
Remove ads
歴史
細胞運動のようにチューブリンや微小管を介して行われている過程は、レーウェンフック(1677)ら初期の顕微鏡学者によって観察されていた。約200年後、光学顕微鏡の改良によって繊毛や鞭毛が繊維から構成されていることが観察され、そして20世紀に入って電子顕微鏡や生化学的研究によって内部の繊維構造が確認された[7]。
構造
要約
視点


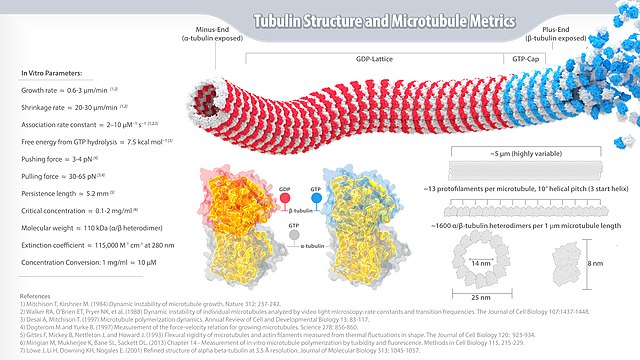
真核生物の微小管は、α、β-チューブリン二量体の重合によって形成される、長い中空の円筒である[9]。円筒の内部空間は内腔(管腔、lumen)と呼ばれる。α、β-チューブリンはアミノ酸レベルで約50%の同一性を有し、どちらも分子量はおよそ50kである[10][11]。
微小管内のα/β-チューブリン二量体は同じ向きに直列に並んでプロトフィラメントを形成しており、プロトフィラメント間の相互作用によって管構造が形成されている。微小管は末端にα/β-チューブリン二量体が付加されることでさらに伸長する。微小管は一般的には13個のプロトフィラメントから形成されるが、それよりも多いもしくは少ない数のプロトフィラメントからなる微小管も、さまざまな生物種[12]やin vitro[13]で観察されている。
微小管には明確な極性が存在し、この性質は微小管の生物学的機能に重要である。重合したチューブリンは、1つの二量体のβサブユニットは隣の二量体のαサブユニットと接触している。そのため、プロトフィラメントの一方の端ではαサブユニットが露出しており、もう一方の端ではβサブユニットが露出している。これらの末端は、それぞれ(−)端、(+)端と呼ばれている。微小管内のプロトフィラメントは全て同じ極性で並んで束を形成しているため、微小管にもβサブユニットのみが露出している(+)端と、αサブユニットのみが露出している(−)端が存在する。微小管の伸長は(+)端と(−)端の双方で生じるが、(+)端の方が大幅に速く伸長する[14]。
また、プロトフィラメントどうしの横方向の結合によって擬らせん構造が生み出され、らせん1ターンには13個のチューブリン二量体が含まれている。最も一般的な"13-3"構造では、らせん1ターンでチューブリン単量体3個分だけ進む構造となっている。 11-3、12-3、14-3、15-4、16-4など他の代替的構造も検出されるが、その頻度ははるかに低い[15]。また微小管は、有孔虫などの原生生物で観察されるらせん形フィラメントのように他の形態へ変形することもある[16]。微小管内のプロトフィラメント間でみられる横方向のサブユニット間相互作用には、A-type lattice、B-type latticeと呼ばれる2種類が存在する。A-type latticeでは、プロトフィラメントの横方向の結合はα-チューブリンとβ-チューブリンの間で行われている(すなわち、1つのプロトフィラメントのα-チューブリンは隣接するプロトフィラメントのβ-チューブリンと相互作用している)。B-type latticeでは1つのプロトフィラメントのα、βチューブリンは隣接するプロトフィラメントのα、βチューブリンとそれぞれ相互作用している。微小管内の主要な配置はB-type latticeであることが実験的に示されているが、大部分の微小管にはα-β間相互作用が行われている継ぎ目(seam)が存在している[17]。
細菌のProsthecobacter属の一部の種にも微小管が存在する。こうした細菌微小管の構造は、BtubA(bacterial tubulin A)とBtubB(bacterial tubulin B)のヘテロ二量体から組み立てられる中空の管構造であるという点で真核生物のものと類似している。BtubAとBtubBのどちらもα、β-チューブリンと共通した特徴を有するが、真核生物のチューブリンとは異なりフォールディングにシャペロンを必要としない[18]。真核生物の微小管は13個のプロトフィラメントから構成されるのとは対照的に、細菌微小管はわずか5個のプロトフィラメントから構成される[19]。
また、グラム陽性菌であるバチルス・チューリンゲンシスBacillus thuringiensisでは、アクチン様タンパク質によってnanotubuleと呼ばれる微小管様の構造体が形成されることが発見されている。この構造はプラスミドの分離に関与している[20]。
Remove ads
細胞内の組織化

微小管は、細胞質の構造的ネットワークである細胞骨格の一部を構成している。微小管骨格は、機械的支持、細胞質の組織化、輸送、運動性や染色体分離などの役割を果たしている。発生中の神経細胞の微小管は神経細管とも呼ばれ[21]、細胞骨格の他の構成要素であるアクチンフィラメントのダイナミクスを調節している[22]。微小管は伸長と短縮を行うことで力を生み出すことができ、またキネシンやダイニンなどのモータータンパク質はアダプタータンパク質を介して細胞小器官や他の細胞構成要素(mRNAなど)を微小管に沿って輸送する[23][24]。こうした役割のため、微小管は細胞内構成要素や積み荷の組織化や移動に重要なものとなっている。
細胞内における微小管の組織化は細胞種特異的である。上皮細胞では、微小管の(−)端は細胞間接触部位の近傍に係留され、頂端-基底軸に沿って組織化されている。核形成の後に(−)端は遊離し、その後ニネインやPLEKHA7などの因子によって細胞周縁部に再係留される[25]。こうした微小管配置によって、タンパク質や小胞、細胞小器官の頂端-基底軸に沿った輸送が促進される。線維芽細胞やその他の間葉系細胞種では微小管は中心体に係留され、(+)端は細胞の周縁部に向かって放射状に伸びている。これらの細胞では、微小管は遊走に重要な役割を果たしている。
微小管の重合
核形成
→詳細は「微小管核形成」を参照
核形成は、チューブリンから微小管を形成する過程を開始するイベントである。一般的に、微小管形成中心(MTOC)と呼ばれる細胞小器官によって微小管の核形成と組織化が行われる。MTOCには、微小管自体を構成するα、β-チューブリンとは異なる、γ-チューブリンと呼ばれる種類のチューブリンが含まれている。γ-チューブリンは他のいくつかの結合タンパク質とともにγ-TuRC(γ-チューブリン環複合体)と呼ばれる構造を形成する。この複合体はα/β-チューブリンが重合を開始するための鋳型として、そしてMTOCから(+)端方向への微小管の成長が継続している間、(−)端のキャップとして機能する[26]。
大部分の細胞種において、主なMTOCとなっているのは中心体である。しかしながら、微小管は他の部位でも同様に核形成が行われる場合がある。一例として、繊毛や鞭毛の基部には基底小体と呼ばれるMTOCが存在している。さらに、ゴルジ体も微小管核形成の重要な場として機能していることが示唆されている[27]。中心体での核形成は全方向に対称的に生じるため、微小管ネットワークの非対称性はゴルジ体と関連した微小管核形成によって確立されている可能性がある。さらに、紡錘体微小管を基部とした微小管形成も行われ、この過程に重要な因子としてaugminと呼ばれるタンパク質複合体が同定されている。Augminはγ-TuRCと相互作用して紡錘体近傍の微小管密度を高めることが示されている[28]。
植物細胞など一部の細胞種には、明確なMTOCが存在しない。植物では核膜がMTOCとして機能するほか[29]、既存の微小管からの分枝によって微小管が形成される[30]。
重合
核形成の後、重合体の伸長にはチューブリンの付加が必要である。チューブリンの付加と脱落は溶液中のα/β-チューブリンの濃度と臨界濃度との関係に依存している。臨界濃度とは、微小管の末端での重合と脱重合の総和が等しくなる、定常状態のチューブリン二量体濃度である。二量体濃度が臨界濃度よりも高い場合には、微小管は重合して伸長する。反対に臨界濃度よりも低い場合には、微小管の長さは短くなる[31]。
Remove ads
微小管のダイナミクス
動的不安定性
動的不安定性とは、微小管の末端において組み立てと解体の双方ともが生じている状態を指す。この領域の微小管は、伸長と短縮を動的に切り替えることができる[32]。チューブリン二量体は2分子のGTPを結合しており、そのうちの1つは重合後に加水分解が生じる[9]。α-チューブリンに結合したGTPは安定であり、この結合状態で構造的機能を果たしている。一方、β-チューブリンに結合したGTPは重合後にGDPへ加水分解される可能性がある。GDP結合型チューブリンの性質はGTP結合型チューブリンとは異なっており、脱重合を起こしやすい[33]。そのため、微小管の末端に位置するGDP結合型チューブリンは脱落が起こりやすいが、微小管の内部に位置するGDP結合型チューブリンが重合体から自発的に飛び出すことはない。微小管の末端に付加されるチューブリンはGTP結合状態であるため、微小管を脱重合から保護するキャップとして存在していることが提唱されている。新たなチューブリンの付加が低下しGTPの加水分解が微小管の末端まで進行すると、急速な脱重合と微小管の短縮が開始される。この伸長から短縮への切り替えはカタストロフ(catastrophe)と呼ばれる。GTP結合型チューブリンの末端への付加が再開されると、それらは微小管を短縮から保護する新たなキャップとして機能する。この過程はレスキュー(rescue)と呼ばれている[34]。
"Search and capture"モデル"
1986年にマーク・カーシュナーとTim Mitchisonは、微小管の(+)端における伸長と短縮の動的性質を利用した細胞内の三次元空間の探索(search)が行われていると提唱した。キネトコアや極性部位に到達した(+)端は捕捉(capture)され、伸長や短縮が起こらなくなる。通常の動的な微小管の半減期は5–10分であるが、こうして捕捉された微小管は数時間にわたって維持される場合がある。このモデルは"search and capture"モデルとして広く知られている[35]。実際に、その後の研究によってこのモデルはおおむね検証されており、キネトコアではさまざまな複合体が微小管の(+)端を捕捉することが示されている[36]。さらに、間期の微小管の(+)端にキャップを形成して安定化する活性の存在も記載されている[37]。この活性はフォルミン[38]、APC、そして微小管の(+)端を追跡するタンパク質EB1[39]によって媒介されている。
Remove ads
微小管ダイナミクスの調節
要約
視点
翻訳後修飾

大部分の微小管の半減期は5–10分であるが、特定の微小管は数時間にわたって安定である[37]。こうした安定化された微小管のチューブリンサブユニットには、微小管結合酵素による翻訳後修飾が蓄積している[40][41]。微小管が脱重合した際には大部分の修飾は可溶性酵素によって迅速に元の状態へ戻される。ほとんどの修飾反応は緩やかに進行する一方でその逆反応は急速に生じるため、修飾されたチューブリンは長寿命の安定な微小管でのみ検出される。こうした修飾の大部分はα-チューブリンのC末端領域に施される。負に帯電したグルタミン酸残基に富むこの領域は、比較的構造をとらないテール領域として微小管から伸び、モータータンパク質と接触している。そのため、チューブリンの修飾は微小管とモーターとの相互作用を調節していると考えられている。こうした修飾が施された安定な微小管は一般的には間期の細胞で細胞極性部位へ向かって伸びているものであり、極性領域へ小胞を送達するための専用のルートを形成している。修飾には次のようなものがある。
- 脱チロシン化: α-チューブリンのC末端のチロシンの除去。この反応によってグルタミン酸が新たなC末端として露出する。この修飾が蓄積した微小管はGlu-microtubuleと呼ばれることが多い。チューブリンに対して作用するカルボキシペプチダーゼは未同定であるが、遊離した脱チロシン化チューブリンにチロシンを付加するチューブリンチロシンリガーゼ(TTL)は既知である[42]。
- delta 2(Δ2、δ2): α-チューブリンのC末端の2残基の除去[43]。脱チロシン化とは異なり、この反応は不可逆的であると考えられており、神経細胞でのみ記載されている。
- アセチル化: α-チューブリンのリジン40番残基へのアセチル基の付加。この修飾は微小管の内部からのみアクセス可能なリジン残基に対して行われており、酵素がこのリジン残基へどのようにアクセスしているのかは不明確である。アセチルトランスフェラーゼの性質に関しては議論があるが、哺乳類の主な酵素はATAT1であることが示されている[44]。逆反応はHDAC6によって触媒されることが知られている[45]。アセチル化が微小管の構造や機能に及ぼす影響は未解明である[46]。
- ポリグルタミル化: α-チューブリンのC末端近傍の5つのグルタミン酸残基のいずれかのγ-カルボキシル基へ、ポリグルタミン酸鎖(一般的には4–6残基の長さ[47])を付加する。分岐の開始となるグルタミン酸を付加する酵素(TTLL4、5、7)とポリグルタミン酸の伸長を担う酵素(TTLL6、11、13)が存在する[41]。
- ポリグリシル化: α-チューブリンのC末端近傍の5つのグルタミン酸残基のいずれかのγ-カルボキシル基へ、ポリグリシン鎖(一般的には2–10残基の長さ)を付加する。TTLL3、TTLL8は分岐の開始となるグリシンを付加し、TTLL10はポリグリシン鎖を伸長する[41]。
チューブリンに結合する薬剤とその影響
幅広い薬剤がチューブリンに結合し、微小管の組み立て過程に変化を及ぼす。こうした薬剤は細胞内のチューブリン濃度よりもはるかに低い濃度で影響を及ぼす場合がある。微小管ダイナミクスへの干渉によって、細胞周期の停止という影響が生じたり、プログラム細胞死(アポトーシス)が引き起こされたりする場合がある。しかしながら、微小管ダイナミクスへの干渉だけでは有糸分裂の遮断には不十分であることを示唆するデータも得られている[48]。こうした研究では、ダイナミクスの抑制は有糸分裂の遮断に必要な濃度よりも低い段階で生じることが示されている。チューブリンの変異もしくは薬剤処理による微小管ダイナミクスの抑制は、細胞遊走を阻害することが示されている[49]。微小管を安定化する薬剤と不安定化する薬剤のどちらも微小管のダイナミクスを抑制する作用を示す。
微小管のダイナミクスに変化を及ぼす薬剤には次のようなものである。
- タキサン系に分類される抗がん剤(パクリタキセルやドセタキセル)は、微小管内のGDP結合型チューブリンを安定化することで動的不安定性を防ぐ。そのため、GTPの加水分解が微小管の末端へ到達した場合でも脱重合は起こらず、微小管は短縮しない。タキサン系薬剤は単独または白金製剤(カルボプラチン)やゲムシタビンとの併用によって、乳がんや婦人科腫瘍、扁平上皮がん(頭頸部がん、一部の肺がん)などに用いられている。
- エポチロン(イキサベピロンなど)はタキサンと同様に作用する。
- ビノレルビン、ノコダゾール、ビンクリスチン、コルヒチンは反対の影響を及ぼし、チューブリンの微小管への重合を阻害する。
- エリブリンは微小管の(+)端に結合する。エリブリンは、がん細胞において長期的かつ不可逆的な有糸分裂の遮断後にアポトーシスを誘発することで抗がん作用を発揮する。
β3-チューブリンの発現は、薬剤による微小管ダイナミクスの抑制への応答に変化を及ぼすことが報告されている。一般的に、薬剤が毒性を示す濃度よりも低い濃度でダイナミクスは抑制され、また細胞遊走も阻害される。しかしながら、β3-チューブリンが微小管に組み込まれることで、ダイナミクスを抑制し細胞遊走を阻害するのに必要な濃度は上昇する。そのため、β3-チューブリンを発現している腫瘍は微小管を標的とした薬剤による細胞傷害作用に対して抵抗性を示すだけでなく、腫瘍転移抑制能に対しても抵抗性が生じる[50]。さらにβ3-チューブリンの発現は、これらの薬剤の他の重要な側面となっている血管新生阻害作用に対しても対抗する作用をもたらす[51]。
微小化重合体は、周囲の環境のさまざまな影響に対して極めて敏感である。微小管は非常の低濃度の遊離カルシウムによって不安定化され、このことは初期のin vitroでの重合体の研究の妨げとなっていた[9]。また、低温も微小管の急速な脱重合を引き起こす。重水は微小管重合体の安定性を促進する[52]。
Remove ads
微小管と相互作用するタンパク質
要約
視点
微小管結合タンパク質
→詳細は「微小管結合タンパク質」を参照
微小管結合タンパク質(MAP)は、in vivoでの微小管ダイナミクスの調節に重要な役割を果たしている。微小管の重合、脱重合、カタストロフの速度は、どのようなMAPが存在しているか依存して変動する。当初、脳組織から同定されていたMAPは分子量に基づいて2つのグループへ分類された。1つ目の分類は55–62 kDaよりも小さいサイズのMAPからなり、これらはタウタンパク質と呼ばれている。In vitroでは、タウタンパク質は微小管に直接結合し、核生成を促進し、脱重合を阻害すること、そして微小管が平行に並んだ列の形成を誘導することが示されている[53]。さらに、タウタンパク質は軸索中の微小管を安定化することが示されており、アルツハイマー病との関連も示唆されている[54]。2つ目の分類には200–1000 kDaのMAPが含まれ、MAP-1、MAP-2、MAP-3、MAP-4の4種類が知られている。MAP-1タンパク質はA、B、Cの3つのタンパク質から構成される。MAP-1Cタンパク質は小胞の逆行性輸送に重要な役割を果たしており、細胞質ダイニンとしても知られている。MAP-2タンパク質は神経細胞の樹状突起や細胞体に位置し、そこで他の細胞骨格フィラメントと結合している。MAP-4タンパク質は大部分の細胞に存在し、微小管を安定化している。微小管構造を安定化するMAP以外にも、微小管の切断や脱重合の誘導によって不安定化をもたらすMAPも存在する。カタニン、スパスチン、fidgetinと呼ばれる3種類のタンパク質は、不安定化作用によって微小管の数や長さを調節していることが観察されている。さらに、CRACDLも微小管に局在することが予測されている[55]。
MAPは軸索や樹状突起の細胞骨格の形態の差異を決定する因子であり、樹状突起では微小管は互いにより離れて存在している[56]。
微小管プラス端集積因子
→詳細は「微小管プラス端集積因子」を参照
微小管プラス端集積因子(+TIP)は微小管の(+)端に結合するMAPの総称であり、微小管ダイナミクスの調節に重要な役割を果たしている。一例として、+TIPは有糸分裂時の染色体と微小管との相互作用に関与していることが観察されている。+TIPとして最初に同定されたMAPはCLIP170であり、微小管脱重合のレスキューに関与していることが示されている。+TIPはEBタンパク質やp150gluedなど多くの種類が知られている[57]。
モータータンパク質


→「モータータンパク質」も参照
微小管は、小胞輸送や細胞分裂など重要な細胞機能に関与しているモータータンパク質の基質としてはたらく。モータータンパク質は他のMAPと異なり、ATPの加水分解のエネルギーを利用することで基質に沿ってタンパク質を移動する機械的仕事を行っている。微小管と相互作用する主要なモータータンパク質としては、通常(+)端へ向かって移動するキネシンや、(−)端へ向かって移動するダイニンがある。
- ダイニンは2つの同一な重鎖と、そこに結合するいくつかのポリペプチド鎖から構成される[58]。ダイニンを介した輸送は微小管の(+)端から(−)端へ向かって行われる。ATPの加水分解はヘッドドメインで行われ、その構造はAAA+(ATPase associated with various cellular activities)ファミリータンパク質との類似性がみられる。このドメインで生じるATPの加水分解は、微小管結合ドメインの微小管上の移動と共役している。ダイニンはダイナクチンなどいくつかのタンパク質を介して積み荷を結合し、輸送を行う[59]。
- キネシンはダイニンと類似した構造を有する。キネシンは小胞、細胞小器官、タンパク質複合体、mRNAなど細胞内のさまざまな積み荷を微小管の(+)端へ向かって輸送する[60]。
Remove ads
有糸分裂
要約
視点
中心体

中心体は有糸分裂中の細胞の主要なMTOCである。各中心体は、互いに直交する向きに配置された、中心小体と呼ばれる2つの円筒から構成される。中心小体には9個のmain microtubuleが存在し、そのそれぞれに2つのpartial microtubuleが結合している。中心小体の円筒構造の長さは約400 nm、外周は約200 nmである[61]。
中心体は有糸分裂に重要であり、この過程に関与する微小管の大部分は中心体から発したものである。各微小管の(−)端は中心体に位置し、(+)端は全方向へ放射される。中心小体は有糸分裂時の微小管の極性の維持にも重要である[62]。
大部分の細胞では、細胞周期のほとんどの期間には中心体は1つしか存在しない。しかしながら、有糸分裂前に中心体は複製され、2つの中心体が存在する状態となる[63]。中心体から放射された微小管の一部は姉妹染色体から離れた方向へ直接伸長する。こうした微小管は星状体微小管と呼ばれる。星状体微小管の助けのもと、中心体は互いに離れるように細胞の両極へ移動する。両極に到達すると、有糸分裂に必要な極微小管や動原体微小管など、他の種類の微小管の形成が開始される[64]。微小管が正しい位置に形成された場合には、中心体自体は有糸分裂の進行には必要ではないことが示されている[65]。
微小管の分類

星状体微小管(astral microtubule)は、有糸分裂時とその前後にのみ存在する。これらの微小管は中心体から発するが、染色体やキネトコア、他の中心体から発した微小管とは相互作用しない[66]。その代わり、これらは細胞膜へ向かって放射している。そこで特異的モータータンパク質と相互作用し、モータータンパク質は微小管、そして中心体全体を細胞膜へ向かって引っ張る力を生み出す。上述したように、この微小管は中心体が細胞内で互いに離れた配置となるよう補助している。しかしながら、これらの微小管は紡錘体自体とは直接的な相互作用は行っていない。こうした星状体微小管が存在しない場合でも紡錘体は形成されるが、その細胞内での配向は常に正しいものとなるわけではなく、そのため有糸分裂の効率的進行が損なわれることが実験的に示されている[67]。星状体微小管の他の重要な機能としては、細胞質分裂の補助がある。星状体微小管は細胞膜に位置するモータータンパク質と相互作用し、紡錘体や細胞全体が引き離される。
極微小管(interpolar/polar microtubule)もまた、有糸分裂時に中心体から放射される微小管の1つである。星状体微小管とは異なり、これらの微小管は紡錘体へ向かって放射される。極微小管は有糸分裂時に最も豊富に存在し、また最も動的な微小管である。紡錘体内の微小管の約95%が極微小管としての特性を有する。さらに、こうした微小管の半減期は極めて短く、1分未満である[68]。キネトコアへの接着を行わない極微小管は、側面でのキネトコアとの相互作用を介して染色体の集合を補助する[69]。
動原体微小管(キネトコア微小管、kinetochore microtubule、K fiber)は、紡錘体内でキネトコアとの直接的な連結を形成する。各繊維は20–40本の平行な微小管から構成され、一方の端は中心体、そしてもう一方の端は各染色体の中心に位置するキネトコアへ接着され、強力な管構造を形成する。染色体対は双方の中心体と連結されるため、これらの微小管によって染色体は紡錘体中心部に係留されることとなる。キネトコア微小管の半減期は極微小管よりもはるかに長く、4–8分である[70]。有糸分裂の終盤にはキネトコア微小管の脱重合が開始され、微小管は短縮する。細胞質分裂の前に微小管が短縮されるにつれて、染色体対は引き離される。キネトコア微小管は他の微小管と同様に中心体で形成された(−)端から発すると考えられていたが、新たな研究では異なる機構の存在が指摘されている。この新たな機構では、キネトコア微小管はまずキネトコアによって(+)端が安定化され、そこから成長するとされる。(−)端は既存の極微小管へ連結され、最終的に中心体へ連結される[71]。
紡錘体中の微小管核
紡錘体を形成している微小管の大部分は、中心体から発したものである。当初はこうした微小管の全てがsearch and captureモデルによって中心体から発したものであると考えられていたが、新たな研究では有糸分裂時の微小管核形成には他の機構も存在することが示されている。こうした新たな核形成機構の中で重要性が高いのがRan-GTP経路である。有糸分裂時にRan-GTPはクロマチンに結合し、染色体近傍で局所的な微小管核形成を可能にする勾配を形成している。さらに、 augmin/HAUS複合体を介した経路も紡錘体内での微小管核形成機構として機能している[71]。
Remove ads
機能
要約
視点
細胞遊走
微小管の(+)端は特定の構造に局在していることが多い。間期の極性細胞では、遊走中の線維芽細胞における先導端など、細胞の極性部位へ向かって微小管は伸びていることが多い。こうした配置は、ゴルジ体から極性部位への微小管結合小胞の送達に役立っていると考えられている。
微小管の動的不安定性は、這うように移動する(crawling)大部分の哺乳類細胞の遊走にも必要である[72]。動的な微小管は、RhoA[73]やRac1[74]などの重要なGタンパク質によって調節されており、これらによって細胞の収縮と拡張が調節されている。動的な微小管はフォーカルアドヒージョンの解体の開始にも必要であり、この過程は遊走に必要である[75]。微小管は移動時に細胞の後端を引き込む収縮力に対抗する、支柱のような役割を果たすことが明らかにされている。細胞の後端の微小管が動的である場合、微小管の再編成が行われ、収縮が可能となる。ダイナミクスが抑制されている場合には、微小管の再編成は行われず、そのため収縮力に対抗するはたらきをすることとなる[49]。微小管のダイナミクスが抑制された細胞の形態は、細胞の前端(移動方向)の拡張は可能であるものの、後端の収縮に問題を抱えていることを示している[76]。一方で、微小管の脱重合を引き起こす高濃度の薬剤や微小管の変異によって細胞の遊走能は回復されるものの、移動の方向性は失われる。微小管は細胞の移動の制限、移動の方向性の確立の双方に寄与している。
繊毛と鞭毛
微小管は、真核生物の繊毛や鞭毛において構造的に大きな役割を果たしている。繊毛や鞭毛は常にMTOC(この場合には基底小体と呼ばれる)から直接伸長する。さまざまな微小管上のダイニンモータータンパク質の作用によって繊毛や鞭毛は屈曲し、泳いだり、細胞外の物質を移動したりするための力が生み出されている[77]。原核生物にはFtsZなどのチューブリン様タンパク質が存在している[78]。しかしながら、原核生物の鞭毛の構造は真核生物のものとは全く異なり、微小管を基盤とした構造は存在していない。
発生
微小管によって形成される細胞骨格は、個体の発生過程における形態形成に必要不可欠である。一例として、極性を有する微小管ネットワークはキイロショウジョウバエDrosophila melanogasterの胚発生時に卵の軸を確立するために必要である。濾胞細胞と卵母細胞の間で送られるシグナル(上皮成長因子に類似した因子など)によって、(−)端は卵母細胞の下方に位置するよう微小管の再編成が引き起こされ、構造の極性化と前後軸の形成が生じる[79]。こうした体の構造の形成への関与は哺乳類でも観察される[80]。
微小管は高等脊椎動物の神経系の発生にも必要不可欠であり、神経系の発生時にはチューブリンのダイナミクスや関連するタンパク質(MAPなど)は細やかな制御を受けている[81]。
遺伝子調節
細胞骨格は、多くのレベルで機能する動的な系である。細胞骨格は細胞に特定の形状をもたらしたり、小胞や細胞小器官の輸送を補助しているだけでなく、遺伝子発現にも影響を及ぼす場合がある。こうしたコミュニケーションに関与するシグナル伝達機構はほとんど解明されていない。しかしながら、薬剤による微小管の脱重合と転写因子の特異的発現との関係が記載されており、こうした因子の存在に依存した遺伝子発現の変化に関する情報が得られている[82]。細胞骨格の変化による細胞応答調節には、CTGFのような成長因子の発現も関係している[83]。
出典
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads