Isopentenil-difosfato delta isomerase
From Wikipedia, the free encyclopedia
Remove ads
A isopentenil-difosfato delta isomerase, tamén chamada isopentenil pirofosfato isomerase (IPP isomerase),[1] é unha isomerase que cataliza a conversión da molécula relativamente pouco reactiva isopentenil pirofosfato (IPP) no electrófilo máis reactivo dimetilalil pirofosfato (DMAPP). Esta isomerización é un paso clave na biosíntese de isoprenoides por medio das vías do mevalonato e MEP.
- isopentenil difosfato dimetilalil difosfato
Isopentenil-pirofosfato delta isomerase 1 | |
| Identificadores | |
| Símbolo | IDI1 |
| Entrez | 3422 |
| HUGO | 5387 |
| OMIM | |
| RefSeq | NM_004508 |
| UniProt | Q13907 |
| Outros datos | |
| Número EC | 5.3.3.2 |
| Locus | Cr. 10 p15.3 |
Este encima pertence á familia das isomerases, especificamente ás oxidorredutases intramoleculares que transpoñen enlaces C=C. O nome sistemático desta clase de encimas é isopentenil-difosfato Delta3-Delta2-isomerase. Outros nomes de uso común son isopentenilpirofosfato Delta-isomerase, metilbutenilpirofosfato isomerase e isopentenilpirofosfato isomerase.[2][3][4]
Remove ads
Mecanismo encimático
A IPP isomerase cataliza a isomerización do IPP a DMAPP por medio dunha transposición antarafacial de hidróxeno.[5][6] As probas empíricas indican que esta reacción se produce por un mecanismo de protonación/desprotonación, coa adición dun protón á cara cara re do dobre enlace inactivado C3-C4 orixinando un intermediario transitorio carbocatión.[7][8] A retirada do protón pro-R de C2 forma o dobre enlace C2-C3 do DMAPP.

Remove ads
Estrutura encimática

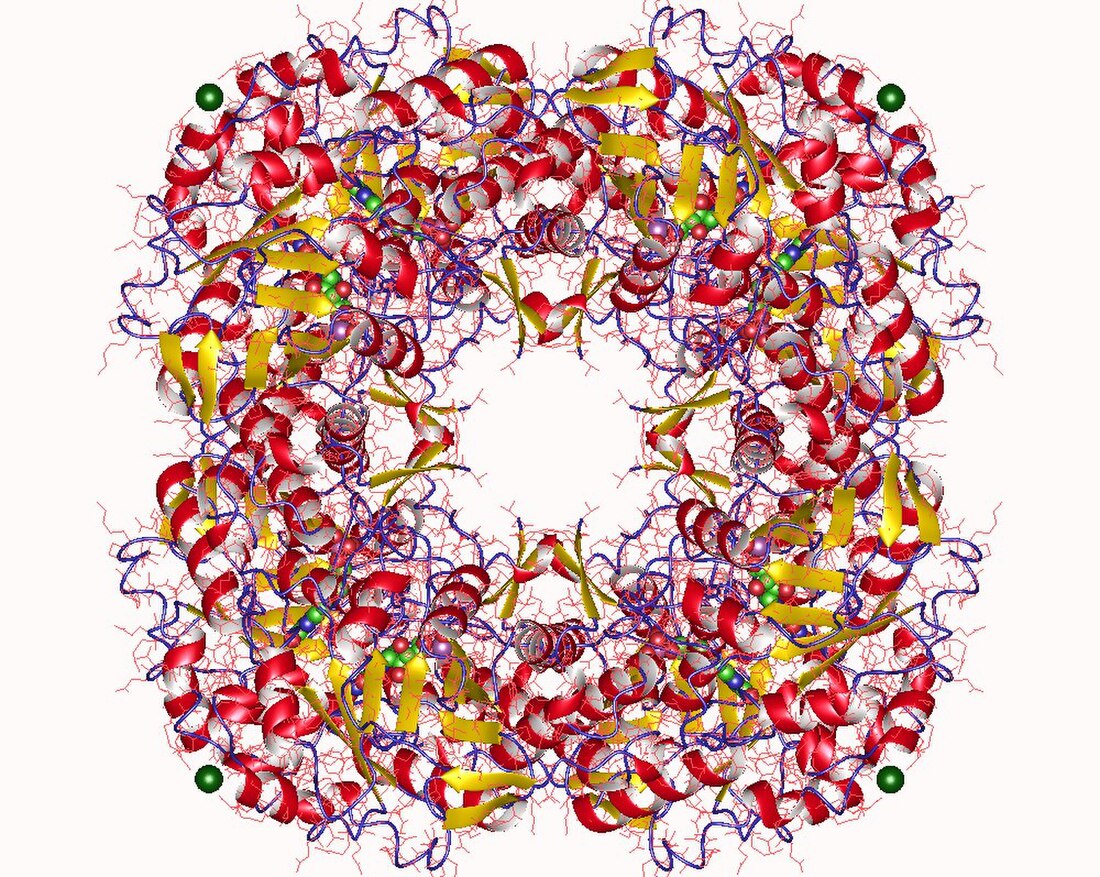
Os estudos cristalográficos indicaron que a forma activa da IPP isomerase é un monómero con hélices α e follas β alternantes.[9][10] O sitio activo da IPP isomerase está moi enterrado dentro do encima e consta dun residuo de ácido glutámico e outro de cisteína que interaccionan cos lados opostos do substrato IPP, consistentemente coa estereoquímica antarafacial da isomerización.[9][11] A orixe do paso de protonación inicial non foi establecido concluintemente. Probas recentes indican que o residuo de ácido glutámico está implicado no paso de protonación malia a observación de que a súa cadea lateral de ácido carboxílico está estabilizada na súa forma carboxilato.[12] Outro descubrimento foi que existe unha molécula de auga no sitio activo da IPP isomerase humana, que suxire un mecanismo no cal a molécula de auga podería ser o doante directo de protóns.[13]
A IPP isomerase tamén necesita un catión divalente para pregarse na súa conformación activa. O encima contén varios aminoácidos, incluíndo o glutamato catalítico, que están implicados na coordinación cun Mg2+ ou Mn2+.[9][14] A coordinación do catión metálico co residuo de glutamato estabiliza o intermediario carbocatión despois da protonación.
Estudos estruturais
A finais de 2007, resolvéranse 25 estruturas desta clase de encimas, cos seguintes códigos de acceso en PDB: PDB 1HX3, PDB 1HZT, PDB 1I9A, PDB 1NFS, PDB 1NFZ, PDB 1OW2, PDB 1P0K, PDB 1P0N, PDB 1PPV, PDB 1PPW, PDB 1PVF, PDB 1Q54, PDB 1R67, PDB 1VCF, PDB 1VCG, PDB 1X83, PDB 1X84, PDB 2B2K, PDB 2DHO, PDB 2G73, PDB 2G74, PDB 2I6K, PDB 2ICJ, PDB 2ICK e PDB 2PNY.
Remove ads
Función biolóxica
A protonación do dobre enlace inactivo raramente se ve na natureza, o que salienta o mecanismo catalítico único da isomerase IPP. A isomerización do IPP ao DMAPP é un paso crucial na síntese de isoprenoides e derivados de isoprenoides, compostos que desempeñan funcións vitais nas vías biosintéticas de todos os organismos vivos.[15] Debido á importancia da vía do melavonato na biosíntese de isoprenoides, a IPP isomerase encóntrase en diversos compartimentos celulares, como os plastidios e as mitocondrias de mamíferos.[16]

Importancia en enfermidades
As mutacións en IDI1, o xene que codifica a IPP isomerase 1, foron implicadas no descenso da viabilidade en diversos organismos, incluíndo os lévedos Saccharomyces cerevisiae, o nematodo Caenorhabditis elegans e a planta Arabidopsis thaliana.[17][18][19] Aínda que non hai evidencias directas da implicación das mutacións en IDI1 en enfermidades humanas, a análise xenómica identificou unha ganancia de número de copias preto de dous xenes de IPP isomerase nunha proporción substancial de pacientes de esclerose lateral amiotrófica esporádica, o que suxire que esta isomerase pode xogar un papel decisivo nesta doenza.[20]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads