トップQs
タイムライン
チャット
視点
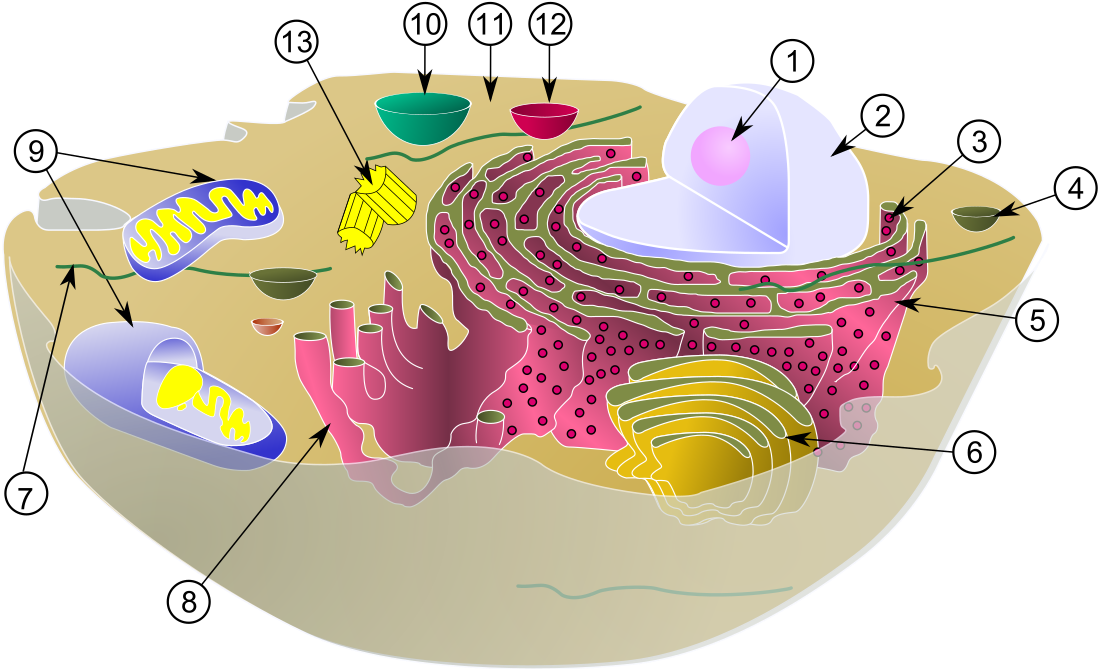
ゴルジ体
真核生物の細胞にみられる細胞小器官のひとつ ウィキペディアから
Remove ads
ゴルジ体(ゴルジたい、英: Golgi body)、ゴルジ装置(ゴルジそうち、英: Golgi apparatus)またはゴルジ複合体(ゴルジふくごうたい、英: Golgi complex)は、ほとんどの真核生物の細胞にみられる細胞小器官の1つである[1]。細胞質の内膜系の一部として、タンパク質を膜に包まれた小胞へ詰め込み、目的地へ送っている。ゴルジ体は、分泌経路、リソソーム経路、エンドサイトーシス経路の交点となっている。ゴルジ体はタンパク質の分泌のためのプロセシングに特に重要であり、タンパク質が通過した際にさまざまな単糖を付加する一連のグリコシル化酵素が含まれている。
ゴルジ体はイタリアの生物学者・病理学者カミッロ・ゴルジによって1898年に同定された[2]。「ゴルジ体」という名称は、後に彼の名をとって1910年代に命名されたものである[2]。
Remove ads
発見
ゴルジ体はサイズが大きく特徴的な構造を有するため、発見と詳細な観察が最初期に行われた細胞小器官の1つであり、1898年に神経系の研究を行っていたカミッロ・ゴルジによって発見された[2][3]。顕微鏡下での観察後、彼はこの構造をapparato reticolare interno(内部の網目状の装置)と名付けた。当初一部の人々はこの発見に疑問を抱いており、その構造的外観は単にゴルジの観察技法によって生み出された視覚的錯覚にすぎないといった主張がなされた。しかし20世紀に入って現代的な顕微鏡が開発され、彼の発見の確証が行われた[4]。初期の文献では、ゴルジ体はGolgi–Holmgren apparatus、Golgi–Holmgren ducts、Golgi–Kopsch apparatusなどさまざまな名称で言及されている[2]。Golgi apparatusという用語は1910年に用いられ、科学的文献に初めて現れるのは1913年である。Golgi complexという語は1956年に導入された[2]。
Remove ads
構造

大部分の真核生物では、ゴルジ体は膜に囲まれた扁平な円盤(槽、ゴルジ槽、嚢、シスターナ、シスターネ)が積み重なった構造(ゴルジ層板 [Golgi stack])をしており、これらは小胞体から出芽した小胞のクラスターに起源を有する。哺乳類細胞では一般的には40個から100個の層板が存在する[5]。1つの層板に含まれる槽は多くの場合4個から8個であるが、一部の原生生物では60個もの槽が重なっているのが観察されている[4]。こうした層板はシス槽(cis cisternae)、中間槽(medial cisternae)、トランス槽(trans cisternae)の3つの区画に分けられ、またシスゴルジ網(cis-Golgi network [CGN])、トランスゴルジ網(trans-Golgi network [TGN])と呼ばれる網目状のネットワーク構造に接している。CGNは最初の槽構造、TGNは最後の構造であり、TGNで小胞に詰め込まれたタンパク質はリソソーム、分泌小胞、または細胞表面へ送られる。通常TGNは層板に隣接して位置しているが、両者は分離している場合もある。酵母や植物では、TGNは初期エンドソームとして機能している可能性がある[6][7]。
ゴルジ体の構造や組織化には真核生物の間でも差異がみられる。一部の酵母では、層板形成は観察されない。ピキア酵母Pichia pastorisは層板を有するのに対し、出芽酵母Saccharomyces cerevisiaeは層板を形成しない[6]。植物では、ゴルジ体の個々の層板は独立して動作しているようである[6]。
各層板には、受け入れを担うシス面と出口となるトランス面が存在する。これらの面はそれぞれ固有の形態学的・生化学的特徴を有する[8]。個々の層板内は積み荷タンパク質を選択的に修飾する酵素が詰まっており、修飾はタンパク質の運命に影響を及ぼす。ゴルジ体の区画化は、こうした修飾酵素を分離し、連続的かつ選択的なプロセシング段階を維持するのに有利である。一般的なモデルでは、序盤の修飾を触媒する酵素はシス側の槽に集められ、終盤の修飾を触媒する酵素は層板のトランス側の槽に位置しているとされる[8][9]。
Remove ads
細胞内局在
ゴルジ体の細胞内局在は真核生物の中でも多様である。哺乳類では、通常1個のゴルジ体が核の近傍、中心体に近接して位置している。複数の層板が管状の連結部によって互いに結び付けられ、ゴルジリボン(Golgi ribbon)と呼ばれる構造を形成している。ゴルジ体や管状の連結部の局在は微小管に依存している。実験的には、微小管の脱重合によってゴルジ体は互いの連結を失い、個々の層板が細胞質中に広がることが観察されている[9]。一方、酵母では複数のゴルジ体が細胞質全体に散在している。植物では、ゴルジ体は中心体領域に濃縮されているわけではなく、またゴルジリボンも形成されない[6]。植物のゴルジ体の組織化はアクチン繊維に依存しており、微小管ではない[6]。こうした多様なゴルジ体に共通する特徴は、小胞体の出口部位に近接して位置していることである[10]。
機能

ゴルジ体は、小胞体から受け取ったタンパク質を集め、発送する場となっている。小胞体で合成されたタンパク質は小胞へ詰め込まれ、その後小胞はゴルジ体と融合する。ゴルジ体で積み荷タンパク質は修飾され、エキソサイトーシスを介した分泌、もしくは細胞内での使用へと振り分けられる。こうした点でゴルジ体は郵便局に似たものと考えることができ、すなわちパッケージされた品物(タンパク質)にラベルを付け、そして目的地(細胞内のさまざまな部位や細胞外空間)へと送る役割を果たしている。ゴルジ体は脂質の輸送やリソソームの形成にも関与している[11]。
ゴルジ体の構造と機能は密接な関係にある。一般的なモデルでは、個々の槽は異なる酵素の詰め合わせとなっており、積み荷タンパク質がシス面からトランス面へと移動するにつれてプロセシングが漸進的に進行するとされる[8][9]。ゴルジ層板内での酵素反応は、酵素が係留されている膜表面の近傍に限定されている。修飾を担う可溶性タンパク質や酵素が内腔にも存在している小胞体とはこの点で対照的である。ゴルジ体における酵素的プロセシングの大部分は、タンパク質の翻訳後修飾である。一般的なモデルでは、リソソームタンパク質上のオリゴ糖のリン酸化はCGNで行われる[9]。シス槽はマンノース残基の除去に関連している[8][9]。中間槽ではマンノース残基の除去とN-アセチルグルコサミンの付加が行われる[9]。ガラクトースやシアル酸の付加はトランス槽で行われる[9]。そしてTGNではチロシンや糖鎖の硫酸化が行われるとされる[9]。タンパク質に対して一般的に行われる他の翻訳後修飾として、グリコシル化[12]やリン酸化がある。タンパク質修飾によってシグナル配列が形成される場合があり、タンパク質の最終的な目的地が決定される。一例として、ゴルジ体ではリソソームへ送られるタンパク質にはマンノース-6-リン酸が付加される。また、ゴルジ体の他の重要な機能として、プロテオグリカンの形成が行われる。ゴルジ体の酵素がタンパク質にグリコサミノグリカンを付加することでプロテオグリカンは形成される[13]。グリコサミノグリカンは非分岐多糖分子であり、動物の細胞外マトリックスに存在する。
Remove ads
小胞輸送
一般的なモデルでは、粗面小胞体を出発した小胞はゴルジ体のシス面へと輸送され、そこでゴルジ膜と融合して内容物を内腔へ放出する。内腔へ移動した分子は修飾され、そして次の目的地への輸送に向けた選別が行われる。小胞体やゴルジ体以外の部位へ送られるタンパク質はトランス面へ向かって移動し、膜とそこに結合した小胞からなる複雑なネットワークであるTGNへ到達する。TGNでは、タンパク質は自身が有するシグナル配列に依存した形で選別され、目的地へ向けて出荷される。
Remove ads
小胞輸送とトラフィッキングに関する現行のモデル
要約
視点
タンパク質がゴルジ体を通過する、その正確な輸送機構は未解明であり、いくつかのモデルが提唱されている[14]。
モデル1: 小胞輸送モデル(安定な区画間での順行性小胞輸送)
このモデルでは、ゴルジ体は協働する安定な区画のセットから構成されていると考えられている。積み荷タンパク質を修飾するために機能する酵素群は、区画ごとに固有の組み合わせで存在している。タンパク質は小胞体からシス面へCOPII被覆小胞によって送達される。その後、積み荷はCOPI被覆小胞によってトランス面へ向かって進行する。このモデルはCOPI被覆小胞は2方向に移動するとされており、順行性小胞では分泌タンパク質などが輸送され、逆行性小胞ではゴルジ特異的輸送タンパク質のリサイクルが行われる[14]。
長所: ゴルジ体内に区画が存在すること、酵素の極性分布、層間を移動する積み荷の波を説明することができる。ゴルジ特異的酵素のリサイクルについても説明が試みられている[14]。
短所: COPI小胞の数は細胞種によって劇的に異なり、またゴルジ体の近傍に観察される小胞の数も限られている。COPI小胞では輸送できない大きな積み荷の輸送を説明することができない。COPI小胞が順行性・逆行性の双方の移動を行うことができるという明確なエビデンスは得られていない[14]。
このモデルは1980年代初頭から1990年代後半まで広く受け入れられていた[14]。
モデル2: 槽成熟モデル(槽の進行/成熟)
このモデルでは、小胞体からきたCOPII小胞の融合によってシス面の第一の槽の形成が開始され、そのまま進行して最終的にTGNの成熟した槽になるとされる。TGNにおいて、成熟した槽は解体されて分泌小胞となる。こうした進行が起こっている間、COPI小胞は継続的にゴルジ特異的タンパク質を古い槽から若い槽へ輸送しリサイクルする。リサイクルにさまざまなパターンが存在することで、ゴルジ層板のさまざまな生化学的特性が生じている可能性がある。このように、ゴルジ体内の各区画は動的な成熟過程における離散的段階を表しているとみなされる[14]。
長所: ゴルジ体内に区画が存在すること、各区画の生化学的特性の差異、大きな積み荷の輸送、槽の一過的形成と解体が説明される。観察されるゴルジ体の構造的多様性についても説明することができる[14]。
短所: 槽間にみられる管状の連結構造や、積み荷によってゴルジ体内の移動速度が異なることの説明が容易ではない[14]
モデル3: 管状構造を介した異種槽間輸送を伴う槽成熟モデル
このモデルはモデル2を拡張し、槽間の管状連結構造の存在を組み込んだものである。このモデルでは、管状構造が小胞体-ゴルジシステム内での双方向的輸送に重要な役割を果たしているとされる。この構造は、小さな積み荷の急速な順行性輸送や、ゴルジ内在タンパク質の逆行性輸送を可能にしている[14][15]。
長所: このモデルはモデル2の長所が全て含まれるとともに、積み荷の急速な輸送、そしてゴルジタンパク質がCOPI小胞非依存的にリサイクルされていることの説明が可能である[14]。
短所: このモデルでは、コラーゲン前駆体など管構造を拡散することができない巨大な積み荷タンパク質も指数関数的速度論に従うことを説明できない。また、管状の連結構造は植物細胞では一般的ではない。こうした連結構造の役割は普遍的形質ではなく、特定の細胞種における特殊化である可能性がある。膜が垂直方向にも連結されているのであれば、ゴルジ体内で観察される生化学的勾配を維持する機構が存在するはずである[14]。
モデル4: Rapid partitioning(急速な区画化)モデル
このモデルでは小胞輸送に関する従来の見方から最も劇的な転換がなされている。このモデルは、ゴルジ体は積み荷のプロセシングを担う膜ドメインと搬出を担う膜ドメインが存在する単一の区画として機能する。小胞体から送られてきた積み荷はこれら2つのドメインの間を移動し、確率論的にゴルジ体のどの層からでも最終的な目的地へ向けて出発する。このモデルは、ゴルジ体からの積み荷の搬出が指数関数的速度論に従うパターンで行われるという観察から支持される。ゴルジ体内に膜ドメインが存在することは蛍光顕微鏡データからも支持される[14]。
長所: このモデルは大きなタンパク質も小さなタンパク質も指数関数的速度論に従って輸送されることを説明することができる[14]。
短所: ゴルジ体に槽のような離散的区画が存在すること、また槽間の生化学的極性の説明が不足している。ゴルジネットワークの形成や解体、COPI小胞の役割の説明がなされていない[14]。
Model 5: Cisternal progenitor(槽前駆体)モデル
このモデルでは、ゴルジ体はさまざまなRabによって特徴づけられる安定な区画の集合体とみなされる。このアイデアは、エンドソーム膜ではRabが明確なドメインを形成していることに基づいている。あるドメインに結合しているRab(ここではRabAとする)がRab conversionと呼ばれる過程によって別種のRab(RabBとする)へ変換され、続いて隣接する槽のRabBからなるドメインとの間で同種Rab間順行性膜融合が生じることで輸送が行われる[14][16]。
長所: このモデルは多くの観察結果を説明でき、また成熟モデルの一部の長所も包含される。このモデルは"megavesicle"と呼ばれる巨大な輸送中間体の存在を説明することができる[14]。
短所: このモデルはゴルジ体の形態的多様性を説明しておらず、COPI小胞の役割も示されていない。ゴルジリボン構造が形成されず、層板が個々存在している植物、藻類、真菌に適用することが難しい。さらに、"megavesicle"はゴルジ体内の輸送中間体として一般的に観察される構造ではない[14]。
複数のモデルによってゴルジ体を通過する小胞輸送の説明が試みられているが、いずれのモデルもゴルジ体に関する全ての観察結果を説明するには至っていない。現在のところ槽成熟モデルが最も広く受け入れられており、真核生物全体にわたる多くの観察結果への対応がなされている。他のモデルも疑問点を明確にし、将来的な実験を導く重要な意味を持っている。COPI小胞の方向性、そして積み荷タンパク質の輸送を調節するRabの役割は、根本的な未解決問題である[14]。
Remove ads
ブレフェルジンA
ブレフェルジンA(BFA)は、ゴルジ体の機能の研究を目的として、分泌経路を実験的に破壊するために用いられる真菌由来の代謝産物である[17]。BFAは一部のADPリボシル化因子(ARF)の活性化を遮断する[18]。ARFは被覆タンパク質をエンドソームやゴルジ体へリクルートすることで小胞輸送を調節する低分子量GTPアーゼである[18]。BFAは、ARFへのGTPの結合を媒介している一部のグアニンヌクレオチド交換因子(GEF)の機能を阻害する[18]。そのため、細胞をBFA処理することで分泌経路は破壊され、ゴルジ体の解体が促進され、またゴルジタンパク質はエンドソームや小胞体に分布するようになる[17][18]。
ギャラリー
出典
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads