トップQs
タイムライン
チャット
視点
Myc
ホモサピエンスに見られる哺乳類タンパク質 ウィキペディアから
Remove ads
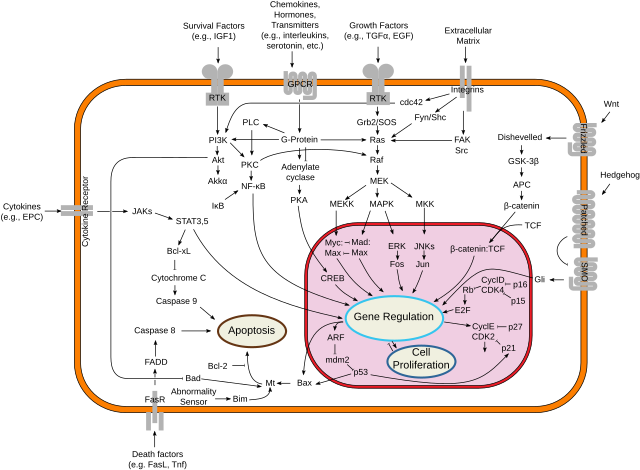
Mycは、転写因子をコードする遺伝子ファミリーであり、調節遺伝子かつがん原遺伝子のファミリーである。Mycファミリーは、関連する3つのヒト遺伝子c-Myc(MYC)、l-Myc(MYCL)、n-Myc(MYCN)から構成される。c-Myc(単にMyc、MYCと呼ばれることもある)はこのファミリーで最初に発見された遺伝子であり、名称はウイルス遺伝子v-mycとの相同性に由来する。
がんでは、c-Mycはしばしば恒常的に発現している。c-Mycによって多くの遺伝子の発現が上昇し、その一部は細胞増殖に関与しているため、がんの形成に寄与することとなる[1]。c-Mycと関係した染色体転座は、バーキットリンパ腫の症例の大部分で重要な役割を果たしている[2]。c-Myc遺伝子の恒常的なアップレギュレーションは頸部、大腸、胸部、肺、胃の癌腫でも観察されている[1]。そのため、Mycは抗がん剤の有望な標的であると考えられている[3]。残念ながら、Mycは抗がん剤の標的として適さないいくつかの特徴を持っているため、タンパク質自身を標的とする低分子化合物ではなく、MycをコードするmRNAを標的とするなど、間接的にタンパク質に作用することが必要である[4][5]。
ヒトゲノムでは、c-Mycは8番染色体に位置しており、E-boxへの結合を介して全遺伝子の15%の発現を調節していると考えられている[6]。
典型的な転写因子としての役割に加えて、N-Mycはヒストンアセチル化酵素をリクルートする可能性がある。これによって、ヒストンのアセチル化を介して全体的なクロマチン構造の調節が可能となる[7]。
Remove ads
発見
鳥類のウイルス(avian myelocytomatosis virus)にコードされるがん遺伝子(v-myc)の発見後、相同な遺伝子(c-Myc)が正常細胞にも存在することが発見された。後に、さらに他の相同遺伝子n-Mycとl-Mycが発見され、Mycファミリーへ加えられた[8]。
バーキットリンパ腫のがん細胞では染色体転座が生じており、8番染色体と14番染色体間の転座 [t(8;14)] が最も一般的である。この転座によってc-Mycは非常に活性の高い免疫グロブリン(Ig)プロモーター領域の下流に配置され、c-Mycの過剰発現が引き起こされる[2][8]。
構造
Mycファミリーの遺伝子はすべてMycファミリーの転写因子をコードしており、塩基性ヘリックスループヘリックス(bHLH)とロイシンジッパー(LZ)モチーフを含んでいる。bHLHモチーフはMycのDNAへの結合を担い、LZモチーフは他のbHLH型転写因子であるMaxとの二量体化を担う[9]。
MycのmRNAはIRESを含んでおり、ウイルス感染時など5'キャップ依存的な翻訳が阻害された際にもタンパク質への翻訳を行うことが可能となる[10]。
機能
Mycタンパク質は、E-box配列への結合とヒストンアセチル化酵素のリクルートによって多くの増殖促進遺伝子の発現を活性化する転写因子である。Mycは転写伸長因子のリクルートによって、活発に転写されている遺伝子の転写伸長反応をアップレギュレーションすると考えられている[11]。また、Mycはリプレッサーとして機能することもある。MycはMiz-1転写因子に結合することで、p300転写コアクチベーターと置き換わることで、Miz-1の標的遺伝子の発現を阻害する。さらに、MycはDNA複製の制御に直接的役割を持ち[12]、この活性はがん細胞でのDNA増幅に寄与している可能性がある[13]。
Mycは血清刺激やWnt、Shh、EGF(MAPK/ERK経路を介して)などさまざまな分裂促進シグナルによって活性化される[14]。Mycの活性化は、標的遺伝子の発現変化によって多くの生物学的影響を引き起こす。最初に発見されたのは細胞増殖を駆動する能力(サイクリンのアップレギュレーションとp21のダウンレギュレーション)であるが、それだけでなく細胞成長(rRNAとリボソームタンパク質のアップレギュレーション)、アポトーシス(Bcl-2のダウンレギュレーション)、分化、幹細胞の自己複製などの調節にも重要な役割を果たす。ヌクレオチドの代謝に関与する遺伝子もMycによってアップレギュレーションされ[15]、この作用はMyc誘導性の細胞増殖[16]や細胞成長[17]に必要である。
細胞競合におけるMycの役割を明確に示す研究がいくつか存在する[18]。
c-MycはB細胞の増殖に大きな影響を与え、MYCの遺伝子増幅はB細胞の悪性化、そして組織学的形質転換を含む悪性度(aggressiveness)の増大と関係している[19]。
Myc-nick

Myc-nickは、全長のc-MycとN-Mycの切断によって産生される細胞質型のMycである[20]。Mycの切断はカルシウム依存的な細胞質プロテアーゼであるカルパインファミリーによって行われる。
カルパインによるMycの切断は恒常的な過程であるが、終末分化などMycレベルの迅速なダウンレギュレーションが必要な状況下で増加する。切断に伴ってDNA結合ドメインを含むC末端領域が分解されるが、N末端の298残基の断片は細胞質にとどまり続ける。Myc-nickはヒストンアセチル化酵素やユビキチンリガーゼの結合ドメインを含んでいる。
Myc-nickの機能は現在研究中であるが、この新たなMycファミリーのメンバーは細胞の形態を調節し、少なくとも一部はアセチル基転移酵素と相互作用することで、α-チューブリンのアセチル化を促進することが示されている。Myc-nickの異所性発現は筋芽細胞への分化を加速する。
Remove ads
臨床的意義
最初期遺伝子を除いて、Mycは遺伝子発現を全体的にアップレギュレーションする。アップレギュレーションの効果は非線形的であり、Myc非存在下ですでにアップレギュレーションされている遺伝子の発現はMycの存在によって強くブーストされるが、Myc非存在下での発現レベルが低い遺伝子はMycの存在下でも小さなブースト効果しか見られない[21]。
Mycの過剰活性化下でのSUMO活性化酵素(SAE1/SAE2)の不活性化は、がん細胞の分裂期崩壊と細胞死を引き起こす。したがって、SUMO化の阻害剤はがん治療薬となる可能性がある[22]。
MYC遺伝子の増幅は上皮性卵巣がんの症例の多くでみられる[23]。TCGAのデータによると、MYCの増幅は乳がん、大腸がん、膵臓がん、胃がん、子宮がんを含むいくつかのがんで生じている[24]。
正常細胞からがん細胞への実験的な形質転換過程では、MYC遺伝子はRAS遺伝子と協働的に機能する[25][26]。
一部のがんでは、Mycの発現はBRD4の機能に大きく依存している[27][28]。BET阻害剤は臨床前がんモデルでMycの機能をブロックすることに成功しており、現在臨床試験での評価が行われている[29]。
Remove ads
動物モデル
ショウジョウバエではMycはdiminutive遺伝子座にコードされており、1935年以前から遺伝学者に知られていた[30]。diminutive変異体は生存可能であるが、体のサイズが小さくなる。その後、ショウジョウバエはMycの細胞競合[31]、核内倍加[32]、細胞成長[33]における役割を示すために利用された。
Myc遺伝子の発見を通じて、バーキットリンパ腫で8番染色体へ転座した染色体の切断部には免疫グロブリン遺伝子が含まれることが明らかにされた。バーキットリンパ腫におけるMycの発現パターンを模倣することで腫瘍形成機構を研究するため、トランスジェニックマウスモデルが開発された。トランスジェニックマウスでIgM重鎖エンハンサーの制御下に置かれたMyc遺伝子は、主にリンパ腫を形成した[34]。マウスの研究では、Mycの発現低下が長寿を誘導することが示され、両性で寿命の中央値と最大値の延長、そして全年齢層での致死率の低下、健康の改善、がんの進行の低下、代謝の改善がみられ、体のサイズは小さくなった。また、AMPK活性の上昇、TOR、AKT、S6Kの活性低下や他のエネルギーや代謝に関する経路の変化(酸素消費の増加、運動の増加など)がみられた[35]。この研究ではCre-loxPリコンビナーゼによってMycの1コピーがノックアウトされたハプロ不全型のマウス(Myc+/-)が用いられた。このマウスの表現型は通常の加齢の影響に抗するもので、カロリー制限、Ames dwarf、ラパマイシン、メトホルミン、レスベラトロール処理マウスなどの他の長寿マウスモデルの多くと共通していた。他の研究では、Mycとp53の遺伝子が慢性骨髄性白血病(CML)細胞の生存に重要であることが示されている。薬剤によるMycとp53の標的化はCMLマウスで良好な結果が得られた[36][37]。
Remove ads
幹細胞との関係
c-Mycは人工多能性幹細胞(iPS細胞)の形成に大きな役割を果たす。c-Mycは、山中伸弥らによって発見された、細胞が幹細胞様状態を回復するために必要な4つのオリジナル因子の1つである(他の3つの転写因子はOct4、Sox2、Klf4)。その後、c-MycなしでもiPS細胞の形成が可能であることが示されている[38]。
相互作用
MYCは次に挙げる因子と相互作用する。
- ACTL6A[39]
- BRCA1[40][41][42][43]
- BCL2[44]
- CCNT1[45]
- CHD8[46]
- DNMT3A[47]
- EP400[48]
- GTF2I[49]
- KAT5[50]
- let-7[51][52][53]
- MAPK1[44][54][55]
- MAPK8[56]
- MAX[57][58][59][60][61][62][63][64][65][66][67][68][69]
- MLH1[61]
- MYCBP2[70]
- MYCBP[71]
- NMI[40]
- NFYB[72]
- NFYC[73]
- P73[74]
- PCAF[75]
- PFDN5[76][77]
- RUVBL1[39][48]
- SAP130[75]
- SMAD2[78]
- SMAD3[78]
- SMARCA4[39][57]
- SMARCB1[60]
- SUPT3H[75]
- TIAM1[79]
- TADA2L[75]
- TAF9[75]
- TFAP2A[80]
- TRRAP[39][58][59][75]
- WDR5[81]
- YY1[82]
- ZBTB17[83][84]
- C2orf16[85]
Remove ads
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads