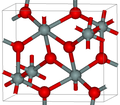
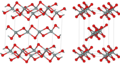
Силициум диоксид
хемиско соединение From Wikipedia, the free encyclopedia
Remove ads
Силициум диоксид — оксид на силициум со хемиска формула SiO
2, најчесто се среќава во природата како кварц.[1][2] Во многу делови од светот, силициум диоксид е главната состојка на песокот. Силиката е една од најкомплексните и најзастапените фамилии на материјали, која постои како соединение од повеќе минерали и како синтетички производ. Забележителни примери вклучуваат фузиран кварц, гасен силициум диоксид, силика гел, опал и аерогели. Се користи во структурни материјали, микроелектроника (како електричен изолатор) и како компоненти во прехранбената и фармацевтската индустрија.
Remove ads
Структура



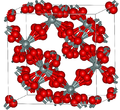
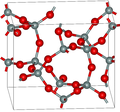
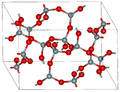
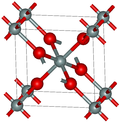
Во поголемиот дел од силициум диоксидот, силиконскиот атом покажува тетраедарска координација, со четири атоми на кислород што го опкружуваат централниот атом на Si (види 3-Д единична ќелија). Така, SiO2 формира 3-димензионални мрежни цврсти материи во кои секој атом на силикон е ковалентно поврзан на тетраедарски начин со 4 атоми на кислород. Спротивно на тоа, CO2 е линеарна молекула. Остро различните структури на диоксидите на јаглеродот и силициумот се манифестација на правилото за двојна врска.
SiO2 има неколку различни кристални форми, но тие речиси секогаш ја имаат истата локална структура околу Si и O. Во α-кварц должината на врската Si-O е 161 pm, додека кај α-тридимитот е во опсег од 154-171 pm. Аголот Si–O–Si исто така варира помеѓу ниска вредност од 140 ° кај α-тридимит, до 180° кај β-тридимит. Во α-кварцот, аголот Si–O–Si е 144°.[4]
Полиморфизам
Алфа кварцот е најстабилната форма на цврст SiO2 на собна температура. Високотемпературните минерали, кристобалит и тридимит, имаат и помала густина и пониски индекси на рефракција од кварцот. Трансформацијата од α-кварц во бета-кварц се одвива нагло на 573 °C. Бидејќи трансформацијата е придружена со значителна промена во волуменот, таа лесно може да предизвика фрактура на керамика или карпи кои минуваат низ оваа температурна граница.[5] Минералите под висок притисок, сеифертитот, стишовитот и козитот, сепак, имаат поголема густина и индекси на рефракција од кварцот.[6] Стишовитот има структура слична на рутил каде силиконот е 6-координати. Густината на стишовитот е 4.287 g/cm 3, што се споредува со α-кварцот, најгустиот од формите со низок притисок, кој има густина од 2,648 g/cm 3 . Разликата во густината може да се припише на зголемувањето на координацијата бидејќи шесте најкратки должини на Si-O врската во стишовитот (четири Si-O должини на врската од 176 pm и две други од 181 pm) се поголеми од должината на врската Si-O ( 161 часот) во α-кварц.[7] Промената на координацијата ја зголемува јоноста на врската Si–O.[8] Што е уште поважно, сите отстапувања од овие стандардни параметри претставуваат микроструктурни разлики или варијации, кои претставуваат пристап кон аморфно тело, стаклестото тело или стаклестото тело.
Фаујазит силика, друг полиморф, се добива со делуминирање на ниско-натриум, ултрастабилен Y зеолит со комбинирана киселина и топлинска обработка. Добиениот производ содржи над 99% силициум диоксид и има висока кристалиност и специфична површина (над 800 m 2/g). Фаујазит-силика има многу висока топлинска и киселинска стабилност. На пример, одржува висок степен на долг дострел на молекуларен ред или кристалност дури и по вриење во концентрирана хлороводородна киселина.[9]
Растопен SiO2
Растопен силициум диоксид покажува неколку посебни физички одлики кои се слични на оние забележани во течна вода: негативна температурна експанзија, максимална густина на температури ~ 5000 °C и минимум топлински капацитет.[10] Неговата густина се намалува од 2,08 g/cm 3 во 1950 °C до 2,03 g/cm3 на 2200 °C.[11]
Молекуларен SiO2
Молекуларниот SiO2 има линеарна структура како CO. Се произведува со комбинирање на силициум моноксид (SiO) со кислород во аргон матрица. Димерниот силициум диоксид, (SiO2)2 е добиен со реакција на O2 со матрикс изолиран димерен силициум моноксид, (S2O2). Во димерниот силициум диоксид има два атоми на кислород кои се премостуваат помеѓу атомите на силиконот со агол Si–O–Si од 94° и должина на врската од 164,6 pm, а должината на терминалната врска Si–O е 150,2 pm. Должината на врската Si–O е 148,3 pm, што се споредува со должината од 161 pm во α-кварц. Енергијата на врската се проценува на 621,7 kJ/mol.[12]
Remove ads
Природна појава
Геологија
SiO
2 најчесто се наоѓа во природата како кварц, кој сочинува повеќе од 10% по маса од Земјината кора. Кварцот е единствениот полиморф на силициум диоксид стабилен на површината на Земјата. Метастабилни појави на формите под висок притисок коизит и стишовит се пронајдени околу структурите на ударот и се поврзани со еклогити формирани за време на метаморфизмот со ултра висок притисок. Високотемпературните форми на тридимит и кристобалит се познати од вулканските карпи богати со силика. Во многу делови од светот, силициум диоксид е главната состојка на песокот[13].
Биологија
И покрај тоа што е слабо растворлив, силициум диоксид се јавува во многу растенија како што е оризот. Растителните материјали со висока содржина на силициум фитолит се смета дека се важни за животните кои пасат, од инсекти за џвакање до копитари. Силиката го забрзува трошењето на забите, а високите нивоа на силициум диоксид во растенијата кои често ги јадат тревопасните животни може да се развиле како одбранбен механизам против предаторството.[14][15]
Силика е исто така примарна компонента на пепелта од оризова лушпа, која се користи, на пример, во филтрација и како дополнителен цементен материјал (SCM) во производството на цемент и бетон.
Повеќе од 1000 милиони години, силицификацијата во и од клетките е вообичаена во биолошкиот свет. Во современиот свет, се јавува кај бактерии, едноклеточни организми, растенија и животни (безрбетници и ’рбетници). Истакнати примери вклучуваат:
- Тестови или фрустули (т.е. школки) на дијатоми, радиоларија и амеби.[2]
- Силика фитолити во клетките на многу растенија, вклучувајќи ги и коњски опашки, практично сите треви и широк спектар на дикотиледони.
- Спикулите го формираат скелетот на многу сунѓери.
Кристалните минерали формирани во физиолошката средина често покажуваат исклучителни физички својства (на пр., сила, цврстина, цврстина на фрактура) и имаат тенденција да формираат хиерархиски структури кои покажуваат микроструктурен ред во низа размери. Минералите се кристализираат од средина која е недоволно заситена во однос на силициумот, и во услови на неутрална pH вредност и ниска температура (0-40 °C).
Remove ads
Употреба
Структурна употреба
Околу 95% од комерцијалната употреба на силициум диоксид (песок) се јавува во градежната индустрија, на пр. за производство на бетон ( портланд цемент бетон).[16]
Одредени наоѓалишта на силика песок, со посакувана големина и форма на честички и пожелна содржина на глина и други минерали, биле важни за песокот за лиење на метални производи.[17] Високата точка на топење на силициум диоксид овозможува да се користи во такви апликации како што е лиење железо; модерното леење песок понекогаш користи други минерали од други причини.
Кристалниот силициум диоксид се користи при хидраулично фрактурирање на формации кои содржат цврсто масло и гас од шкрилци.[18]
Претходник на стакло и силициум
Силика е примарна состојка во производството на повеќето стакло. Како што другите минерали се топат со силика, принципот на депресија на точката на замрзнување ја намалува точката на топење на смесата и ја зголемува флуидноста. Температурата на транзиција на стаклото на чистиот SiO 2 е околу 1475 К.[19] Кога растопениот силициум диоксид SiO2 брзо се лади, тој не се кристализира, туку се зацврстува како стакло. Поради ова, повеќето керамички глазури имаат силика како главна состојка.
Структурната геометрија на силициумот и кислородот во стаклото е слична на онаа во кварцот и повеќето други кристални форми на силициум и кислород со силициум опкружен со редовни тетраедри на кислородни центри. Разликата помеѓу стаклената и кристалната форма произлегува од поврзаноста на тетраедарските единици: Иако не постои периодичност на долг дострел во стаклената мрежа, редоследот останува на должината скали далеку од должината на врската SiO. Еден пример за ова подредување е претпочитањето да се формираат прстени од 6-тетраедри.[20]
Поголемиот дел од оптичките влакна за телекомуникации исто така се направени од силика. Тоа е примарна суровина за многу керамика како што се глинени садови, камени садови и порцелан.
Силициум диоксид се користи за производство на елементарен силициум. Процесот вклучува карботоплинска редукција во електрична лачна печка:[21]
Парен силициум диоксид
Испарената силика, позната и како пироген силициум диоксид, се подготвува со согорување на SiCl<sub id="mwAQg">4</sub> во водороден пламен богат со кислород за да се произведе „чад“ од SiO2 .
Може да се произведе и со испарување на кварцен песок во 3000 °C електричен лак. И двата процеса резултираат со микроскопски капки од аморфна силициум диоксид споени во разгранети, верижни, тродимензионални секундарни честички кои потоа се агломерираат во терциерни честички, бел прав со екстремно мала зафатнинска густина (0,03-,15 g/cm3) и со тоа висока површина .[22] Честичките делуваат како тиксотропно средство за згуснување, или како средство против стврднување и може да се третираат за да се направат хидрофилни или хидрофобни за примена на вода или органска течност.

Силициум чад е ултрафин прав собран како нуспроизвод од производството на силициум и легури на феросилициум. Се состои од аморфни (некристални) сферични честички со просечен дијаметар на честички од 150 nm, без разгранување на пирогениот производ. Главната употреба е како позолански материјал за бетон со високи перформанси. Испарените наночестички силика може успешно да се користат како средство против стареење во врзива за асфалт.[23]
Прехранбени, козметички и фармацевтски апликации
Силика, или колоидна, таложена или пирогена испарувана, е вообичаен додаток во производството на храна. Се користи првенствено како средство за проток или против стврднување во храната во прав, како што се зачините и кремот за кафе без млечни производи, или прашоци за да се формираат во фармацевтски таблети.[22] Може да апсорбира вода во хигроскопски апликации. Колоиден силициум диоксид се користи како фино средство за вино, пиво и сок, со референца Е-број E551 .
Во козметиката, силициум диоксид е корисен поради својствата на дифузија на светлина [24] и природната апсорпција.[25]
Дијатомејската земја, миниран производ, се користи во храната и козметиката со векови. Се состои од силика школки на микроскопски дијатоми; во помалку обработена форма се продавала како „прашок за заби“. Произведената или минирана хидрирана силициум диоксид се користи како тврд абразив во пастата за заби.
Полупроводници
Силиконскиот диоксид е широко користен во технологијата на полупроводници
- за примарна пасивација (директно на полупроводничката површина),
- како оригинален диелектрик на портата во MOS технологијата. Денес, кога скалирањето напредува под 10 nm силициум диоксидот е заменет со други диелектрични материјали како хафниум оксид или слично со повисока диелектрична константа во споредба со силициум диоксид,
- како диелектричен слој помеѓу металните (жици) слоеви (понекогаш и до 8-10) поврзувачки елементи и
- како втор пасивационен слој (за заштита на полупроводничките елементи и слоевите за метализација) обично денес слоевит со некои други диелектрици како силициум нитрид.
Бидејќи силициум диоксидот е природен оксид на силициумот, тој е пошироко користен во споредба со другите полупроводници како галиум арсенид или индиум фосфид.
Силициум диоксид може да се одгледува на силициумска полупроводничка површина.[26] Слоевите од силициум оксид може да ги заштитат силиконските површини за време на процесите на дифузија и може да се користат за маскирање на дифузија.[27][28]
Површинската пасивација е процес со кој полупроводничката површина се прави инертна и не ги менува својствата на полупроводниците како резултат на интеракција со воздухот или други материјали во контакт со површината или работ на кристалот.[29][30] Формирањето на топлински развиен слој од силициум диоксид во голема мера ја намалува концентрацијата на електронските состојби на површината на силициумот.[30] SiO2 ги зачувуваат електричните одлики на p-n спојниците и спречуваат овие електрични одлики да се влошат поради гасовитата околина.[28] Слоевите од силициум оксид може да се користат за електрично стабилизирање на силиконските површини.[27] Процесот на површинска пасивација е важен метод за изработка на полупроводнички уреди што вклучува обложување на силиконски нафора со изолационен слој од силициум оксид, така што електричната енергија може сигурно да навлезе во спроводливиот силициум долу. Растењето на слој од силициум диоксид на врвот на силиконската обланда му овозможува да ги надмине површинските состојби кои инаку спречуваат струјата да стигне до полупроводливиот слој.[29][31]
Процесот на пасивација на површината на силициумот со топлинска оксидација (силициум диоксид) е критичен за индустријата за полупроводници. Најчесто се користи за производство на транзистори со ефект на поле од метал-оксид-полупроводник (MOSFET) и чипови со силиконски интегрални кола (со рамнина процес).[29][31]
Останато
Хидрофобниот силициум диоксид се користи како компонента за депенење .
Во својот капацитет како огноотпорен материјал, корисен е во форма на влакна како високотемпературна топлинска заштитна ткаенина.
Силика се користи во екстракција на ДНК и РНК поради неговата способност да се врзува за нуклеинските киселини под присуство на хаотропи .[32]
Силика аергел се користела во вселенското летало Стардаст за собирање вонземски честички.[33]
Чистиот силициум диоксид кога се лади како споен кварц во чаша без вистинска точка на топење, може да се користи како стаклено влакно за фибреглас.
Инсектицид
Силикон диоксидот е истражуван за земјоделски апликации како потенцијален инсектицид .[34][35]
Remove ads
Производство
Силиконскиот диоксид најмногу се добива со ископување, вклучувајќи ископ на песок и прочистување на кварц. Кварцот е погоден за многу намени, додека хемиската обработка е потребна за да се направи почист или на друг начин посоодветен (на пр. пореактивен или ситнозрнест) производ.
Преципитирана силициум диоксид
Таложениот силициум диоксид или аморфна силициум диоксид се добива со закиселување на растворите на натриум силикат. Желатинозниот талог или силика гел, прво се мие, а потоа се дехидрира за да се добие безбојна микропорозна силициум диоксид. Идеализираната равенка која вклучува трисиликатна и сулфурна киселина е:
Приближно една милијарда килограми годишно (1999) се произведуваа силициум диоксид на овој начин, главно за употреба за полимерни композити - гуми и ѓон за чевли.[16]
На микрочипови
Тенките фолии од силициум диоксид растат спонтано на силиконските нафори преку топлинска оксидација, создавајќи многу плиток слој од околу 1 nm или 10 Å т.н. природен оксид.[36] Повисоки температури и алтернативни средини се користат за одгледување на добро контролирани слоеви на силициум диоксид на силициум, на пример на температури помеѓу 600 и 1200 °C, користејќи таканаречена сува оксидација со O2
или влажна оксидација со H2O.[37][38]
Природниот оксиден слој е корисен во микроелектрониката, каде што делува како електричен изолатор со висока хемиска стабилност. Може да го заштити силиконот, да складира полнење, да ја блокира струјата, па дури и да дејствува како контролирана патека за ограничување на протокот на струја.[39]
Лабораториски или специјални методи
Од органосилициумски соединенија
Многу патишта до силициум диоксид започнуваат со органосилициумско соединение, на пр., HMDSO,[40] TEOS. Синтезата на силициум диоксид е илустрирана подолу со користење на тетраетил ортосиликат (TEOS).[41] Едноставно загревање на TEOS на 680–730 °C резултира со оксид:
Слично, TEOS согорува околу 400 °C:
TEOS се подложува на хидролиза преку таканаречениот процес сол-гел. Текот на реакцијата и природата на производот се под влијание на катализаторите, но идеализираната равенка е:[42]
Други методи
Бидејќи е многу стабилен, силициум диоксидот произлегува од многу методи. Концептуално едноставно, но со мала практична вредност, согорувањето на силинот дава силициум диоксид. Оваа реакција е аналогна на согорувањето на метан:
Сепак , хемиското таложење на пареа на силициум диоксид на кристалната површина од силинот се користело со користење на азот како гас-носител на 200-500 °C.[43]
Remove ads
Хемиски реакции
Силициум диоксидот е релативно инертен материјал (оттука и неговата широко распространета појава како минерал. Силиката често се користи како инертни контејнери за хемиски реакции. На високи температури, тој се претвора во силициум со редукција со јаглерод.
Флуорот реагира со силициум диоксид за да формира SiF4 и O2 додека другите халогени гасови (Cl2, Br2, I2 ) се нереактивни.
Повеќето форми на силициум диоксид се нападнати („огравини“) од флуороводородна киселина (HF) за да се произведе хексафлуоросилициумска киселина:[4]
- SiO
2 + 6 HF → H
2SiF
6 + 2 H
2O
Стишовит, кој не реагира во некој значаен степенref name="Fleischer1962">Fleischer, Michael (1962). „New mineral names“ (PDF). American Mineralogist. Mineralogical Society of America. 47 (2): 172–174. Архивирано (PDF) од изворникот 2011-07-22.</ref>) HF се користи за отстранување или обликување на силициум диоксид во полупроводничката индустрија.
Силикон диоксидот делува како Киселинско-базна ракција, која може да реагира со бази под одредени услови. Бидејќи не содржи водород, нехидрираната силициум диоксид не може директно да делува како Бренстнед-Лоуриева киселина. Додека силициум диоксидот е слабо растворлив во вода при ниска или неутрална pH вредност (обично, 2 × 10 -4 M за кварц до 10 -3 M за криптокристален халцедон), силните бази реагираат со стакло и лесно го раствораат. Затоа, силните основи треба да се чуваат во пластични шишиња за да се избегне заглавување на капачето на шишето, за да се зачува интегритетот на примачот и да се избегне несакана контаминација со силикатни анјони[44].
Силициум диоксид се раствора во врел концентриран алкали или споен хидроксид, како што е опишано во оваа идеализирана равенка:
Силициум диоксидот ќе ги неутрализира оксидите на основните метали (на пр. натриум оксид, калиум оксид, олово(II) оксид, цинк оксид или мешавини од оксиди, формирајќи силикати и чаши кога врските Si-O-Si во силициум диоксид последователно се кршат). Како пример, реакцијата на натриум оксид и SiO2 може да произведе натриум ортосиликат, натриум силикат и чаши, во зависност од пропорциите на реактантите:
- .
Примери на такви чаши имаат комерцијално значење, на пр. стакло од сода и вар, боросиликатно стакло, оловно стакло. Во овие очила, силициум диоксид се нарекува мрежен или решеткаст. Реакцијата исто така се користи во високите печки за отстранување на нечистотиите од песок во рудата со неутрализација со калциум оксид, со што се формира калциум силикатна згура.

Силикон диоксидот реагира во загреан рефлукс под динитроген со етилен гликол и база на алкален метал за да произведе високо реактивни, пентакоординатни силикати кои обезбедуваат пристап до широк спектар на нови силициумски соединенија[45]. Силикатите се суштински нерастворливи во сите поларни растворувачи освен метанол.
Силициум диоксид реагира со елементарен силициум на високи температури за да произведе SiO:
Растворливост во вода
Растворливоста на силициум диоксид во вода силно зависи од неговата кристална форма и е три-четири пати поголема за силициум диоксид. од кварц; во функција на температурата, таа достигнува максимум околу 340 °C (644 °F)[46]. Ова својство се користи за одгледување на единечни кристали на кварц во хидротермалниот процес каде природниот кварц се раствора во прегреана вода во сад под притисок кој е поладен на врвот. Кристали од 0,5–1 kg може да се одгледува 1-2 месеци. Овие кристали се извор на многу чист кварц за употреба во електронски апликации. Над критичната температура на водата 647.096 K (373.946 °C; 705.103 °F) и притисок од 22.064 megapascals (3,200.1 psi) или повисока, водата е суперкритична течност и растворливоста е повторно повисока отколку на пониски температури[47].
Remove ads
Здраствени ефекти
Силиката внесена орално во суштина е нетоксична, со LD50 од 5000 mg/kg (5 g/kg). Студијата од 2008 година, следена 15 години, покажала дека повисоките нивоа на силициум диоксид во водата го намалуваат ризикот од деменција. Зголемување за 10 mg/ден силициум диоксид во водата за пиење бил поврзан со намален ризик од деменција за 11%.[48]
Вдишувањето ситно поделена кристална силициумова прашина може да доведе до силикоз, бронхитис или рак на белите дробови, бидејќи прашината се таложи во белите дробови и континуирано го иритира ткивото, намалувајќи ги капацитетите на белите дробови.[49] Кога ситните честички на силициум диоксид се вдишуваат во доволно големи количини (како на пример преку професионална изложеност), тоа го зголемува ризикот од системски автоимуни болести како што се лупус [50] и ревматоиден артритис во споредба со очекуваните стапки кај општата популација.
Професионална опасност
Силиката е професионална опасност за луѓето кои вршат пескарење или работат со производи кои содржат кристален силициум диоксид во прав. Аморфниот силициум диоксид, како што е испразнет силициум диоксид, може да предизвика неповратно оштетување на белите дробови во некои случаи, но не е поврзано со развој на силикоза. Децата, астматичарите од која било возраст, оние со алергии и постарите лица (сите имаат намален капацитет на белите дробови) може да бидат погодени за помалку време.[51]
Кристалниот силициум диоксид е професионална опасност за оние кои работат со камени површини, бидејќи процесот на сечење и инсталирање на работните површини создава големи количини на силициум диоксид во воздухот.[52] Кристалниот силициум диоксид кој се користи во хидрауличното фрактурирање претставува опасност по здравјето на работниците.
Патофизиологија
Во телото, честичките од кристална силика не се раствораат во текот на клинички релевантни периоди. Силициумските кристали во белите дробови можат да го активираат инфламаторниот NLRP3 во макрофагите и дендритичните клетки и со тоа да резултираат со производство на интерлеукин, високо проинфламаторен цитокин во имунолошкиот систем.[53][54][55]
Регулатива
Регулативите што ја ограничуваат изложеноста на силициум диоксид „во однос на опасноста од силикоза“ наведуваат дека тие се однесуваат само на силициум диоксид, кој истовремено е кристален и создава прашина.[56][57][58][59][60][61]
Во 2013 година, Управата за безбедност и здравје при работа на САД ја намалила границата на изложеност на 50 µg /m 3 воздух. Пред 2013 година дозволувала 100 µg/m 3 и кај градежните работници дури 250 µg/ m3. Во 2013 година, OSHA исто така барала „зелено завршување“ на фракирани бунари за да се намали изложеноста на кристален силициум диоксид, покрај ограничувањето на границата на изложеност.[18]
Remove ads
Кристални форми
SiO 2, повеќе од речиси секој материјал, постои во многу кристални форми. Овие форми се нарекуваат полиморфи.
Remove ads
Безбедност
Вдишувањето на ситно поделениот кристален силициум диоксид може да доведе до тешко воспаление на ткивото на белите дробови, силикоза, бронхитис, рак на белите дробови и системски автоимуни болести, како што се лупус и ревматоиден артритис. Вдишувањето на аморфен силициум диоксид, во високи дози, доведува до непостојано краткотрајно воспаление, каде што сите ефекти заздравуваат.[77]
- Мезопорозна силициум диоксид
- Ортосилинска киселина
- Силициум карбид
Remove ads
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


![{\displaystyle {\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {C} {}\mathrel {\longrightarrow } {}\mathrm {Si} {}+{}2\,\mathrm {CO} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1eb9e849d727fcb019f0416dac5f4f967695cdfa)
![{\displaystyle {\mathrm {SiCl} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}4\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/9cdc77ca718b1aa2fbff897b06de1b7c65933dfd)
![{\displaystyle {\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Si} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{7}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}3\,\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/9876f7b261a2fa2527cd3614cc6e1def21392eba)
![{\displaystyle {\mathrm {Si} {}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ac34960afdbf2b558f5883aed59bcbb109554f8f)
![{\displaystyle {\mathrm {Si} (\mathrm {OC} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}){\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {O} (\mathrm {C} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}){\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/61ac3ada0cf5464bd1fedd991049203bff127b6d)
![{\displaystyle {\mathrm {Si} (\mathrm {OC} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}){\vphantom {A}}_{\smash[{t}]{4}}{}+{}12\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}10\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}8\,\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ba7c3aa1a03f27f9c0ab03ba6ef0634e65a53183)
![{\displaystyle {\mathrm {Si} (\mathrm {OC} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{5}}){\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}4\,\mathrm {HOCH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/689234f18e8efa7949bbf19c6c6ee3606c021d56)
![{\displaystyle {\mathrm {SiH} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/03511df937a8f3cb258146f5786fb5fc970cf591)
![{\displaystyle {\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {NaOH} {}\mathrel {\longrightarrow } {}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/13151bda2abffbafaed6f97777a6e3386792a73b)
![{\displaystyle {2\,\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{4}}{;}{\mkern {3mu}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e600c070844b56007a9d7b66d1673a4b04ec0f6f)
![{\displaystyle {\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{3}}{;}{\mkern {3mu}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/c8b8d671c3d195db06e084ad8d1be41d2aaf9e21)

![{\displaystyle {\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {glass} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8c1456b3017f2ad302347f7bbb8f38d8d71c43bb)
![{\displaystyle {\mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {Si} {}\mathrel {\longrightarrow } {}2\,\mathrm {SiO} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3861d55180f8b84194f3494ea23652c10a0206ae)