热门问题
时间线
聊天
视角
2019冠狀病毒病疫苗
用來對抗SARS-CoV-2冠狀病毒的疫苗 来自维基百科,自由的百科全书
Remove ads
2019冠狀病毒病疫苗是旨在提供針對嚴重急性呼吸道症候群冠狀病毒2型(SARS-CoV-2)的獲得性免疫力的疫苗,該病毒是導致2019冠狀病毒病(COVID-19)的病毒。
在COVID-19大流行之前,關於引起嚴重急性呼吸系統症候群(SARS)和中東呼吸系統症候群(MERS)等疾病的冠狀病毒的結構和功能已經有了既定的知識體系。這些知識在2020年初加速了各種疫苗平台的開發。[1]SARS-CoV-2疫苗最初的重點是預防有症狀的、往往是嚴重的疾病。[2]2020年1月,SARS-CoV-2基因序列數據通過GISAID共享,到2020年3月,全球製藥業宣布了解決COVID-19的重大承諾。[3]2020年,第一批COVID-19疫苗被開發出來,並通過緊急授權[4]和有條件批准向公眾提供。[5][6]最初,大多數COVID-19疫苗是兩劑量的疫苗,唯一的例外是單劑量的嬌生2019冠狀病毒病疫苗。[4]然而,人們發現疫苗的免疫力會隨著時間的推移而減弱,需要人們接種加強劑量的疫苗以保持對COVID-19的免疫力。[4]
COVID-19疫苗在減少COVID-19的傳播和降低COVID-19造成的嚴重程度和死亡方面的作用被廣泛稱讚。[4][7]根據2022年6月的一項研究,從2020年12月8日至2021年12月8日,COVID-19疫苗在185個國家和地區額外防止了1440萬至1980萬例死亡。[8][9]許多國家實施了分階段分配計劃,優先考慮併發症風險最高的人群,如老年人,以及暴露和傳播風險高的人群,如醫護人員。[10][11]
Remove ads
疫苗概況

針對數種動物的冠狀病毒引發疾病的疫苗已經被研製,包括針對禽類傳染性支氣管炎病毒、犬冠狀病毒和貓冠狀病毒的疫苗[12]。
此前,針對可感染人類的冠狀病毒的疫苗的研製工作,主要是針對嚴重急性呼吸道症候群冠狀病毒(SARS)和中東呼吸症候群冠狀病毒(MERS)的疫苗,也有過一定進展。SARS和MERS的疫苗已經完成了動物試驗。[13][14]
截至2020年,還沒有針對SARS的對人類安全有效的治療性或保護性疫苗被研製出來[15][16]。根據2005年和2006年發表的論文,識別並研發治療SARS的新疫苗和藥物是當時世界各國政府和公共衛生機構的優先事項[17][18][19]。
同樣,目前暫時沒有針對MERS的經過試驗的疫苗[20]。當MERS正在流行時,人們認為當時已有的對SARS的研究可能為研發針對MERS的疫苗和藥物提供借鑑[15][21]。截至2020年3月,一種基於DNA的MERS疫苗已完成了人類的I期臨床試驗[22];另外三種基於病毒載體的MERS疫苗則正在進行臨床試驗,其中兩種是腺病毒載體疫苗(ChAdOx1-MERS、BVRS-GamVac),另一種則是改良牛痘病毒載體疫苗(MVA-MERS-S)[23]。
截至2021年2月,66種SARS-CoV-2候選疫苗正在進行臨床試驗,其中17種Ⅰ期臨床試驗,23種Ⅰ–Ⅱ期臨床試驗,6種Ⅱ期臨床試驗和20種Ⅲ期臨床試驗[24]。在Ⅲ期臨床試驗中,幾種COVID-19疫苗在預防症狀性COVID-19感染的效力高達95%[25]。目前有至少18種疫苗獲得至少一個政府醫藥監管機構的緊急批准:3種RNA疫苗(輝瑞-BioNTech疫苗、莫德納疫苗以及華森疫苗[26]),至少6種不活化疫苗(國藥北京生物眾愛可維、國藥武漢生物眾康可維、CoviVac、QazVac、巴拉特生物技術科瓦克辛(Covaxin)、科興疫苗以及深圳康泰疫苗[27]),4種病毒載體疫苗(「衛星V」、牛津-阿斯利康疫苗、康希諾疫苗、嬌生疫苗),以及5種蛋白質亞基疫苗(安徽智飛疫苗、EpiVacCorona、阿布達拉、高端疫苗[28]、諾瓦瓦克斯疫苗[29])。截至2022年5月19日,世界衛生組織把11款疫苗列入緊急使用清單[30]:輝瑞-BioNTech疫苗、牛津-阿斯利康疫苗及該疫苗的印度版(COVISHIELD)、嬌生疫苗、莫德納疫苗、眾愛可維(國藥北京生物)、科興生物(CoronaVac)、科瓦克辛(Covaxin)、諾瓦瓦克斯疫苗及該疫苗的印度版科沃瓦克斯(Covovax)、克威莎疫苗。[31][32][33][34] 接種COVID-19疫苗可以大大降低SARS-CoV-2傳播、感染和死亡風險。[35]
許多國家已經實施了分階段的分配計劃,優先考慮併發症風險最高的人群(例如老年人)和暴露、傳播風險較高的人群(例如醫護人員)[36]。根據國家衛生機構的官方報告,截至2021年1月8日,全球已施用1770萬劑COVID-19疫苗[37]。國藥集團估計在2021年將生產30億劑疫苗[38],阿斯利康製藥預測將生產30億劑,輝瑞公司將生產20億劑,而莫德納公司計劃將生產7-10億劑[39]。印度估計在2021年能生產35億劑新冠疫苗[40]。到2020年12月,各國已預訂購了超過100億劑疫苗[41];大約一半的疫苗由高收入國家購買,而這些國家人口僅占世界人口的14%[42]。目前,各國也在加速生產疫苗,推進群眾大力接種疫苗,疫苗接種人次在逐步上升。為使疫苗在全球普及應用,世衛牽頭的COVAX確保開發中國家及低收入國家都可獲取基本的疫苗供應[43]。
Remove ads
背景與時間線
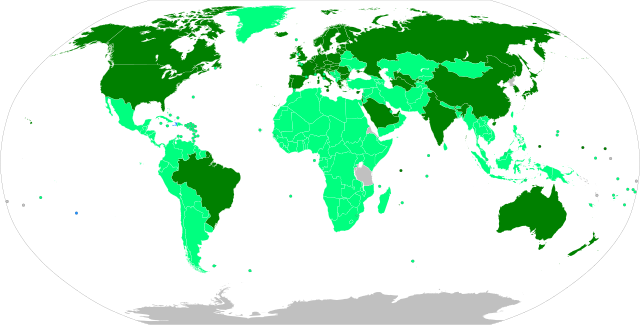
全面授權,正在進行大規模疫苗接種
緊急使用授權,正在進行大規模疫苗接種
緊急使用授權,有限的疫苗接種
全面授權,計劃大規模疫苗接種
緊急使用授權,計劃大規模疫苗接種
有待緊急使用授權
沒有數據
2019年12月1日,由SARS-CoV-2引起的一種疾病在中華人民共和國湖北省武漢市發現,早期當局隱瞞、拖延、掩蓋疫情一個月左右,並通過中國春運擴散到全中國,後於世界範圍內首次被發現,隨後通報國際社會,全球各國陸續檢測發現此病傳播已久,後來該疾病被命名為2019冠狀病毒病[44]。2020年,該疾病導致的2019冠狀病毒病疫情在世界各地蔓延,因應這場人類公共衛生史上百年一遇的大瘟疫,使得前所未有的大量資金和人力被用於研發針對該疾病的疫苗[45]。許多組織正在利用已經公開的基因序列研發SARS-CoV-2疫苗[46][47][48]。[何時?]大約有35家企業和學術機構參與到這一進程之中[49],其中3家,包括莫德納[50]、Inovio Pharmaceuticals及昆士蘭大學,得到了流行病防備創新聯盟(CEPI)的支持[51]。根據2020年3月10日的一份報告,當時全世界有約300項正在進行的前期研究[52]。
2020年3月,美國政府、醫療行業和大學向研究人員提供了訪問IBM的超級計算機以及亞馬遜、微軟和谷歌的雲計算資源的權限。這些計算資源的提供者成立了2019冠狀病毒病高性能計算聯盟,其正被用於預測疾病傳播、模擬可能的疫苗以及篩選數千種化合物以設計針對2019冠狀病毒病的疫苗或治療方案[53]。
2020年3月上旬,CEPI公布了20億美元的籌資目標,以建立一個涵蓋公共組織、私人組織、慈善組織和民間社會組織的全球合作夥伴關係,以加速2019冠狀病毒病疫苗的研發。丹麥、芬蘭、德國、挪威和英國政府承諾支持CEPI為研發2019冠狀病毒病疫苗所做的努力[54]。
2020年5月18日,中華人民共和國領導人習近平應世界衛生組織總幹事譚德塞邀請,在第73屆世界衛生大會視頻會議開幕式上發表《團結合作戰勝疫情 共同構建人類衛生健康共同體》的致辭,其中提到「中國新冠疫苗研發完成並投入使用後,將作為全球公共產品」[55]。
2020年6月4日,中華人民共和國國務院總理李克強在全球疫苗峰會視像會議致辭,表示中國將繼續支持世界衛生組織在統籌疫苗研發等方面發揮作用,亦願意為全球疫苗免疫聯盟提供捐助[56]。8月24日,李克強在湄公河合作第三次領導人會議上發言,稱中國的疫苗研製完成並投入使用後,將優先向湄公河國家提供[57]。
2020年8月11日,俄羅斯總統普丁宣布,俄羅斯完成全球第一款COVID-19疫苗[58]。但俄羅斯尚未公布候選疫苗的第Ⅰ期或第Ⅱ期臨床試驗結果,候選疫苗也尚未進入第Ⅲ期臨床試驗[59]。
2020年10月,世界衛生組織牽頭實施COVAX項目,旨在於2021年底前購入20億支COVID-19疫苗[60],並優先向開發中國家提供[61][62]。
2020年11月9日,澳洲開始生產由阿斯利康研發的2019冠狀病毒病疫苗[63]。同日,輝瑞公司及其合作夥伴BioNTech SE(BNTX)宣布所開發的疫苗有效性超過90%[64]。11月11日,俄羅斯宣布該國研發的Sputnik V疫苗有效性達到92%[65]。11月16日,莫德納宣布該公司研發的疫苗有效性達94.5%[66]。阿斯利康瓦爾牛津大學宣布兩家機構聯合研發的AZD1222疫苗有效性可達90%[67]。
2020年11月,世界衛生組織表示,全球有213種COVID-19疫苗正在被研發,其中49種疫苗進入臨床試驗階段[68]。
2020年12月2日,英國藥品及保健品管理局批准緊急使用輝瑞製藥與BioNTech合作研發的BNT162b2疫苗[69],並於12月9日展開全民接種計劃[70]。日本參議院全體會議於12月2日一致表決通過修改後的《預防接種法》,內容包括由國家承擔日本民眾接種COVID-19疫苗的費用[71]。
12月7日,中華人民共和國澳門特別行政區應變協調中心強調,特區政府預計於年底引進首批疫苗。[72]同月,中華人民共和國四川已經針對12類高風險人員開展了COVID-19疫苗緊急接種。[73]同月,莫斯科70多個站點啟動COVID-19疫苗接種工作,自願申請接種的醫護人員、教師等高風險感染人群將優先接種該疫苗,優先接種人群為醫護人員、教師等高風險感染人群。[74]4日,蕪湖開展冬春季COVID-19疫苗摸底,這次摸底是為統籌做好該市COVID-19疫苗、流感、肺炎鏈球菌肺炎等疫苗接種,建立落實多病共防機制的前期工作。[75]
2020年12月11日,美國食品藥物管理局宣布批准緊急使用輝瑞製藥與BioNTech合作研發的BNT162b2疫苗[76][77]。同月,世界衛生組織表示,雖然一些COVID-19疫苗已陸續推出並開始接種,但目前仍不清楚疫苗是否能防止人體感染SARS-CoV-2。[78]
2020年12月31日,世界衛生組織率先核准使用輝瑞製藥與BioNTech合作研發的輝瑞-BioNTech 2019冠狀病毒病疫苗[79]。同日,中華人民共和國國務院召開的疫情防控記者會上宣布,國藥集團生物新冠不活化疫苗已獲中華人民共和國國家藥監局批准附條件上市[80]。
2021年1月11日,世衛組織宣布,已有40多個國家開始接種COVID-19疫苗。[81]
2021年1月30日,嬌生公司宣佈研發的疫苗的單劑有效率為66%[82][83]。
2021年2月3日,中華人民共和國外交部發言人汪文斌宣布,中國正式加入COVAX計劃,將提供1000萬劑疫苗用於開發中國家急需[84]。
2021年2月5日,世界衛生組織總幹事譚德塞表示,全球新冠疫苗接種數量已經超過了報告的感染病例總數[85]。
2021年2月15日,世界衛生組織批准緊急使用阿斯特捷利康與牛津大學共同研發的牛津-阿斯利康2019冠狀病毒病疫苗[86][87]。
2021年2月24日,由印度血清研究所生產的60萬劑阿斯利康疫苗運抵加納首都阿克拉,加納因而成為世界衛生組織疫苗分配計劃(COVAX)的首個受益國[88]。
2021年3月8日,芬蘭研究人員研發出一款鼻噴式2019冠狀病毒病疫苗,計劃幾個月內開展臨床試驗[89]。
2021年3月12日,嬌生公司研發的嬌生2019冠狀病毒病疫苗獲得歐盟和世衛組織發出緊急使用許可[90]。這是世衛組織和歐盟首次批准使用單次接種的新冠疫苗[91]。
2021年3月31日,俄羅斯註冊了全球首個用於動物的新冠疫苗[92]。
2021年4月30日,美國莫德納公司研發的莫德納疫苗獲得世界衛生組織核准緊急使用授權,是世衛組織第五種列入緊急使用清單的新型冠狀病毒疫苗[93]。
2021年5月5日,美國政府宣布總統拜登同意臨時豁免新型冠狀病毒疫苗的專利保護,以促進疫苗的全球供應,世衛組織發言人讚揚是「里程碑時刻」,世衛組織總幹事譚德塞在推特稱美國的行動是「應對全球衛生挑戰的強有力的領導範例」[94]。
2021年5月7日,中國國藥集團研發生產的BBIBP-CorV獲得世界衛生組織核准緊急使用授權,是世界衛生組織第六種列入緊急使用清單的新型冠狀病毒疫苗。[95][96]
2021年5月14日,深圳康泰生物宣布公司研發的新型冠狀病毒不活化疫苗已獲批在中國緊急使用,已啟動開展疫苗III期臨床試驗相關工作。[97]
2021年6月1日,中國科興生物研發生產的克爾來福疫苗獲得世界衛生組織核准緊急使用授權,是世界衛生組織第七種列入緊急使用清單的新型冠狀病毒疫苗。[98][99]
2021年6月28日,輝瑞旗下動物藥廠碩騰捐贈第一批試驗性質動物用COVID-19疫苗給美國加州奧克蘭動物園,老虎、熊、美洲獅和雪貂為第一批接種對象,該園之後也會為靈長類、果蝠和豬等動物注射疫苗[100]。
2021年7月26日,由中國工程院院士、軍事科學院軍事醫學研究院研究員陳薇領銜團隊所研發的霧化吸入用重組新冠疫苗(腺病毒載體)在《刺胳針·傳染病》發表I期臨床研究數據。這是全球首個發表的新冠疫苗黏膜免疫臨床試驗結果[101]。
2021年10月11日,世衛組織疫苗顧問小組表示完成注射兩劑中國科興克爾來福或國藥眾愛可維疫苗的60歲或以上長者、中度至嚴重免疫力低下的族群,仍然有很高的受感染及演變為重症的風險,建議為這類族群在完成接種第二劑科興或國藥疫苗後的一至三個月,再追加多一劑世衛組織列入緊急使用的疫苗作為加強劑,這是世衛組織首次建議打第三針疫苗[102]。
截至2021年10月末,全球已接種了超過70億劑疫苗,其中阿聯及中國的接種率已超過八成,智利及柬埔寨的接種也接近八成水平。非洲國家均在20%以下,其中南非的接種率最高,為19%,坦尚尼亞、奈及利亞及衣索比亞只有1%的人口接種疫苗。[103]
2021年11月3日,印度研發的科瓦克辛疫苗獲世衛組織批核緊急使用授權,在完成兩劑接種兩個月後的有效率為78%[104]。
2021年11月12日,康希諾研發的全球首款吸入式腺病毒載體新冠疫苗克威莎亮相第五屆海南國際健康產業博覽會[105]。
2021年12月17日,由美國諾瓦瓦克斯醫藥開發後授權印度血清研究所生產的科沃瓦克斯獲世衛組織發出緊急使用授權[106]。
2021年12月21日,世衛組織向美國諾瓦瓦克斯醫藥原廠發出諾瓦瓦克斯2019冠狀病毒病疫苗的緊急使用授權[107]。
2022年1月25日,輝瑞和德國生物新技術公司宣布正式啟動針對變異新冠病毒奧密克戎毒株的疫苗臨床試驗。[108]
2022年4月3日,國藥集團中國生物二代重組蛋白新冠疫苗獲得國家藥品監督管理局頒發的臨床試驗批准文件。[109]
2022年5月20日,世界衛生組織對中國製造商康希諾生物研發的單劑型COVID-19疫苗克威莎核發緊急使用授權。
2022年6月30日,台灣高端生物製劑表示旗下高端新冠肺炎疫苗正參與世界衛生組織主導的團結實驗[110],並將在結果公布後向世衛組織申請核發緊急使用授權[111]。
2022年9月4日,康希諾發布公告,表示自己研發的全球首個吸入用新冠疫苗克威莎霧優在中國獲批緊急使用[112][113]。
2022年9月初,多國相繼批准針對奧密克戎BA.1或BA.4/5的新冠二價疫苗。[114]
2023年1月,康希諾開始試生產一款尚處於臨床試驗階段的疫苗,這款疫苗也是中國使用mRNA技術研發的首批疫苗之一[115]。
2023年1月19日,國藥集團中國生物復諾健生物科技針對奧密克戎變異株研發的新冠mRNA疫苗獲得國家藥品監督管理局臨床試驗批件。[116]
2024年1月10日,北京科興中維生物技術公司確認,科興生物「克爾來福」疫苗已經停產,病毒學家常榮山曾經建議不要打不活化疫苗,並說病毒流行株的抗原性變化較大,最好打mRNA疫苗、重組蛋白疫苗[117]。中國生物製藥在2024年1月15日透露,通過投資科興中維,從中收到接近60億元人民幣的分紅,當時疫苗存貨仍有大約4億支[118]。
Remove ads
疫苗列表

- 科興生物研發了一種名為克爾來福的不活化疫苗,並對743名志願者進行了Ⅰ/Ⅱ期臨床試驗,結果顯示沒有嚴重的不良反應。2020年7月,科興生物在巴西啟動了一項Ⅲ期臨床試驗,隨後於8月在印度尼西亞和9月在土耳其開啟Ⅲ期臨床試驗[119][120]。12月25日,土耳其的研究人員宣布該疫苗的有效率為91.25%。 儘管有7371名志願者參與了土耳其的試驗,有效率數據僅基於752名接受了疫苗的志願者和570名接受了安慰劑的志願者[121]。2021年1月12日,聖保羅布坦坦研究所宣布該疫苗在巴西Ⅲ期臨床試驗的有效率為50.38%[122]。4月11日,布坦坦研究所公布了該疫苗在巴西的Ⅲ期臨床試驗的最終結果,並將該疫苗的有效率修正為50.7%。[123]
- 巴拉特生技的不活化疫苗BBV152(又稱Covaxin)於2020年6月開始臨床試驗,成為首款進入臨床試驗的印度研製新冠候選疫苗[124]。10月23日,巴拉特生技宣布開啟Ⅲ期臨床試驗,將在印度25個地點招募26,000名志願者參與[125]。2021年1月3日,印度政府授予BBV152緊急使用授權[126]。巴拉特生技於3月3日宣布Ⅲ期臨床試驗中期分析結果顯示該疫苗的有效率為81%[127],並於4月21日宣布第二次中期分析結果,將該疫苗的有效率從81%修正為78%[128]。
- 哈薩克生物安全問題研究所研發的不活化疫苗QazVac於2020年9月開啟Ⅰ期臨床試驗,有44名志願者參與[129]。12月,Ⅲ期臨床試驗在哈薩克國內開始,3000名志願者參與[130]。哈薩克於2021年4月下旬開始向公眾接種疫苗[131]。
- 中國人民解放軍軍事科學院軍事醫學研究院陳薇院士領銜與天津疫苗公司康希諾生物聯合研發的一種基於重組腺病毒疫苗的,名為Ad5-nCoV的候選疫苗的I期臨床試驗於2020年3月開始在武漢招募108名健康成年人,而試驗數據的收集工作則計劃持續到2020年底[132][133][134]。2021年2月21日,康希諾生物向中國國家藥監局提交附條件上市申請[135],2月25日獲國家藥監局附條件批准註冊申請[136]。康希諾生物表示其一劑疫苗在接種後28天的有效率為65.28%[137]。
- 俄羅斯加馬列亞流行病與微生物學國家研究中心研發的一種基於5型、26型腺病毒名為Gam-Covid-Vac的新冠疫苗。研究人員於2020年6月開啟臨床試驗。8月11日,總統普丁宣布俄羅斯監管機構已批准該疫苗,並將其商品名命名為「衛星V」[138]。2021年2月2日,研究人員在《刺胳針》上發表了Ⅲ期臨床試驗數據,顯示疫苗的效力為91.6%[139]。
- 美國嬌生公司的26型腺病毒載體疫苗Ad26.COV2.S於2020年7月開啟Ⅰ/Ⅱ期臨床試驗。9月,嬌生公司開始Ⅲ期臨床試驗,但因一名志願者出現不良反應,試驗於10月12日暫停。試驗在11天後恢復[140]。2021年2月24日,美國食品藥品監督管理局發表了對試驗的分析,總結該疫苗在美國的有效性為72%,在南非為64%,在拉丁美洲為61%[141]。
- 安徽智飛龍科馬生物製藥與中國科學院微生物研究所合作研發了一種蛋白質亞基疫苗。Ⅱ期臨床試驗於2020年7月啟動。12月,Ⅲ期臨床試驗啟動,該項試驗將招募29000名志願者[142]。
- 古巴芬萊疫苗研究所開發了一種名為「主權2號」的三劑疫苗。芬萊研究人員於2020年10月開始Ⅰ期臨床試驗,隨後於12月進行了Ⅱ期臨床試驗。2021年3月3日,芬萊疫苗研究所註冊了「主權2號」的Ⅲ期臨床試驗[143]。6月19日,古巴生技製藥表示,該疫苗接種第二劑後的有效率為62%[144]。
- 美國國家過敏和傳染病研究所(NIAID)與莫德納合作開發了一種RNA疫苗,該疫苗產生的蛋白質與冠狀病毒表面的突觸相匹配,因此該疫苗不含有冠狀病毒或者其他類別的病毒[46]。NIAID登記了這種名為mRNA-1273的候選疫苗的一項Ⅰ期臨床試驗,其志願者為來自西雅圖的45名健康成年人[145],而其招募工作則於2020年3月19日完成[146]。位於喬治亞州亞特蘭大市的埃默里大學則於4月啟動另一項Ⅰ期臨床試驗[147]。Ⅲ期臨床試驗於7月27日開始,這項試驗將在美國約89個地點招募30,000名志願者[148]。11月16日,莫德納宣布了該試驗的第一批初步數據,試驗志願者中一共有196例COVID-19病例,其中185例為接受了安慰劑的志願者,11例為接受了疫苗的志願者。研究人員估計該疫苗的效力為94.5%,遠高於疫苗測試開始時專家的預測[149]。2021年4月13日,莫德納宣布Ⅲ期臨床試驗的最新數據顯示該疫苗的有效率為>90%和重症病例的有效率為>95%[150]。
Remove ads
此章節需要擴充。 |
- 國藥集團中國生物研究院重組新冠病毒疫苗於2021年4月9日獲得國家藥品監督管理局臨床試驗批件[343]。
Remove ads
- 澳洲昆士蘭大學和傑特公司聯合研發的蛋白質亞基COVID-19疫苗於2020年7月啟動,但部分受試者在第I期臨床試驗中出現愛滋病病毒檢測假陽性結果[392]。12月11日,澳洲總理史考特·莫里森宣佈放棄研製該款疫苗[393]。
- 美國默克公司於2020年6月收購奧地利公司Themis Bioscience以研發其疫苗TMV-083。該疫苗最初由巴斯德研究院研發,它使用了一種攜帶新冠病毒刺突蛋白基因的弱化麻疹病毒。研究人員於8月在法國和比利時啟動了Ⅰ期臨床試驗[394]。2021年1月25日,默克公司宣布放棄研發TMV-083,因為該疫苗引起的免疫反應比自然感染弱[395]。
- 默克公司與IAVI合作開發了第二種病毒載體疫苗V590。該疫苗水使用疱性口炎病毒載體,與默克公司生產的伊波拉疫苗的方法相同。默克公司和IAVI於2020年9月30日註冊位於美國的Ⅰ期臨床試驗[396]。但因該疫苗未能觸發與新冠病毒自然感染相似的免疫反應,2021年1月25日,默克公司宣布放棄研發V590[395]。
- 倫敦帝國學院於2021年1月26日宣布放棄對其RNA候選疫苗進行大規模臨床試驗的計劃。研究團隊將專注於研發新冠病毒變體的候選疫苗[397]。
- 美國馬里蘭州生物製藥公司Altimmune研發了一種基於5型腺病毒,名為AdCOVID的鼻噴霧疫苗。2020年12月22日,Altimmune註冊了其疫苗的Ⅰ期臨床試驗[398]。但Altimmune於2021年6月29日宣布將放棄研發該疫苗。Ⅰ期臨床試驗數據表明接受疫苗的80名志願者產生的免疫反應比預期低[399]。
- 台灣浩鼎生技股份有限公司董事會於2023年12月20日宣布,停止開發BCVax產品研發專案。[400]
Remove ads
正在研發的疫苗可能不安全或無效[401]。一項研究表明,在2006年至2015年之間,疫苗等生物製劑連續獲得I期至III期臨床試驗批准的成功率為11.5%[402]。
2020年9月8日,阿斯利康表示,由於英國一項研究中的一名對象出現貫穿性脊髓炎,該公司暫停了COVID-19疫苗的臨床試驗[395]。阿斯利康在一周內已恢復了全球的臨床試驗,美國在10月23日恢復試驗[403][404]。
2020年10月21日,巴西衛生部門表示,有一名巴西志願者在接種阿斯利康研發的疫苗後死亡[405]。10月29日,由聖保羅布坦坦研究所與中國大陸科興生物技術公司共同研發的COVID-19疫苗在巴西再度出現「嚴重副作用」。11月9日,聖保羅布坦坦研究所與科興生物技術公司共同研發的COVID-19疫苗暫停臨床試驗[406]。不過11月10日,巴西衛生部門表示志願者死亡原因為自殺,故於11月11日恢復科興生物科技的疫苗試驗[407]。
2020年12月11日,秘魯通報一名接受中國國藥疫苗的受試者接種疫苗後出現神經問題,秘魯當局決定暫停中國國藥疫苗的實驗[408]。12月16日,實驗恢復[409]。
Remove ads
疫苗效力
雖然目前的科學共識是2019冠狀病毒病疫苗可以有效的保護接種者免於患病、患重症或死亡[421],惟一項於2021年10月下旬發表在《刺胳針》上的研究指出,接種了兩針新冠疫苗的人依然會感染新冠病毒並將病毒傳染給共同居住的人,且打過兩針疫苗的人傳染性和沒打過疫苗的人一樣強[422][423][424]。
Remove ads
接種計劃
隨著疫苗研發的進展,中國大陸、美國和歐洲多國等計劃2020年10月至2021年1月期間開始允許分發和接種疫苗。[425]

2020年6月24日,國務院批准《新冠病毒疫苗緊急使用(試用)方案》,7月22日正式啟動新冠疫苗的緊急使用。[426]
2021年1月9日,國務院聯防聯控機制新聞發布會中,國家衛健委副主任曾益新明確,疫苗和接種服務的全部費用將由醫保基金和財政共同負擔,居民個人不負擔費用[427]。
2021年3月29日,國家衛健委發布了《新冠病毒疫苗接種技術指南(第一版)》。[428]
截至2021年6月24日,中國大陸共有7款疫苗批准附條件上市或緊急使用[429][97],累計報告接種新冠病毒疫苗超過11億劑次[430]。
2024年7月15日起,新冠疫苗免費接種將調整為自費接種,醫保基金將停止支付新冠疫苗及接種費用,各級財政機構也不再提供相關補助[431]。
2020年12月23日,香港特區政府刊憲,訂立《預防及控制疾病(使用疫苗)規例》(第599K章)(《規例》),在公共衛生緊急狀態下提供法律框架,引入符合安全、效能及質素要求的2019冠狀病毒病疫苗作緊急使用,《規例》的有效期至2021年12月23日。[432]
2021年2月22日,林鄭月娥聯同多名司局長在設於香港中央圖書館展覽館的社區疫苗接種中心接種科興疫苗[433]。2月26日,香港正式啟動疫苗接種計畫[434]。至2021年6月2日為止,共有兩款疫苗在香港獲得緊急使用批核(EUA),分別是克爾來福及復必泰疫苗,於2021年2月中旬起先後交付並投入使用;約有141萬名香港居民已接受至少一劑疫苗和約有104萬名香港居民已接受第二劑疫苗[435]。
香港至2021年4月中下旬施打了130萬劑疫苗,當中20多人在注射疫苗後死亡[436]。截至2021年5月23日有68人在接種疫苗後於醫院病房或急診室死亡,另有19名孕婦接種疫苗後流產[437]。新冠疫苗臨床事件評估專家委員會目前認為沒有死亡個案與疫苗有因果關係[438]。香港特區政府從6月1日起不再公佈注射疫苗後的死亡事故,改為每隔兩星期在網上簡報,並且排除官方認為不相關的個案[439]。
2020年12月7日,澳門正就訂購COVID-19疫苗積極與供應商聯繫,未來澳門市民接種疫苗屬自願性質,且為免費接種,接種計劃位將會讓高危人群或有特別需要的人士優先接種。[72]14日,澳門特區政府公布COVID-19疫苗的接種安排,將以自願為原則,為高暴露人群或有特別需要的人士等三類人員優先接種。[440]
2021年2月1日,澳門政府宣布,第一批由國藥集團生產的10萬劑不活化疫苗,將於2月5日運抵澳門,預計將在農曆新年前後優先安排包括醫護人員、各口岸前線人員、賭場莊荷、教學人員、司機或急需往外地的人士接種。而復星醫藥同德國BioNTech合資的10萬劑疫苗,則預計在2月26日前運抵澳門。而阿斯利康的疫苗則預計最快2021年第3季才會抵達澳門[441]。2月6日,首批由國藥集團生產的10萬劑不活化疫苗運抵澳門,於9日早上安排接種儀式,澳門行政長官賀一誠率領大部分主要官員在接種儀式上即時接種疫苗[442][443]。
2021年2月8日,澳門新型冠狀病毒感染應變協調中心表示,第一階段優先接種疫苗的人群,包括前線抗疫人員、高職業暴露人群及需要前往流行地區的人士,即日可開始預約,並於2月9日9時開始接種;第二階段開放予其他居民接種,2月9日中午12時起可以預約,於2月22日後接種,有需要協助預約人士,可到社工局轄下8個站點由工作人員提供協助[444]。為了向新冠病毒疫苗接種人士提供額外的保障,政府已選出一家保險公司就接種疫苗的不良反應或副作用而出現不良後果之情況,提供投保年期為1年的團體保險服務;被保人為任何按衛生局指引接種疫苗的人士,年齡由16至85歲(不論性別和健康狀況)[445]。

2020年12月30日,中央流行疫情指揮中心公布台灣疫苗獲得進展。指揮中心已洽購疫苗總計近2,000萬劑,包含COVAX採購平台約476萬劑、阿斯特捷利康1,000萬劑及另一家洽談中約500萬劑疫苗。指揮中心指揮官暨衛生福利部部長陳時中表示,上述疫苗最快2021年3月可供貨,到第3季以前近八成可進口到台灣[446]。另外,有台灣民間人士表示,建議由民間單位引進中國大陸的疫苗,但指揮中心指揮官多次表示不會引進和使用中國大陸疫苗。對此,中國大陸國台辦發言人朱鳳蓮表示,此問題存在障礙,主要是政治障礙。陳時中表示,依據《臺灣地區與大陸地區貿易許可辦法》及經濟部國貿局公告之《大陸物品不准許輸入項目彙總表》,台灣一直沒有開放中國大陸生產的血清、血液製劑和疫苗進口,並不是因為此次疫情,而是長期以來對中國大陸的製程有疑慮,加上中國大陸過去有許多疫苗曾出現問題,因此一直沒有開放中國大陸疫苗進口[447][448]。
2021年2月3日,有網絡傳出流行疫情指揮中心另與嬌生、默克、諾瓦瓦克斯接洽疫苗採購事宜。指揮官陳時中證實,進入二、三期臨床試驗疫苗廠,指揮中心陸續都有去接洽,除採購外也談相關研究合作,盼謀得雙方利益[449]。
2021年2月10日,莫德納宣布已和政府簽署疫苗供應協議,將提供500萬劑疫苗[450]。5月28日,首批莫德納疫苗由中華航空貨機從盧森堡啟運,中停杜拜後抵達台灣[451]。
2021年3月3日,首批AZ疫苗從韓國以大韓航空班機運抵台灣,經檢驗與封緘後於同月22日起分配到全台57家醫院開打,行政院院長蘇貞昌及陳時中帶頭接種,上午7時40分在台大醫院施打疫苗[452]。
2021年6月4日,日本宣布向台灣提供124萬劑英國阿斯利康公司AZ疫苗,當天這批疫苗送抵台灣。[453]6月19日,美國無償捐贈台灣250萬劑美國生產的莫德納疫苗[454],這250萬劑疫苗於6月20日下午運抵台灣[455]。除了美日兩國,立陶宛、捷克、斯洛伐克及波蘭也陸續捐贈疫苗給台灣。
2021年7月11日,上海復星宣佈旗下子公司復星實業與鴻海精密、永齡基金會、台積電及裕利醫藥簽訂銷售協議,將銷售1000萬劑BNT疫苗[456][457]。鴻海精密與台積電於隔日(12日)在台灣證券交易所發佈重大訊息證實[458][459]。7月21日,慈濟基金會宣佈與復星實業完成500萬劑BNT疫苗採購及捐贈合約簽訂[460]。同年9月2日,第一批93.2萬劑BNT疫苗由盧森堡國際貨運航空的CV7962班次貨機運抵台灣桃園國際機場[461],將會先供12歲至17歲的學生及18歲至22歲的青年施打[462]。
2022年4月17日,衛生福利部食品藥物管理署召開專家會議,因應新型冠狀病毒疾病疫情(COVID-19)防疫需求,核准莫德納疫苗用於6至11歲兒童接種[463]。莫德納疫苗作為兒童疫苗用法用量為施打兩劑,每劑0.25毫升(含50微克的mRNA,為成人劑量的一半)[464]。兩劑施打間隔12週[465]。預計2022年5月2日開始施打[466]。
2022年4月28日,衛生福利部食品藥物管理署召開專家會議,通過輝瑞BNT兒童疫苗於5歲至11歲兒童使用,2劑至少間隔21天,但預計以上次ACIP專家建議的12週為實際接種間隔的原則。也宣布將採購220萬劑輝瑞BNT兒童疫苗,預計5月中旬前會到貨。劑量為0.2毫升、含有10微克mRNA,完整接種為2劑、至少間隔21天;針對嚴重免疫功能不全兒童至少間隔28天,且可以接種第3劑[467]。目前有次世代疫苗,是針對BA.5,但是高端報廢率高,所以這次不訂高端疫苗。」

2020年11月20日,輝瑞和BioNTech向美國食品藥品監督管理局(FDA)提交了其COVID-19候選疫苗BNT162b2的緊急使用授權(EUA)申請,而BNT162b2於12月11日獲得FDA緊急使用授權。[468][469]12月14日,醫護人員和長期護理機構居住者開始接種該疫苗。[470]當選總統喬·拜登於12月21日在電視直播中接種了他的第一劑輝瑞疫苗。[471]
11月30日,莫德納向FDA申請候選疫苗mRNA-1273的緊急使用授權。[395]莫德納疫苗於12月18日獲得FDA緊急使用授權,並於12月21日開始接種。[472][473]美國疾病預防控制中心表示,自2020年12月21日至2021年1月10日期間,美國共完成400多萬劑莫德納疫苗的注射,其中只有10人出現嚴重過敏反應[474]。
2021年2月4日,嬌生公司向FDA申請其COVID-19候選疫苗的緊急使用授權。[475]FDA於2月27日批准該授權的申請。嬌生公司已承諾在6月底前向美國提供1億劑疫苗。[476]
川普政府的目標是在2021年12月底前至少讓2000萬人接種第一劑疫苗,但截止12月31日,美國只有280萬人接種第一劑輝瑞或莫德納疫苗。[477]12月,當選總統拜登承諾在上任後100天時完成1億劑新冠疫苗的注射。[478]2021年1月25日,拜登政府宣布每日完成150萬劑疫苗注射的目標。[479]3月9日,阿拉斯加州成為美國首個向16歲或以上人群開放COVID-19疫苗接種的州[480]。3月11日,拜登總統表示他將指示各州、原住民保留地和領地在5月1日之前向所有美國成年人開放COVID-19疫苗接種[481]。截至4月19日,美國一半成年國民已經至少接種了一劑新冠疫苗[482]。
2020年12月2日,英國批准使用輝瑞疫苗[483]。12月8日,英國開始大規模接種疫苗,成為全球首個大規模接種2019冠狀病毒病疫苗的國家。[484][485]不過在疫苗接種第一天,有兩人報告出現不良反應。英國藥品監管機構建議有嚴重過敏史的人不要接種疫苗[486]。12月31日,英國批准了由牛津大學和阿斯利康聯合研發的COVID-19疫苗緊急使用[487]。2021年1月8日,英國允許莫德納研發的COVID-19疫苗在英國使用[488]。1月9日,英國女王伊莉莎白二世與丈夫菲利普親王完成疫苗接種[489]。截至2月14日,英國有約22%的人口注射了第一劑疫苗[490]。截至3月24日,英國民眾已接種1800萬劑阿斯利康新冠疫苗,當中30人出現血栓症狀,有7人死亡[491]。
2020年8月,俄羅斯衛星V(Sputnik V)註冊,為全球首款註冊的COVID-19疫苗[492]。12月5日,俄羅斯莫斯科啟動COVID-19疫苗接種工作,教師等高風險人群優先接種。[74]12月27日,克里姆林宮發言人稱俄國總統普丁將接種衛星V疫苗[493]。至2021年1月2日的統計,俄羅斯已有80萬人接種衛星V疫苗[494]。
2021年5月6日,單劑2019冠狀病毒病疫苗「衛星-Light」在俄羅斯批准[495]。
2021年11月初,俄羅斯聖彼得堡當局強制60歲以上和慢性病患者接種2019冠狀病毒病疫苗。[496]截至當時,俄羅斯全國有4成人左右接種疫苗。[497]
印度於2021年1月16日推出第一階段疫苗接種計劃,計劃對象為國內一千萬名醫護人員和二千萬名前線人員(警察、市政人員等)接種疫苗[498],接種者無法選擇接種的疫苗種類[499]。3月1日開始第二階接種計劃,對象擴大到60歲以上及45歲以上患有心臟病、糖尿病等長期病患人士,覆蓋全國2.7億人[499]。疫苗在公立醫院免費提供,全國一萬家私立醫院發售,價格固定為250盧布。這個階段六百六萬醫護人員注射第一劑疫苗,二百四十萬人注射了兩劑疫苗,前線人員只有五百一十萬接種了疫苗[500]。第二階接種計劃開始,申請接種疫苗的人需要在網站CoWIN上注冊[501]。3月24日,印度衛生部記錄顯示全國有超過五千萬人接種了疫苗[498]。5月1日開始第三階接種計劃,對象擴大到18歲到45歲人士。印度部分邦因為疫苗供應不足等問題,無法實施計劃[502]。計劃展開一周,疫苗接種數量下降到八周以來最低。除了疫苗生產和運輸問題,疫苗接種登記網站CoWIN的設計問題被認為是原因之一。印度電信管理局數據顯示印度只有58%人口能使用網絡,CoWIN目前只能提供英文,而印度只有10%的人口懂得說英文[503]。6月21日起,印度成年人可以免費接種疫苗[504]。截至10月21日,印度累計接種新冠疫苗10億劑次。[505]
2020年10月底,阿聯和巴林批准對中國國藥的兩款COVID-19疫苗進行緊急使用[506]。12月4日,巴林批准使用輝瑞的COVID-19疫苗[507]。12月9日,阿聯正式批准中國國藥的COVID-19疫苗上市[508]。
2020年12月,哈薩克衛生部表示,俄制「衛星V」疫苗預計將在明年2月11日前在哈薩克完成註冊。[509]
2021年1月3日,印度藥品管理總局批准緊急使用兩種COVID-19疫苗的授權申請[510]。
2021年1月3日,泰國政府已與中國大陸科興控股生物技術有限公司簽署COVID-19疫苗訂購協議,採購200萬劑COVID-19疫苗。[511]2021年1月6日,泰國總理巴育·占奧差在個人社交媒體上宣布,年內為全國至少半數民眾免費接種疫苗[512]。
2021年1月11日,韓國總統文在寅表示自2月起,韓國公民可免費接種疫苗[513]。2月26日,韓國開啟疫苗接種[514]。
2021年1月4日,日本首相菅義偉4日在記者會上宣布,將在2月下旬之前啟動COVID-19疫苗接種。他表示自己有意率先接種。[515]2月17日,日本啟動新冠疫苗接種工作[516]。
2021年1月13日,約旦啟動接種國藥集團研發的COVID-19疫苗計劃[194];印尼總統佐科·維多多通過電視直播接種科興生物研發的疫苗[517];土耳其緊急批准科興生物研發的疫苗[518];亞塞拜然的民眾開始大規模接種科興公司生產的COVID-19疫苗[519]。
2021年1月19日,新加坡的民眾開始進行大規模冠狀病毒疫苗接種工作[520]。
2021年2月1日,巴基斯坦正式接受中國政府首批對外援助的新冠疫苗。2月3日,巴基斯坦全國範圍內的疫苗接種開始進行。[521]2021年4月9日,巴基斯坦授權緊急使用中國科興新冠疫苗。[522]據印度亞洲國際新聞社(ANI)報道,在中國康希諾生物公司的幫助下,巴基斯坦國立衛生研究院(NIH)成功在本土生產新冠疫苗,並將於5月底上市。[523]
2021年2月21日,以色列政府表示,該國已有近半人口接種新冠疫苗[524]。2021年7月底,由於原本注射兩針的疫苗對德爾塔變異毒株效果不佳,以色列開始為60歲以上人群接種新冠疫苗第三針加強劑[525]。
2021年11月16日,菲律賓批准中國科興公司生產的新冠疫苗作為加強劑在菲律賓接種。[526]
2021年11月26日,阿聯衛生部表示,該國已經施打逾2180萬劑新冠疫苗,100%的目標人口已接種至少一劑疫苗,而完成全程接種的人口比例達到90.18%。[527]12月27日,該國又批准緊急使用中國國藥新型重組蛋白疫苗作為加強劑[528]。
2022年1月5日,越南政府常務副總理范平明表示越南成為新冠疫苗接種率最高的6個國家之一。[529]
2022年1月10日起,印度開始為醫護人員、一線工作者和有基礎病的60歲以上人群接種新冠疫苗加強劑。[530]
2022年2月底,韓國開始為高風險人群施打第四劑冠病疫苗。[531]

2020年12月,據希臘媒體報道,已激活電子處方服務的希臘公民將在疫苗接種工作開始後收到帶有預約信息的短信或電子郵件。[532]
2020年12月24日,法國高級衛生管理局發布公告,對德國生物新技術公司與美國輝瑞公司聯合開發的COVID-19疫苗的有效性表示認可,並批准在年齡為16歲及以上的人群中接種。[533]2021年1月8日,法國批准使用莫德納疫苗[534]。
2021年1月29日,匈牙利成為首個批准使用中國疫苗的歐盟國家。[535]匈牙利現已採購的疫苗包括俄羅斯「衛星-V」疫苗、美德合作研發的輝瑞-BioNTech疫苗、英國牛津-阿斯利康疫苗、美國莫德納疫苗、中國國藥集團疫苗、中國康希諾新冠疫苗和印度Covishield疫苗。[536]同日,歐盟執委會批准阿斯利康與牛津大學聯合研發的疫苗附條件上市[537]。
2021年3月7日,奧地利衛生監管機構宣布,由於該國出現兩名護理師接種疫苗後分別病亡和發生肺栓塞,奧地利暫停一個批次的阿斯利康新冠疫苗的接種[538]。
2021年5月17日,德國聯邦衛生部宣佈6月7日起取消新冠疫苗接種排序規定,16歲以上人士可以接種疫苗[539]。
2021年9月起,德國為老年人及免疫力低下者接種新冠疫苗加強劑[540]。
截至2021年9月14日,義大利各大區疫苗接種率達到74.28%[541]。
截至2021年10月18日,德國國內人口總數65.8%的人完全接種新冠疫苗。[542]
法國自2021年11月27日新冠疫苗加強劑接種範圍擴大至18歲以上人群[543]。2021年12月15日起,65歲以上人群必須接種加強劑才能繼續持有健康通行證;同時加強劑接種範圍將擴大至50歲至64歲人群[544]。
2021年11月16日,愛爾蘭將加強劑接種範圍從60歲以上人群和醫務工作者擴大到50歲至59歲的人群和16歲至59歲有基礎疾病的人群。[545]
2021年12月10日,德國聯邦議院和聯邦參議院通過了醫護人員義務接種新冠疫苗的法律[546]。
2022年2月1日起,奧地利全國強制接種疫苗。[547]
2022年7月21日,西班牙決定對80歲以上年齡段的民眾接種第四針新冠疫苗加強劑。[548]

2021年3月24日,古巴開始為國內一線醫護人員接種主權2號疫苗,將有十五萬醫護人員接種疫苗[549]。5月12日,古巴本地開始展開大規模接種計劃[550]。
2021年1月18日,巴西國家衛生監督局宣布,批准中國大陸和英國兩款COVID-19疫苗在該國緊急使用。[551]
2021年4月7日,智利公共衛生研究院專家委員會給予中國康希諾新冠疫苗在智利緊急使用許可[552]。9月6日,智利公共衛生研究院專家委員會給予中國科興公司新冠疫苗在6歲至17歲人群中的緊急使用許可[553]。11月25日,智利公共衛生研究院允許中國科興疫苗可在3至6歲人群中使用[554]。
2021年10月1日。阿根廷政府批准中國醫藥集團有限公司研發的新冠疫苗在該國3至11歲兒童中緊急使用[555]。
2021年11月起,古巴開始為民眾接種新冠疫苗加強劑。[556]
2021年1月25日,埃及開始為醫護人員接種中國國藥集團生產的新冠疫苗[557]。
2021年7月23日,澳洲臨時批准輝瑞新冠疫苗用於12歲至15歲人群接種。[558]
2022年1月10日起,澳洲允許5歲至11歲兒童提供輝瑞疫苗接種。[559]同年4月起,澳洲為脆弱人群打第二針加強劑。[560]
疫苗安全、供應及相關議題
接種新冠疫苗後通常伴有發燒、噁心等由免疫反應導致的副作用[561],雖然對健康人不會有持續影響,但可能因此令體弱多病的病患注射疫苗後引起併發症,甚至死亡。儘管有些人在接種疫苗後不久會因年齡或潛在疾病而引起不適,但目前尚未有明確證據表明注射疫苗後的死亡事件與疫苗本身有直接的關係[561][562]。
各國接種計劃大規模展開後,接種人群中所產生的一些症狀與疫苗的關係,有待進一步研究、調查。[563][564]
2025年10月一項研究顯示,針對SARS-CoV-2的mRNA疫苗能提高腫瘤對免疫檢查點抑制劑(ICI)的敏感性[565]。
2020年12月,因為輝瑞疫苗在第三期臨床試驗中出現被稱為貝爾氏麻痹症的「面癱」個案,此症因而被認為是該疫苗的罕見副作用之一[566]。
2021年7月15日,香港特區政府根據疫苗專家委員會分析多宗接種中國科興克爾來福疫苗後發生的多宗不良反應案例後[567],正式將又稱「面癱」的貝爾氏麻痹症列為中國科興克爾來福疫苗的副作用之一[568]。
接種後貝爾氏麻痹症症狀一般不嚴重、可自愈,所以接種疫苗益處仍遠大於弊。[569]
2021年2月,奧地利兩名女子接種阿斯利康疫苗後,發生凝血障礙,其中一人死亡,另一人因肺栓塞住院治療,2021年3月3日,奧地利暫停使用有關批次的疫苗[4]。儘管尚未確定血栓與接種疫苗的聯繫[570],但丹麥、挪威、冰島、羅馬尼亞、保加利亞、愛爾蘭、西班牙、德國、瑞典等十幾個國家也暫停了該疫苗的使用,同時等待歐洲藥品管理局完成安全審查。[571]3月18日,歐洲藥品管理局繼續推薦接種阿斯利康疫苗,歐洲藥監局認為阿斯利康疫苗與接種者血栓風險上升沒有聯繫,也沒有證據證明某批次或者某廠生產的疫苗存在問題[572]。多國開始恢復接種疫苗[573]。不過4月7日,歐洲聯盟藥物監管機構又認為,應把異常且有潛在生命危險的血栓列為牛津-阿斯利康新冠病毒疫苗的罕見副作用[574];歐洲藥品管理局4月13日發布信息更新,稱阿斯利康疫苗與血栓形成之間「有可能存在因果關係」[575]。根據8例六十歲以下接種者血栓與低血小板病例,歐洲藥品管理局4月20日稱嬌生疫苗與罕見血栓形成之間也有「可能的聯繫」,但總體而言接種益處仍然大於風險。[576]
挪威、德國等國學者發現,因接種牛津-阿斯利康新冠病毒疫苗而產生血栓的患者體內均出現了PF4-polyanion抗體陽性及高水平的肝素,而提出了該腺病毒疫苗導致血栓及血小板減少罕見不良事件的一種可能機制。[577][578][579]因接種監測過程中發現6起罕見血栓事件,4月13日美國疾病控制與預防中心與美國食品藥品監督管理局聯合建議暫停嬌生2019冠狀病毒病疫苗接種,以待進一步調查、分析、決定。[579][580][581]上述兩家美國監管機構經研究於4月23日撤回了暫停嬌生疫苗接種的決定,但其專家委員會建議五十歲以下女性接種者應充分了解出現罕見血栓的可能風險。[582]
鑑於兩種不同腺病毒疫苗大規模接種過程中出現類似的血栓形成與血小板減少罕見事件,腺病毒載體本身作為一種疫苗開發平台是否存在內在隱患,引起關注。[583][584]另外兩種腺病毒載體類型新冠疫苗開發機構加馬列亞研究中心及康希諾生物則表示,在近來大規模接種其疫苗過程中均未發現類似血栓事件。[585][586]
截至2021年4月22日,英國已有168人在接種阿斯利康&牛津大學疫苗後出現血栓症狀,其中32人死亡[587]。4月27日,加拿大出現首起接種阿斯利康-牛津疫苗後出現血栓並導致死亡的案例[588]。
因可能的血栓風險,美國食品藥品監督管理局2022年5月5日宣布除少數有特殊情況或需求的成年人之外,應停止嬌生2019冠狀病毒病疫苗的接種。[589]
根據以色列衛生部的說法,在一小群16-30歲的男性中,第二劑輝瑞疫苗與輕度心肌炎之間可能存在著關係。在2020年12月至2021年5月期間,在500萬名接種者中出現了275例心肌炎,其中95%被歸類為輕度心肌炎。[590]類似現象也在美國mRNA疫苗(輝瑞或莫德納疫苗)接種者當中被觀察到。[591]6月23日,美國疾病管制與預防中心(CDC)專家委員會討論了相關接種數據,認為mRNA疫苗接種與青少年及年輕人的罕見心臟發炎(心肌炎或心包炎)「存在可能的關聯」。[592]
歐洲藥品管理局7月9日證實,接種mRNA疫苗之後存在心肌炎或心包炎的稀有案例,主要發生於接種14天之內(多為第二劑)的年輕男子。該管理局建議將心肌炎及心包炎列為輝瑞及莫德納疫苗可能的副作用。[593]
據美國食品藥品監督管理局數據,嬌生2019冠狀病毒病疫苗在極罕見情況下可能觸發格林-巴利症候群。[594] 之前歐洲藥品管理局也建議對於阿斯利康疫苗觸發該症狀的可能性提出警示。[595][596][597]
歐洲藥品管理局分別於2021年10月及2022年1月建議將貫穿性脊髓炎列為嬌生及阿斯利康疫苗的可能副作用。監管機構未有公佈出現此症狀的人數。[598]
由於疫苗供不應求,2021年1月22日,阿斯利康宣布2021年第一季度僅能向歐盟供應少量疫苗,引發歐盟不滿[599]。歐盟呼籲阿斯利康的英國工廠提高產量[600]。
而為緩解疫苗緊張,歐盟又決定對在歐盟內生產的疫苗實行出口管控措施。此舉又招致世衛組織批評。世衛組織總幹事譚德塞表示,疫苗民族主義無助於緩解疫情[601]。2021年4月27日,歐盟不滿阿斯利康延遲交付宣佈起訴阿斯利康[602]。2021年6月中旬,比利時布魯塞爾一審法庭裁定阿斯利康必須於9月27日前交貨8020萬劑疫苗[603],否則每劑罰款10歐元。歐盟原本希望法庭判處阿斯利康須在6月底前交付1.2億劑疫苗,9月底前完整交貨3億劑,及對延遲運交的疫苗每劑每天罰款10歐元,但法庭裁決的交付量及每劑的延期罰款明顯少過歐盟要求的數字,而阿斯利康已經在法庭宣判前交付了近7000萬劑疫苗,亦即只需在9月27日前交付多約1000萬劑便能達到裁決要求,不過法庭也表示阿斯利康仍是要盡力完成3億劑的總交貨量[604]。
2020年3月18日,中華人民共和國清華大學清華長庚醫院急危重症部部長陳旭岩就美國COVID-19疫苗已開始人體臨床試驗表示,「美國這一針打在人體身上的疫苗,從推斷上來說實在是太快了。疫苗的研發,有一系列國際標準的法規和技術標準,必須不能跳步的東西就不能跳步,除非很早就開始進行試驗,更早的拿到了病毒株[605]。」
2020年8月,俄羅斯成為率先批准新冠病毒疫苗的國家,該國生產的「Sputnik V」將於10月起大規模接種,然而由於疫苗在三期臨床試驗之前取得許可,如此匆促的決定也引起全球的關注。[606]
英國倫敦帝國理工學院傳染病專家特裏戈寧(John Tregoning)說:「這種疫苗採用現有的技術。它已經達到很高的標準,使用我們知道可以安全用於人的東西,並且將對那些參與試驗者進行非常嚴格的管控……是的,進行的十分之快,但這是一場與病毒的競賽,而不是科學家之間的競爭,而且這樣做是為了人類的利益。」英國廣播公司報導指,該次實驗的「mRNA-1273」疫苗並非由引起2019冠狀病毒病的病毒製成。取而代之的是,是從科學家已經能夠在實驗室製造的病毒複製而來的基因編碼研發出來,希望能激發人體自身的免疫系統抵抗感染[607]。
美國賓夕法尼亞大學醫學院副教授張洪濤認為,腺病毒載體疫苗的技術路線是可行的,也可以表達抗原,但存在一定的安全風險,因為該疫苗「同時引入了作為載體的腺病毒,而腺病毒本身也是一種病毒」,雖然在疫苗設計中會考慮到病毒複製的風險,但「整個技術路線的安全性尚未經歷過大規模使用的驗證」[134]。
輝瑞疫苗在進行44000人臨床試驗時有6人死亡,其中兩人是在注射疫苗後死亡。[608]美國FDA隨後澄清死亡案例與疫苗無關,並解釋「所有死亡案例都代表發生在其所在年齡段的一般人群中的事件,發生率相似」。[609]
2021年1月,挪威開始疫苗接種後,短期內有23名80歲以上老人在注射疫苗後死亡,有懷疑認為疫苗的輕微副作用也可能對年老體弱者有較高風險。[610][611]截至1月18日,挪威公共衛生學院已調查了23例死亡病例中的13例,調查人員尚未得出疫苗導致死亡病例的結論。[612]
彼得·多西(Peter Doshi)在《英國醫學雜誌》所辦博客BMJ Opinion上計算稱,輝瑞疫苗有效率其實只有29%。有文章對其中算法的問題予以反駁,同時批評多西是美國「反疫苗運動」的成員,平日主要批評政府對疫苗接種的推廣行為。[613]
2021年1月,印度首都新德里超4000名接種者中,有多達51名醫護人員在接種疫苗後出現不良反應,其中一人被送入了醫院的加護病房(ICU)。[614]
2021年1月,美國加利福尼亞州一個社區中心有不到10人在接種莫德納疫苗後24小時內幾乎所有人出現嚴重的過敏反應。加州一家機構報告稱,出現不良反應的人接種的41L20A批次的莫德納疫苗的潛在過敏反應數量高於正常水平。1月17日,加州公共衛生部(California Department of Public Health)建議當地醫療機構暫停41L20A批次的莫德納COVID-19疫苗的接種工作[615]。
2021年1月,據以色列衛生部表示,在以色列民眾接種輝瑞/BioNtech疫苗疫苗後,超過12400人SARS-CoV-2檢測呈陽性,而其中有69人已接受第二劑接種[616]。
2021年2月,菲律賓食品與藥物管理局局長多明戈稱不建議經常暴露在疫情風險中的醫護人員接種中國科興生物疫苗,原因是它對抗冠病的效能僅為50.4%[617]。
截至2021年3月16日,香港2019冠狀病毒病疫苗接種計劃展開只有兩週多,在已接種最少一劑疫苗的16.6萬人之中,便有七人在接種中國科興疫苗後身亡,即每2.4萬人接種疫苗後便有一人死亡,香港的死亡率比英美等國的全民接種計劃高出最少一倍,死者年齡中位數62歲,亦低於英美[618],惟香港特區政府不認為該等接種人士的死亡與接種疫苗有關[619]。
2025年9月,美國疾病管制與預防中心預防接種諮詢委員會(ACIP)公開質疑新冠疫苗的功效與安全,且拒絕明確建議民眾接種。該諮詢委員會表示,關於是否接種新冠病毒疫苗,應在諮詢專業醫護人員後作出個人選擇。委員會並建議疾控中心敦促醫護人員「更明確地提醒疫苗潛在的風險」。[620]
2020年4月底,阿斯利康與牛津大學達成合作後,便開始向參加大規模臨床試驗的英國志願者注射AZD1222疫苗。該試驗的原計劃是為英國的試驗參與者注射2劑全劑量的疫苗,但是在注射第1劑後,研究人員注意到一些人出現的副作用比預期的要輕,隨後他們回頭檢查發現第1劑疫苗濃度為標識濃度的一半,因此一些志願者相當於只注射了半劑量的疫苗。牛津大學決定改變實驗計劃,將部分志願者試驗劑量改為1.5劑,並稱他們與監管機構討論了這一問題。然而,2020年11月兩家機構發聲明公布其疫苗有效性為90%時,並未披露這一關鍵錯誤。根據阿斯利康說法,只有約2741人接種1.5劑疫苗,約8895人接種2劑疫苗。查坦研究所衛生研究員索茲伯里稱低劑量組的人數少,因此很難確定該組試驗數據(90%有效性)是否真實有效,或者只是純屬統計巧合,另外低劑量組中的志願者沒有一人超過55歲,人群年齡偏小也意味著感染COVID-19的風險更小。因此,這很難確定低劑量組有效性達90%,是否受到劑量影響、還是年齡影響。佛羅里達大學生物統計學家迪安(Natalie Dean)則稱在披露候選疫苗試驗結果的透明度與嚴謹度上,阿斯利康與牛津大學做得很爛(poor grade)。對此,阿斯利康生物醫藥研發部執行副總裁潘加洛斯稱,「該錯誤其實無關緊要。」「即使你只相信全劑量、全劑量數據……我們疫苗的有效性也達標了,疫苗獲得批准的門檻是疫苗有效性超過60%。」[621][622]
社交媒體上的部分帖子宣揚一種陰謀論,稱2019冠狀病毒病及其病原體已經為人所知,而且已經有了疫苗。這些社交媒體帖子並引用了一些涉及其他冠狀病毒毒株(如SARS冠狀病毒)的基因序列和疫苗的專利[623][624]。
研究發現在16個國家中,打足完整疫苗劑量的覆蓋率和delta variant病毒序列突變的頻率(mutation frequency)有高度的對數負相關(R-square= 0.878)。這個結果指出完整疫苗接種可能可以有效的壓抑病毒突變的發生。[625]
2020年10月印度和南非向世界貿易組織建議在2019冠狀病毒大流行這個「特殊情況」下豁免《與貿易有關的智慧財產權協定》某些規定,有助擴大疫苗產能,緩解疫苗供應問題。提案馬上遭到美國,歐盟,英國,挪威,瑞士,日本,加拿大,澳大利亞和巴西的反對,之後11月和12月的會議,再次遭到反對。相反有100多個國家支持這個提案。美國貿易代表處表示保護專利才是迅速交付疫苗和有助研究治療的方法,歐盟表示沒有證據表明專利問題對2019冠狀病毒病的疫苗和治療研究造成障礙。《華爾街日報》摘文表示提案是「專利盜竊」[626]。
2021年5月5日美國總統拜登表示支持新冠疫苗專利豁免,歐盟也隨後表示認同,立場和之前相反。製藥商表示反對,認為提議讓他們失去部分收入。德國持反對意見,德國政府發言人稱「保護智慧財產權是創新的源泉,未來也必須加以保持」。《路透社》報導法國總統馬克宏表示非常支持豁免專利,雖然有法國官員評論事件「我要提醒你們的是,連一劑疫苗都沒向其他國家出口過的美國,現在卻在討論放棄專利」,但報導亦指出美國已向墨西哥和加拿大借出數百萬劑阿斯利康疫苗[627]。輝瑞公司透露他和美國白宮簽署協議在3月31日之前禁止將美國生產疫苗運輸到國外,在4月份才開始向墨西哥出口在美國工廠生產的輝瑞疫苗[628]。除德國外,英國、美國的盟友及美國商界皆反對豁免,全球創新政策中心表示「沒有證據」表明豁免智慧財產權能夠提升疫苗產量[629]。世衛組織稱美國此舉是全球抗疫的「不朽時刻」[630],世衛總幹事譚德塞稱美國的決定展現出智慧和道德領導力[94][627]。路透社引述一名美國高層官員的消息,指拜登政府的建議引發不少官員及公司擔憂,他們擔心開放疫苗專利將令中國、俄羅斯等國取得美國生物製藥的尖端技術。[631]世界貿易組織總幹事恩戈齊·奧孔約-伊衞拉在5月11日表示樂意見到這一議題的進展,世貿將於5月底開會討論,並就豁免專利、技術轉讓及讓開發中國家更易取得疫苗等議題進行協商,期望可在12月達成框架協議[632]。5月17日,中國外交部發言人趙立堅回應關於疫苗專利豁免問題時,表示中國「完全理解並支持」[633]。
2022年當地時間6月12日至17日,經世界貿易組織第12屆部長級會議的多日討論,宣布達成了包括新冠疫苗智慧財產權豁免協議在內的諸多協議,而該豁免協議會使南非等開發中國家的公司更容易在有限的情況下生產和出口已獲專利的新冠疫苗,如果得到本國政府批准,則無需徵得專利持有人的同意[634]。南非、印度、美國、中國等國的貿易代表均對該協議持贊成態度[635]。就此事,美國媒體《華爾街時報》發布名為「拜登送給北京的專利禮物」的評論文章,表示世界貿易組織成為打擊美國創新的工具,協議損害美國的智慧財產權,對美國國家利益造成損害,並表示該協議允許中國等開發中國家竊取新冠疫苗智慧財產權[636]。美國商會亦發表聲明,表示該協議開了個壞頭,既阻礙創新、削弱創新公司能力,又不會解決任何阻礙疫苗接種的實際問題[637]。
2021年8月30日中國國藥採用新冠不活化疫苗免疫後血漿製備的新冠肺炎特異性治療藥物COVID-19人免疫球蛋白(pH4),被批准開展臨床試驗。[638]
參考文獻
外部連結
參見
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
