トップQs
タイムライン
チャット
視点
パーキンソン病
運動障害を示す進行性の神経変性疾患の一種 ウィキペディアから
Remove ads
パーキンソン病(パーキンソンびょう、英: Parkinson's disease)は、手の震え、動作や歩行の困難など運動障害を示す、進行性の神経変性疾患である。進行すると自力歩行も困難となり、車椅子や寝たきりになる場合がある。40歳以上の中高年の発症が多く、特に65歳以上の割合が高い。人間の体の硬直や動きの鈍化を引き起こす可能性もある[1]。深刻な認識障害と微弱な言語障害も発生するが、慢性的で進行的で、遅い動作、停止時の震え、筋肉硬直、引きずりながら歩くことや曲がった姿勢のような姿勢不安定症状を特徴とする進行型神経退行性疾患である[2]。
錐体外路症状を呈し、アルツハイマー病と並んで頻度の高い神経変性疾患と考えられている[3]。日本では黒質のドパミン神経細胞の障害によって発症する神経変性疾患として難病(特定疾患)に指定されている[2]。本症以外の変性疾患などによりパーキンソン様症状が見られるものをパーキンソン症候群と呼称する[4]。
Remove ads
歴史
1817年にイングランドのジェームズ・パーキンソンにより初めて報告された。ジェームズは、現代でいうパーキンソン病の症状を呈した6症例を、振戦麻痺(shaking palsy)という名で紹介した。記載した症状は、寡動、安静時振戦、姿勢保持障害、前傾姿勢、小字症などで、筋強剛については触れていない。
ジェームズの報告は長い間評価されなかったが、1888年になってフランスのジャン=マルタン・シャルコーによって再評価された。シャルコーは筋強剛についても記載し、彼の提唱により本疾患はパーキンソン病と呼ばれるようになった[5]。シャルコーが改名を提唱した理由は、本当の意味での「麻痺」は見られないためと、全ての患者に必ずしも振戦が見られるわけではないためであった[6]。もう一つの主要症候である無動・動作緩慢については、サミュエル・アレクサンダー・キニア・ウィルソンがその教科書の中で提唱している[6]。
パーキンソン病の病理に関しては、1913年にフレデリック・レビーが神経細胞内の封入体 (レビー小体) を初めて記載、またロシアの神経病理学者コンスタンティン・トレティアコフは1919年、パーキンソン病の責任病変が中脳の黒質にあると発表した[7]。
パーキンソン病の治療は19世紀末までにベラドンナアルカロイドが効果のあることがわかり、20世紀に入ってスコポラミンによる治療が、1949年にはトリヘキシフェニジルの治療報告が行われている。L-ドパ(レボドパ)は1913年には既に精製単離されていたが、1950年代後半から脳内、特に線条体でのドーパミンの存在と、その低下がパーキンソン病で見られることが報告されると、1960年代にレボドパを使った実験・試験が始まり、その効果が明らかとなった[7]。
1987年、スウェーデンにあるルンド大学のオーレ・リンドヴァールたちが、中絶胎児からとった中脳の一部の細胞を、パーキンソン病患者の線条体へ移植する臨床研究を行った。彼らは細胞移植によりパーキンソン病の脳機能の回復が起こったと報告している。数体の中絶された胎児から細胞を採取する必要があるため、その倫理的な問題性と中絶された胎児を数体同時に入手するのが困難なため治療法としては確立していない。しかし、近年進められているiPS細胞の開発が細胞の確保を可能にしつつある[8]。
→詳細は「§ 細胞移植治療」を参照
Remove ads
病理
要約
視点
肉眼的には中脳の黒質、青斑核の色素脱失がみられ、組織学的には、黒質や青斑、迷走神経背側核、視床下部、交感神経節などの神経細胞脱落が生じていて、典型的には残存神経細胞やその突起の一部にレビー小体(Lewy body)という特徴的な封入体が認められる。パーキンソン病の病理診断基準では中脳黒質の緻密部の中等度以上の神経細胞の消失とレビー小体病理が必要である[9]。
近年ではレビー小体は自律神経節など末梢レベルでも蓄積していることが明らかになってきた。レビー小体には、リン酸化α-シヌクレインの異常な蓄積が認められる。このα-シヌクレインに対して、EBウイルスの潜伏感染Ⅲ型遺伝子抗原のLMP1が交叉反応性を持つことが報告されている[10]。
病理学的な検討ではレビー小体病全体のレビー小体は脳幹、辺縁系、末梢から始まる3パターンが知られているが[11][12]、パーキンソン病の多くは脳幹のレビー小体から始まると考えられている。
マクロ病理所見
パーキンソン病のマクロ病理所見は中脳黒質、橋青斑核の脱色素である。これは中脳黒質、橋青斑核にあるメラニン含有細胞が減少するためである。それ以外にパーキンソン病のマクロ病理所見では特徴的な所見はない。
ミクロ病理所見
パーキンソン病のミクロ病理所見は2つの特徴的な所見がある。ひとつは中脳黒質、橋青斑核、延髄迷走神経背側核の神経変性である。神経変性は神経細胞脱落とグリオーシスのことである。もうひとつはレビー小体に代表されるαシヌクレイン陽性のレビー関連病理である。パーキンソン病の病理診断基準では中脳黒質の緻密部の中等度以上の神経細胞の消失とレビー小体病理が必要である[9]。
神経変性
神経病理学では神経変性とは明らかな他の原因がなく神経細胞が死にいたる現象である。病理所見としては神経細胞の萎縮、減少とそれに反応したアストログリアの増生、すなわちグリオーシスである。パーキンソン病では神経変性を起こす部位は中脳黒質、橋青斑核、延髄迷走神経背側核の3ヶ所に限られている。中脳黒質はドパミン作動性神経、橋青斑核はノルアドレナリン作動性神経、延髄迷走神経背側核はコリン作動性神経であり、これらは解剖学的、機能的いずれにも関連がみられない。パーキンソン病でなぜこれら脳幹部の3ヶ所のみが特異的に神経変性を起こすかについては明らかな原因は解明されていない。病理診断では特に中脳黒質の緻密部の中等度以上の神経細胞の消失が重要である。
神経炎症
神経炎症は神経変性に対する反応とみなされていたが、疾患の引き金になったり、重要な役割を担うと考えられるようになった[13]。 パーキンソン病の初期段階にCD8陽性T細胞が中脳黒質に浸潤するという報告がある[14]。
レビー関連病理
レビー小体の発見
ドイツのベルリン出身のユダヤ系神経学者のフレデリック・レビーは1912年に、パーキンソン病患者脳の大脳基底核の無名質および延髄の迷走神経背側核にみられる神経細胞内封入体を発見し詳細に記載した。その後、1919年にロシアの神経病理学者コンスタンティン・トレティアコフが博士論文の中でパーキンソン病の中脳黒質の神経細胞内にレビーが発見した細胞内封入体と同様の構造物を見出し、発見者の名にちなんでレビー小体と記載して以來同名称が用いられるようになった。中脳黒質や青斑核など脳幹部にみられるレビー小体は光学顕微鏡で2ないし3層の同心円状にみえ、HE染色では好酸性のcoreと周囲に明瞭なhaloからなる封入体として観察される。一方で大脳皮質神経細胞に形成されるレビー小体は細胞質全体に占めるなど比較的大きく、かつHE染色で淡く染色され皮質型レビー小体とよばれる。レビー小体は神経細胞の核周囲の細胞体に存在するが、一部は神経突起に認められレビーニューライトと呼称される。
レビー小体の構成成分
レビー小体の周辺部であるhaloの部分には電子顕微鏡で直径10nm前後の線維構造がみられるが、その主たる構成成分についての詳細は不明であった。岩坪威らはレビー小体型認知症の患者脳を出発材料としてレビー小体を分離精製した。そして、これを抗原として得られた抗体の一部がαシヌクレインを認識すること、さらに抗αシヌクレイン抗体を用いた免疫電顕にてレビー小体内部の線維状構造を認識することを示し、凝集・線維化したαシヌクレインがレビー小体の主要構成成分であることを明らかにした[15]。ほぼ時を同じくして、常染色体優性遺伝を示す家族性パーキンソン病であるPARK1の原因としてαシヌクレイン遺伝子(SNCA)の点変異(A53T、A30P)が同定され、さらにその後SNCAの遺伝子重複によっても家族性パーキンソン病が発症する(PARK4)ことが証明され、αシヌクレインはパーキンソン病病態におけるkey moleculeとして広く認識されるようになった。抗αシヌクレイン抗体の登場によりHE染色では確認できないpale bodyと呼ばれる形成途上のレビー小体も確認できるようになった。さらに多系統萎縮症脳のグリア細胞内封入体もαシヌクレイン陽性であることが判明し、αシヌクレイン凝集・蓄積を共通の病態背景とする疾患を総称するシヌクレイノパチーという概念が提唱されるようになった。レビー小体とレビーニューライトなど関連する病理所見をレビー関連病理とよぶ。
レビー小体病の分類
小阪らは中枢神経系にレビー小体をもつ剖検例からレビー小体病を提唱し、レビー小体の広がりから脳幹型、移行型、びまん型に分類した。脳幹型がパーキンソン病である。その後、脳幹優位型、辺縁系(移行)型、新皮質型の分類に改訂された[16]。
病期分類
パーキンソン病やレビー小体病の病期分類としてBraak分類の他、高齢者ブレインバンク分類、Beachらの分類、Attemsらの分類が知られている。
Braak分類
Braak分類はパーキンソン病の病期分類であり、レビー小体病全体の病期分類ではない。1953年にGreenfieldらが中脳黒質の神経細胞脱落とレビー小体の出現がパーキンソン病の主病変であることを確立した。その後、パーキンソン病は黒質に始まると考えられてきた。しかし2003年にBraakらがパーキンソン病ではαシヌクレインの蓄積は迷走神経背側核と嗅球に最初に起こり、その後、脳幹では延髄から中脳へと上行し、大脳皮質では側頭葉の前内側部から側頭葉外側皮質、島回、帯状回、前頭前野や広がっていくことを明らかにした[17]。これをBraak仮説という。Braak仮説に基づいたBraak分類ではパーキンソン病はStage1~Stage6の6つの病期に分類される。Stage1ではαシヌクレインの蓄積は迷走神経背側核または嗅球に限局している。Stage2では青斑核、Stage3では黒質におよぶ。Stage4では中間皮質、Stage5では高次感覚連合野と前頭前野、Stage6では前頭前野、運動野、体性感覚野が侵される。その後の検証によってパーキンソン病は80~90%の症例でBraak仮説に一致する進展様式を呈することが確認された。Braak分類はパーキンソン病の病期分類として国際的にも用いられている。しかし、中枢神経系にレビー小体の出現を認める例をすべて含めるとBraak仮説に一致する例は約半数程度である。これは嗅球に限局する例、脳幹に病変がなく辺縁系や大脳皮質優位の病変を呈する例が多く含まれるためである。
高齢者ブレインバンク分類
高齢者ブレインバンク分類は東京都健康長寿医療センター高齢者ブレインバンクの分類であり、レビー小体病全体をカバーする病期分類である[18]。StageⅠ~StageⅤまでの5段階の分類である。StageⅠは神経細胞脱落がなく、αシヌクレインの蓄積がわずかに認められる状態である。StageⅡは臨床的にパーキンソン症候群や認知症も欠くが、黒質と青斑核に色素脱失が認められ、多数のレビー小体が出現している状態である。StageⅢは認知症を伴わないパーキンソン病、StageⅣは辺縁型のDLB、StageⅤは新皮質型のDLBに相当する。
Beachらの分類
Beachらの分類ではStageⅠ~StageⅣの4段階に分類される[19]。StageⅠではαシヌクレイン蓄積は嗅球に限局する。StageⅡでは脳幹優位(StageⅡa)または大脳辺縁系優位(StageⅡb)に分けられる。StageⅢではαシヌクレイン蓄積は脳幹と大脳辺縁系にほぼ同等認められる。StageⅣでは大脳新皮質に広がっている。この病期分類ではILBD(incidental Lewy body disease)の多くはStageⅡaに分類される。パーキンソン病やレビー小体型認知症はStageⅢまたはStageⅣに分類される。レビー小体を伴うアルツハイマー病はStageⅠまたはStageⅡbに分類される。
Attemsらの分類
Attemsらはレビー小体病をレビー小体の広がりによって5つに分類した[20]。嗅球のみ、扁桃核優位型、脳幹優位型、辺縁系型、新皮質型の5病型である。この5病型に末梢型(レビー小体の出現を伴う純粋自律神経不全症)を加えておけばほとんどのレビー小体病は分類可能である。
末梢神経系の病理
パーキンソン病では末梢神経系にもαシヌクレインが認められる。唾液腺、消化管神経叢、心臓、副腎、皮膚、網膜、嗅粘膜にαシヌクレインが認められる。一方で多系統萎縮症では末梢交感神経節に少数の神経細胞質内封入体が認められるが内蔵自律神経にはαシヌクレインは認められない。すなわちパーキンソン病では末梢神経を含める全身性のαシヌクレインの蓄積が認められる一方で多系統萎縮症はほぼ中枢神経系にαシヌクレインの蓄積が限局する。
合併病変
パーキンソン病またはレビー小体型認知症とアルツハイマー病の合併例は非常に多い[21][22][23]。臨床診断がアルツハイマー病であった症例の32~40%で病理診断はアルツハイマー病とレビー小体型認知症の合併であったという報告がある。また臨床診断でレビー小体型認知症であった症例の32~52%で病理診断はアルツハイマー病とレビー小体型認知症の合併であった。また病理診断でアルツハイマー病とレビー小体型認知症の合併と診断された例の61%は臨床診断がアルツハイマー病であった。類似した報告もある[24][25]。また臨床診断がレビー小体病でも病理学的にレビー小体病とアルツハイマー病に合併となる例は50%程度である[25][26]。
Remove ads
病態
要約
視点

中脳黒質のドーパミン神経細胞減少により、これが投射する線条体(被殻と尾状核)においてドーパミン不足と相対的なアセチルコリンの増加がおこり、機能がアンバランスとなることが原因と考えられている。しかしその原因は解明には至っていない。このため、パーキンソン病は本態性パーキンソニズムとして、症状の原因が明らかでないパーキンソニズムに分類される。また腸管におけるアウエルバッハ神経叢(Auerbach plexas)の変性も病初期から認められており、この病気は全身性疾患であると再認識され始めている。
神経変性による病態
パーキンソン病では中脳黒質、橋青斑核、延髄迷走神経背側核の3ヶ所で神経変性が起こる。中脳黒質はドパミン作動性神経、橋青斑核はノルアドレナリン作動性神経、延髄迷走神経背側核はコリン作動性神経であり、これらは解剖学的、機能的いずれにも関連がみられない。パーキンソン病でなぜこれら脳幹部の3ヶ所のみが特異的に神経変性を起こすかについては明らかな原因は解明されていない。それぞれの部位の神経変性でパーキンソン病の症状の一部は説明が可能である。中脳黒質では線条体黒質系の障害でパーキンソニズムが、橋青斑核では気分障害や睡眠障害が、延髄迷走神経背側核では消化管機能障害が生じる。特に中脳黒質の変性で生じるパーキンソニズムがパーキンソン病の症状の本態と考えられている。パーキンソン病では中脳黒質の緻密部のドパミン作動性神経が主に変性する。パーキンソニズムは黒質のドパミン神経細胞が50%減少した時点で生じると考えられてきた。しかし黒質における30%のドパミン作動神経の減少でも線条体軸索終末は50~60%の減少をしており、この時点でパーキンソン病の診断に至るという意見もある[27]。
一方、線条体黒質系のポストシナプスである線条体(被殻と尾状核)では病理学的に明らかな神経変性は認められない。多系統萎縮症では線条体の神経変性を伴う。多系統萎縮症ではポストシナプスである線条体の変性があるためL-DOPAの補充で運動症状が改善しないと考えられている。橋青斑核や迷走神経背側核の変性に伴う症状については、これらの部位の機能から関連が推測されているが、黒質へのドパミン補充のように直接アプローチをすることで症状改善を得る治療法は確立していない。橋青斑核や延髄迷走神経背側核に関連した症状については黒質線条体とドパミンのようにシンプルな対応ではなく、複数の要素が関与した複雑な機序によるためと思われる。
αシヌクレインの病態
シヌクレインはゴマフシビレエイの発電器官に存在するシナプス小胞関連分子として最初にクローニングされた。シナプス小胞に加え核にも発現が認められたことからsynaptic and nuclear proteinとしてsynucleinと命名された。哺乳類のシヌクレインにはα、β、γの3つのサブユニットが存在し、このうち140アミノ酸からなる最大の分子種がαシヌクレインである。構造的にはKTKEVGの繰り返し配列を持ち、両親媒性のN末ドメイン、中央部の疎水性NAC(non-Aβ component of AD amyloid)ドメイン、陰性荷電したC末ドメインからなる。αシヌクレインはニトロ化、ジチロシン化、リン酸化、ユビキチン化、SUMO化(small ubiquitin-like modifier)など様々な翻訳後修飾を受ける。特にセリン129残基がリン酸化されたαシヌクレインは大部分のレビー小体で陽性になることが知られている。これまでの研究から点変異、酸化ストレス、ミトコンドリア障害、金属イオンへの暴露などによってαシヌクレインは線維化・凝集化を生じることが示されている。αシヌクレインはフィブリル形成に至る線維化の過程の中で、様々な中間凝集体を生じるが、成熟したフィブリルよりもプロトフィブリルをはじめとする可溶性の中間凝集体により強い細胞毒性があることが判明している。凝集αシヌクレインは細胞・オルガネラ膜破綻、小胞体ストレス、ミトコンドリア機能障害、プロテアソーム/リソソーム機能障害、細胞内輸送障害などを誘発し、細胞毒性発現に関与している可能性が指摘されている。
レビー小体の病態
αシヌクレインは点変異、産出過剰、酸化ストレス、翻訳後修飾などの影響により線維化・凝集化し細胞毒性を示す構造に変化する。その一方でレビー小体の細胞毒性は示されていない。細胞にプロテアソーム阻害剤を加えたり、変異タンパク質を過剰に発現させるとユビキチン化された折りたたみに失敗した(ミスフォールド)タンパク質はダイニンを介して微小管に沿って逆行性に輸送され、核に隣接した微小管形成中心(microtubules organizing center、MTOC)に集積することが知られている[28]。この微小管形成中心に生じるタンパク集積はアグレソームと呼ばれる。アグレソームは中心にポリユビキチン化されたタンパクがあり、その周囲を中間径フィラメントであるビメンチンが覆うという共通した形態学的特徴を有している。免疫組織学的検討ではレビー小体はγチューブリン、ペリフェリンなどの微小管形成中心のマーカーの他、アグレソームのに集積がみられるユビキチン・プロテアソーム系酵素やHsp70などのシャペロン分子が陽性であり、レビー小体形成にアグレソームの機序が関与している可能性が推定されている。パーキンソン病の患者の中脳黒質においてアポトーシス所見を有する細胞の多くはレビー小体を有していない。皮質型レビー小体の出現率はレビー小体型認知症の重症度や罹病期間とは相関していない。そのため、成熟したフィブリル構造を有するαシヌクレイン凝集体の形成自体は細胞死を惹起するものではなく、むしろ細胞死を回避するための合目的な防御反応の結果とも考えられる[29]。
プリオン仮説
プリオン仮説というのは、異常蛋白質が細胞間を伝搬し周囲の病変に拡大させていく様がプリオン病でみられる細胞間伝搬現象に類似しているために名付けられたものである。パーキンソン病ではαシヌクレインによる細胞内凝集体が細胞間に伝搬し、そこでさらなる凝集を引き起こす凝集核として機能し、その結果新たな凝集体が次々に脳内に拡がることを指している。この異常凝集蛋白質伝搬がパーキンソン病で語られるもとになった論文が2つある。ひとつはBraak仮説であり、もう一つが胎児脳黒質移植である。
Braak仮説
2003年にBraakらは認知症を伴わない孤発性パーキンソン病と偶発的レビー小体病(incidental Lewy body disease、iLBD)を含むコホートでαシヌクレイン陽性構造物の分布を検討した。彼らはαシヌクレイン病理が延髄迷走神経背側核にはじまり、橋青斑核を経て中脳黒質に進展し、さらには大脳辺縁系、大脳新皮質へ拡がることを示した[17]。その後、孤発性パーキンソン病の発症機序に鼻粘膜と腸管粘膜からの外来性の病原体の侵入が関与するというdual hit hypothesisを提唱した[30]。
胎児脳黒質移植
実際の患者脳においてレビー小体病変が伝搬することを最初に示唆したのが胎児脳黒質移植である。胎児の中脳神経細胞を移植したパーキンソン病の脳を検索した結果、移植神経細胞内にレビー小体が認められた[31][32]。これは移植組織に対して近傍に存在する異常細胞が何らかの形で影響を与えたことを示す。
異常蛋白質の細胞間伝搬
異常な形に折りたたまれるマウス組換えαシヌクレイン線維を作成し、正常マウスの脳に注入すると、正常であったマウスにパーキンソン病の主要な症状が出現し、次第に悪化することが報告された[33]。この結果から、異常な形に折りたたまれた蛋白質が細胞間を移動することで伝搬され、神経細胞死を引き起こす可能性が示唆された。
Remove ads
病因
病理および病態で詳述するように、中脳黒質緻密質のドーパミン分泌細胞の変性が主な原因である。ほとんどの症例(90-95%)が孤発性であり、神経変性の原因は不明(特発性)である。メンデル遺伝による家族性発症もあり、2012年時点いくつかの病因遺伝子が同定されている。その他毒素、頭部外傷、低酸素脳症、薬剤誘発性パーキンソン病もわずかながら存在する。MPTPを用いてパーキンソン病のモデル動物を作成する。
疫学
要約
視点

no data
< 5
5–12.5
12.5–20
20–27.5
27.5–35
35–42.5
42.5–50
50–57.5
57.5–65
65–72.5
72.5–80
> 80
10歳代〜80歳代まで幅広く発症するが、中年以降の発症が多く、高齢になるほど発症率および有病率は増加する[35]。20歳代の発症はまれである。40歳以下で発症した場合を若年性パーキンソン病と呼ぶが、症状に差はない。日本における有病率は10万人当たり100〜150人といわれる[2][36]。欧米では10万人当たり300人と見積もられている[37]。
明らかな人種差や地域差があるかは不明であるが、白人と比べてアフリカ系アメリカ人の発症率は4分の1程度、アジア人の場合は3分の1から2分の1程度とする資料もある[38]。日本での有病率は増加傾向にあり、これを1) 高齢化に伴うパーキンソン病そのものの増加、2) 診断率の向上、3) 治療の進歩による患者の寿命の延長によるものとする説がある[3]。一方、年齢調整後の発症率・有病率は以前とほぼ変化がないとする報告もある[39][40]。性差については、アメリカのテキスト[38]、オランダからの報告[41]など欧米では男性が多いとされている。一方、日本ではどの調査でも女性が多いとする報告がなされているが、この違いの理由は未解明である[3]。
厚生労働省が公表する「衛生行政報告例」によれば、2023年(令和5年)度末現在の特定医療費(指定難病)受給者証所持者数は147,481件であり、全特定疾患の中で最も多い[42]。
なお、2003年10月よりパーキンソン病関連疾患として本疾患に進行性核上性麻痺と大脳皮質基底核変性症を併せたものになったため、現在では本疾患の正確な人数を反映する数値ではなくなっている。また特定疾患受給の要件として、ホーン・ヤールのスケールのステージ3以上が目安となっているため、実際の患者数はより多いものと予想される[要出典]。
危険因子と保護因子
危険因子・保護因子として報告されたものには、以下のものがあるが十分な知見が蓄積されているとはいえない[3][43][44]。これらは疫学的な研究報告であり、パーキンソン病発症との因果関係があるのかはわかっていないものも多く、また相反する結果の報告も少なくない。因果関係が疑われるものに関しては、原因仮説節の環境因子を参照。
- 危険因子
- 加齢:ほぼ全ての研究で高齢になるほど有病率は高くなり、発症率も60から70代が最も高いとされる[3]。
- 性別:上記のとおり、男女どちらが発症しやすいかは報告が分かれており、断定されていない。
- 居住場所: 都市部に比べて農村部に多いとする報告と、差がないという報告があり、断定されていない。
- トリクロロエチレンへの曝露:発症確率が500%増加するとの報告がある[45]。
- 除草剤・殺虫剤への曝露:パラコート、ロテノン、有機塩素剤などが報告されている。
- 金属への曝露:マンガン、銅、鉛、鉄など[36]。
- ライフスタイル: 飲酒・喫煙をしない、偏食、無趣味、仕事中心、無口・内向的で几帳面など[43]。
- 食事:動物性脂肪、飽和脂肪酸の摂取。総脂肪や総コレステロールについては意見が分かれている。
- 井戸水摂取:危険因子とする報告が多いが、保護因子とするものもある。
- 頭部外傷・その他の合併症:頭部外傷は危険因子とする報告がある一方、否定的なものが多い。
- 保護因子
Remove ads
症状
要約
視点
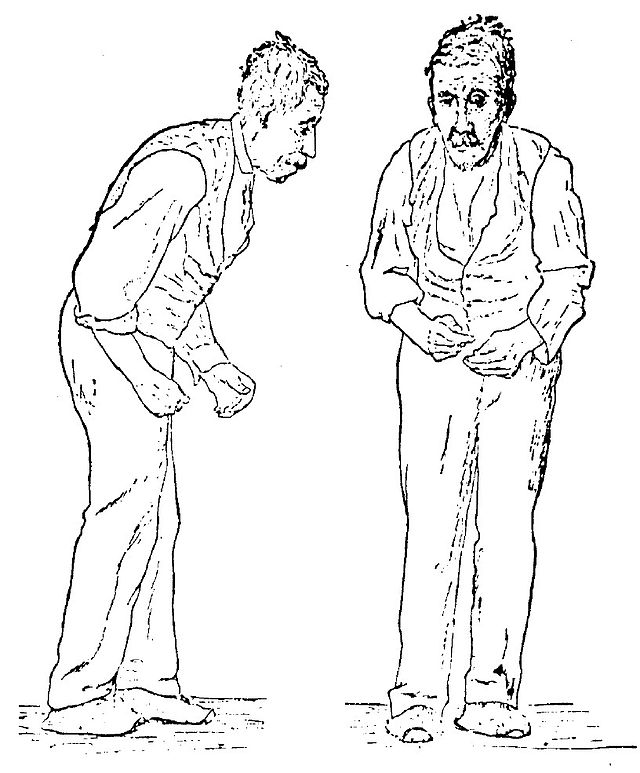
運動症状
主要症状は以下の4つである。安静時振戦、アキネジア(無動)、筋強剛が特に3主徴として知られて、これらの神経学的症候をパーキンソニズムと呼ぶ。
- 安静時振戦(resting tremor)
- 指にみられることが多いが、上肢全体や下肢、顎などにもみられる。安静にしているときにふるえが起こることが本症の特徴である。精神的な緊張で増強する。動かそうとすると、少なくとも一瞬は止まる。また、「タッピング様振戦」(Finger-tapping movement)や薬を包んだ紙を丸める動作に似ている「ピル・ローリング・トレマー」(Pill Rolling Tremor)も見られる。筋肉が安静な状態にあるときに起る。 完全にリラックスした状態であるにもかかわらず、腕や脚がふるえる。 症状が出ている筋肉を動かすと、振戦は目立たなくなったり、なくなったりする。 安静時振戦のふるえは、殆どのケースがゆっくりとした粗い動きである[53]。
- アキネジア(akinesia、無動)、寡動(bradykinesia)
- 動作の開始が困難となる。また動作が全体にゆっくりとして、小さくなる[54]。仮面様顔貌(瞬目(まばたき)が少なく大きく見開いた眼や、表情に乏しい顔貌)、書字障害(小字症)、構音障害などが特徴的である。ただし床に目印となる線などを引き、それを目標にして歩かせたり、障害物をまたがせたりすると、普通に大またで歩くことが可能である(kinésie paradoxale、逆説性歩行、矛盾性運動)。
- 筋強剛(筋固縮、rigidity)
- 力を抜いた状態で関節を他動させた際に抵抗がみられる現象。強剛(固縮)には一定の抵抗が持続する鉛管様強剛(鉛管様固縮、lead pipe rigidity)と抵抗が断続する歯車様強剛(歯車様固縮、cogwheel rigidity)があるが、歯車様強剛が特徴的に現れ、とくに手関節(手首)で認めやすい。純粋なパーキンソン病では錐体路障害がないことが特徴である。すなわち四肢の麻痺やバビンスキー反射などは認められないのが普通である。
- 仮面様顔貌は、顔面筋の筋強剛によるとされる説もある[55]。
- 姿勢保持障害(postural instability)
- バランスを崩しそうになったときに倒れないようにするための反射が弱くなる。すくみ足(歩行開始時に第一歩を踏み出せない)、小刻み歩行、前傾姿勢、突進歩行などが挙げられる。
多くの症例で、特に病初期に症状の左右差がみられる(一側性)。進行すると両側性に症状が現れ、左右差はなくなることが多い。マイヤーソン徴候(Myerson symptom)なども診断の参考になる。また、レボドパ投与が奏効する(症状が顕著に改善する)ことが特徴であり、これは他のパーキンソン症候群と本疾患を鑑別する上で重要な事実である。
嚥下障害を認めることがある。質問票では18.5%に、200mL飲水テストでは81%に嚥下障害がみられる。パーキンソン病患者の死因の1位は肺炎で22%を占めている。これは嚥下障害による誤嚥性肺炎によるところが大きい。
非運動症状
自律神経症状として便秘、嘔吐、流涎などの消化器症状、起立性低血圧、食後性低血圧、発汗過多、あぶら顔、排尿障害(神経因性膀胱)、勃起不全などがある[56]。
精神症状としては、感情鈍麻、快感喪失、不安、うつ症状、幻視・幻聴、認知障害などが挙げられる[57]。感情鈍麻はパーキンソン病のうつ症状に合併することが多い[58]が、単独でも現れる[59]。うつ症状はパーキンソン病の精神症候の中で最も頻度の高い症候とされてきたが、実際の頻度については定説がない[57]。最も用いられている数値は約40%である[60]。幻視も頻度の高い精神症候である。この症候は抗パーキンソン薬による副作用と考えられてきたが、近年ではそれだけでなく、内因性・外因性の様々な要素によって引き起こされるとする考え方が有力になっている[61]。以前は特殊な例を除き認知障害は合併しないといわれていたが、近年では後述のように認知障害を伴うパーキンソン病の例が多いとみなされるようになっている。
無動のため言動が鈍くなるため、一見して認知症またはその他の精神疾患のようにみえることもあるが、実際に認知症やうつ病を合併する疾患もあるため鑑別を要する。また、病的賭博、性欲亢進、強迫的買い物、強迫的過食、反復常同行動、薬剤の強迫的使用などのいわゆる衝動制御障害がパーキンソン病やむずむず脚症候群に合併することもある[62]。
流涎は特に構音障害、嚥下障害、あるいは物品呼称の低下と関連している[63]。
認知症を伴うパーキンソン病
パーキンソン病は、高い確率で認知症を合併する。27の研究のメタアナリシスによると、パーキンソン病の約40%に認知症が合併していた[60]。約30%というメタ解析データもあり[64]、その研究では全認知症症例の3.6%がパーキンソン病であった。パーキンソン病患者は、認知症を発症するリスクは、健常者の約5-6倍と見積もられており、パーキンソン病患者を8年間追跡調査した研究では、78%が認知症を発症した。
Remove ads
病型
要約
視点
パーキンソン病サブタイプ
運動症状に基づく分類
かつてはパーキンソン病は運動症状に基づいて、振戦優位型(tremor-dominant、TD)、無動・固縮型(akinetic-rigid, AR)、姿勢保持障害・歩行障害型(postural instability/gait difficulty, PIGD)、および混合型に分類されていた[65][66]。
- 振戦優位型(tremor-dominant、TD)
進行が緩徐で認知機能障害や転倒リスクが低く、レボドパなどドパミン作動薬への反応も良好と考えられている。このサブタイプは非運動症状を含めてクラスター分析をしたサブタイプ分析の運動優位型に相当すると考えられている。運動優位型は転倒、認知症、要介護状態に達するのに診断から14.3年、全生存期間は20.2年であった[67]。
- 無動・固縮型(akinetic-rigid、AR)
無動と固縮が目立ち歩行障害や姿勢保持障害は比較的軽度である。レボドパなどドパミン作動薬への反応も良好である。長期経過では幻覚など精神症状が出現しやすい。姿勢保持障害・歩行障害型(postural instability/gait difficulty, PIGD)との区別は難しい。
- 姿勢保持障害・歩行障害型(postural instability/gait difficulty、PIGD)
歩行障害や姿勢保持障害が初期から認められる。歩行障害の進行が速く、認知機能障害や自律神経障害など非運動症状の合併も多い。予後は不良である。レボドパなどドパミン作動薬への反応も限定的である。このサブタイプは非運動症状を含めてクラスター分析をしたサブタイプ分析の広汎悪性型に相当すると考えられている。広汎悪性型は転倒、認知症、要介護状態に達するのに診断から3.5年、全生存期間は8.1年であった[68]。
- 混合型(mixed type, combination type)
無動・固縮型と姿勢保持障害・歩行障害型の中間を示す[69]。
運動症状と非運動症状に基づく分類
運動症状と非運動症状を用いてクラスター分析を行いパーキンソン病をサブタイプ分析した研究がある[70]。この研究では少なくとも運動優位型,中間型,広汎悪性型の3群に分類されると考えられた。それぞれのサブタイプで病理学的な差異は見いだせなかった[71]。
- 運動優位型
運動優位型は転倒、認知症、要介護状態に達するのに診断から14.3年、全生存期間は診断後20.2年であった[72]。
- 中間型
中間型は転倒、認知症、要介護状態に達するのに診断から8.2年、全生存期間は診断後13.2年であった[73]。
- 広汎悪性型
広汎悪性型は転倒、認知症、要介護状態に達するのに診断から3.5年、全生存期間は診断後8.1年であった[74]。
前駆期パーキンソン病(Prodromal Parkinson disease)
レビー小体病を疑う運動症状や非運動症状を示さなかった剖検脳でレビー小体が認められた時、偶発的レビー小体病(incidental Lewy body disease、iLBD)という。60歳以上の無症候高齢者の10%程度に認められる。黒質の神経細胞の脱落は軽度で症状は示さないと考えられている。偶発的レビー小体病はレビー小体病の前段階を示唆している[75][76] 。 多系統萎縮症に偶発的レビー小体病を合併する例 [77]や大脳皮質基底核変性症に偶発的レビー小体病を合併する例 [78]が報告されている。
偶発的レビー小体病は病理学的な概念であり、パーキンソン病の診断基準を満たさないがレビー小体病を疑う運動症状や非運動症状やDATscanでの線条体のRI集積低下などバイオマーカーの異常を伴う場合は前駆期パーキンソン病(Prodromal Parkinson disease)などの概念を用いる[79] 。前駆期パーキンソン病(Prodromal Parkinson disease)はパーキンソン病の前段階である。パーキンソン病の診断基準を満たさないがレビー小体病を疑う運動症状や非運動症状やDATscanでの線条体のRI集積低下などバイオマーカーの異常を伴うものである。MDSの基準ではパーキンソン病を神経変性はあるが、症状と徴候を認めない場合(DATscanでの線条体のRI集積低下などバイオマーカーの異常を伴う)をpreclinical PDといい、症状と徴候を認めるがPDの診断基準を満たさない段階をProdromal PDといい、古典的な運動症状をもとにPDと診断できる段階をclinical PDという。Prodromal PDは尤度比を指標に確率論的に予測する。
Remove ads
検査
- 血液検査
パーキンソン病患者の脳に蓄積する、タンパク質α-シヌクレインの異常型を血液から検出することで早期発見につながる手法を順天堂大学などの国際研究チームが開発した[80][81]
- 頭部MRI
診断
要約
視点
1988年英国ブレインバンク診断基準
これまで世界的に最も使用された診断基準が1988年の英国ブレインバンク診断基準である[84]。この診断基準の最大の特徴は3つのステップによる診断の系統化と標準化が図られていることである。ステップ1はパーキンソニズムの存在の診断である。パーキンソニズムの中核症状は動作緩慢である。動作緩慢に加えて筋強剛、4~6Hzの静止時振戦、姿勢保持障害(視覚障害、前庭障害、小脳障害、深部感覚障害などによらない)のうち1つ以上認められることでパーキンソニズムの診断としている。第2ステップはパーキンソン病らしからぬ16項目を除外する作業である。第3ステップにはよりパーキンソン病らしい8項目を挙げており、そのうち3つ以上を満たした場合に最終的にパーキンソン病と診断する。この診断基準は病理診断の陽性的中率は80~90%である[85][86]。1988年英国ブレインバンク診断基準の妥当性も検討されている。運動障害の専門家の臨床診断をゴールドスタンダードとした場合は1988年英国ブレインバンク診断基準の感度は89.2%で特異度は79.2%であった[87]。
2015年MDS診断基準
2015年にInternational Parkinson and Movement Disorder Society(MDS)が提唱したパーキンソン病の診断基準である[88]。この診断基準は診断の特異度が90%を目標とした厳格な診断基準(clinically established PD)と感度・特異度が80%以上を目標とした実用的な診断基準(clinically probable PD)の2つのレベルからなっている。パーキンソニズムの定義、支持基準、絶対的除外基準、red flagsの4つのパートからなる。パーキンソニズムの定義は動作緩慢に加えて、静止時振戦か筋強剛のどちらか1つまたは両方がみられるものと定義している。パーキンソン病において姿勢保持障害は進行期に出現するため、早期ではむしろ他疾患を示唆すると考え診断基準に姿勢保持障害が含まれていない。2015年MDS診断基準の妥当性が検討されている。運動障害の専門家の臨床診断をゴールドスタンダードとした場合、2015年MDS診断基準は感度94.5%であり特異度は88.5%であった[89]。病理診断をゴールドスタンダードとした検討もある[90]。発症から5年以内の早期と進行期で感度、特異度が検討されている。早期ではclinically established PDは感度58.2%で特異度99.2%であった。clinically probable PDでは感度87.9%で特異度91.3%であった。進行期ではclinically established PDは感度63.1%で特異度99.2%であった。clinically probable PDでは感度87.9%で特異度97.6%であった。
治療薬の開発では特異度が高い発症5年以内の診断基準が必要である。MDSではclinically established early PDという診断基準を発表している[91] 。この診断基準の感度は69.8%で特異度は95.4%であった。
鑑別疾患
分類不能のパーキンソニズム(unclassifiable parkinsonisms)
分類不能のパーキンソニズム(unclassifiable parkinsonisms)は英国ブレインバンク診断基準やMDS診断基準でパーキンソン病や進行性核上性麻痺などパーキンソニズムを示す疾患の診断基準を満たさない一群である[92] [93] 。MDS診断基準以前に分類不能のパーキンソニズムと診断された例の30~50%が進行性核上性麻痺に再分類される[94] 。またこの検討は臨床診断の再分類であり、病理学的な検討ではない。パーキンソン病と進行性核上性麻痺の合併例で臨床診断が分類不能のパーキンソニズムになることがある[95]。
SWEDDs(scan without evidence of dopaminergic deficits)
SWEDDs(scan without evidence of dopaminergic deficits)は臨床的にはパーキンソニズムが存在するがDATイメージングでは明らかな集積低下を認めない例である。2015年MDS診断基準では絶対的除外基準に該当する。SWEDDsはパーキンソン病の可能性は低いと考えられている[96] [97] 。その一方で最終診断がパーキンソン病になる例も報告されている[98]。
Remove ads
重症度
ホーン・ヤールのスケールでは1から5までの病期(ステージ)に分類される[2]。
- ステージ1 一側性のパーキンソニズム。
- ステージ2 両側性パーキンソニズム。
- ステージ3 軽度〜中等度のパーキンソニズム。姿勢反射障害あり。日常生活に介助不要。
- ステージ4 重篤な障害を示すが、歩行は介助なしにどうにか可能。
- ステージ5 介助が無ければベッド又は車椅子での生活、歩行は不能。
運動症状・非運動症状を含めた各症状を総合的に評価する方法としては、パーキンソン病統一スケール(Unified Parkinson's disease rating scale, UPDRS)[99]がある。
治療
要約
視点
2022年時点、パーキンソン病に対する根本的な治療法は無い。日常生活動作(ADL)を向上させたり、生命予後を延長したり、運動症状や精神症状、自律神経症状などの非運動症状に対する治療がほとんどである。しかしながら、神経変性の機序が明らかになるにつれ、変性すなわち症状の進行を遅らせるための治療法(神経保護薬による治療法)が試みられるようになってきた。また、変性した神経を再生させる遺伝子治療や幹細胞移植などの根本治療も現実的なものとして視野に入っている[100]。ここではまず現実的な治療について概説し、さらに新しい治療についても現在の到達点と将来的な見通しを記す。
日本では1978年10月1日に特定疾患治療研究事業対象疾患に指定され、公費受給が可能となった(ホーン・ヤールのスケールのステージ3以上が認定の目安となるため、病初期の治療は健康保険の範囲内で自己負担となる)。
運動症状に対する治療
薬物療法
1960年代のレボドパ(L-ドパ)大量投与療法の開始以来、運動症状を改善させる種々の薬物が開発・発見され、パーキンソン病は神経変性疾患の中では唯一効果的な (対症療法ではあるが) 治療の選択肢が多い疾患である[101]。また、早期パーキンソン病と運動合併症の現れる進行期でも治療法は異なっている(後述参照)。
抗パーキンソン病薬には副作用 (有害事象) があり、例えばレボドパは長期服用によって運動合併症を引き起こす。また多くの抗パーキンソン病薬治療下で、悪性症候群が起こりうる。幻覚・妄想の出現も主な合併症の一つである。なお、ドパおよびドパミンは、それぞれドーパ・ドーパミンと同じものだが医学・医療における一般的な呼称なので[102][103]、本項ではドパ・ドパミンを用いる。
ドパミン補充療法
レボドパ
ドーパミンの前駆物質であるドパ(レボドパ、L-ドパ) を投与する。ドーパミンを直接投与しないのは、ドーパミンが血液脳関門を通過できないためである[104]。ドパミン脱炭酸酵素阻害薬であるカルビドパまたはベンセラジドとの合剤を用いることが多い。
1960年代に臨床応用されて以来、薬物治療のゴールデンスタンダードであり、主に運動症状(3主徴) に対して極めて有効に働く。振戦の改善はその他の抗パーキンソン病薬に比べるとマイルドである。十分な量の投与で、運動機能が長期間良好に維持され、クオリティ・オブ・ライフ(QOL)の改善、生存期間の延長につながる。
日本では、レボドパに対する重量比で10%のカルビドパが配合されたL-DOPA/カルビドパとしてメネシットや、ネオドパストンとレボドパに対する重量比で25%のベンセラジドが配合されたL-DOPA/ベンセラジドとしてイーシードパールやマドパー、ネオドパゾールが知られており、L-DOPA/DCIと総称される。さらにL-DOPA/カルビドパ/エンタカポンとしてスタレボが知られている。
L-DOPA/DCIは、中枢刺激回数をできるだけ均一にする意味において150mg分3で開始することが多く、維持量は300mg分3から600mg分3程度になることが多い。導入時に患者が嘔気、眠気、だるさを訴えることがある。一般的にベンセラジド製剤のほうがDCIの含有が多いため、血中濃度のピークが上昇しやすく、導入時の副作用出現率がやや高い。しかし1日量300mg程度の低容量では、ベンセラジド製剤の方が、カルビドパ製剤よりも優れた臨床効果を示すことがある。
発症早期のパーキンソン病において、レボドパはドーパミンアゴニスト(ドパミン受容体刺激薬)やモノアミン酸化酵素阻害薬(MAO阻害薬)と遜色が無い効果を示す[105]。長期に渡る服用により、日内変動(オン・オフ現象(突然薬の効果がきれ体が動かなくなる)やウェアリング・オフ現象(内服直後や時間がたった時に効果が突然切れる))、ジスキネジアといった副作用(運動合併症)が表出する。
レボドパやドパミン受容体刺激薬を投与すると、悪心・嘔吐の副作用が出ることが多いが、これに対する治療としての制吐薬には、パーキンソニズムを悪化させるものが多い。メトクロプラミドはこの用途には用いず、ドンペリドンを用いるのが一般的である。消化器症状の既往がある場合は、開始時に限定してドンペリドン30mg分3をL-DOPA/DCIに併用する場合もある。
→詳細は「パーキンソン症候群 § 分類」を参照
運動合併症を改善できるよう、新たな剤型や誘導体が開発・製品化されている (後述)。レボドパ製剤の経口投与ができないパーキンソン病、パーキンソン症候群の患者には点滴製剤がある。点滴製剤はかつては少量投与しかできなかった[106]。
なお、このタイプの薬の意外な副作用として、ギャンブル依存症に陥ることがある。これは、過剰なドーパミンの作用による[107]。
ドーパミンアゴニスト
ドーパミン受容体刺激薬とも呼ばれる。麦角系としてカベルゴリン(商品名カバサール)、ペルゴリド(商品名ペルマックス)、ブロモクリプチン(商品名パーロデルなど)、非麦角系としてプラミペキソール(商品名ビ・シフロール)、ロピニロール(商品名レキップ)、タリペキソール(商品名ドミン)などがある。レボドパ製剤と比較してウェアリングオフやジスキネジアを起こしにくいことから、認知症を伴わない70歳未満の患者については、レボドパではなくこちらを第一選択とすることが推奨されている[108]。幻覚(幻視が主である)などの精神症状が強く出やすいため、認知障害のある患者では投与を避ける。
また麦角系ドパミンアゴニストでは重篤な副作用(心臓弁膜症や間質性肺炎など)を起こすことがわかり[109]、新たに投与を開始する場合はまず非麦角系薬を選択し、治療効果が不充分であったり忍容性に問題があるときのみ麦角系薬を使用する[110][111]ことになっている(その場合、投与開始前および開始後定期的に心臓超音波検査をはじめとするフォローが必要である)。ただし、非麦角系薬にも突発的睡眠などの副作用がある。また、急に内服を中止すると悪性症候群などの重篤な副作用を引き起こすことがある[112][113]。
アポモルヒネはドパミン受容体のうちD1およびD2受容体の作動薬で、即効性がある。すでに1950年代からパーキンソン病への適応が検討されていたが[114]、初回通過効果を受けやすいため経口薬としては使えなかった。その後、皮下注射薬が開発されて即効性と半減期の短さから、進行期のオフ症状に対するレスキュー役として使われるようになった(日本では2012年3月承認)。さらに持続的に皮下注射を行っている国もある[115]。
モノアミン酸化酵素B阻害薬
選択的不可逆的モノアミン酸化酵素B(MAO-B)阻害薬である。中枢内に多く存在し、ドーパミンの代謝経路として働くモノアミン酸化酵素(MAO-B)を選択的に阻害することで、ドーパミン濃度を高める働きがある。
セレギリンが日本のパーキンソン病の薬として初めて使用されるようになったMAO-B阻害薬である(商品名:エフピー-OD。アンフェタミン骨格を有するため覚醒剤原料に該当[116])。セレギリンは治療量内ではMAO-Bに対して選択的に働くが、高用量になるとMAO-AおよびMAO-Bに対して非選択的に阻害することがある。また、進行期パーキンソン病の運動合併症であるジスキネジアの発現を増強するため、ジスキネジアが出現した場合には投与を中止する。
セレギリンは神経保護作用もあるといわれているが、その効果については報告によって違いが見られ、議論が分かれている。カテコール-O-メチルトランスフェラーゼ(COMT)阻害薬と異なり、MAO-B阻害薬単独でも効果はあるといわれている(NHS <英国国立医療技術評価機構によるガイドラインNICE[117]あるいは国際運動障害学会によるレビュー[118]などの推奨)が、日本ではレボドパとの併用のみが認められている。
セレギリンは代謝されアンフェタミン、メタンフェタミンが産出され、覚醒方向に働き不安、不眠の副作用が生じることがあり、夕方の内服は避けられる傾向がある。ウェアリングオフやすくみ足といった他の抗パーキンソン病薬では効果が低い症状に有効である。しかしピークドーズジスキネジアは出現しやすくなる。そのため早期パーキンソン病ではレボドパの開始と同時期に開始し、病気の進行を遅らせたり後期パーキンソン病で幻覚や認知症のない例でウェアリングオフが認められジスキネジアが認められない例で用いられる場合が多い。ペチジン、三環系抗うつ薬、選択的セロトニン再取り込み阻害薬(SSRI)とは急性の中毒性相互作用(セロトニン症候群)が知られている。また血圧を下げる作用があるため起立性低血圧が認められる場合は増悪する可能性がある。またMIBGシンチグラフィーの検査に影響を与えることが知られている。
ラサギリンは、セレギリン同様に選択的MAO-B阻害薬だが、セレギリンと異なり代謝されてアミノインダンとなる。セレギリンの代謝産物であるアンフェタミン・メタンフェタミンが神経毒性を持つのに対して、アミノインダンは神経保護作用を持つ可能性がある[119][120]。早期パーキンソン病に対して単独投与での運動症状改善が示されており[121][122][123]、また進行期のオフ時間を減少させることも明らかになった[124]。先行してヨーロッパ (2005年) やアメリカ合衆国 (2006年) では発売され、日本では2014年3月にイスラエルの製薬会社と製品化に関する契約を締結[125]した日本の製薬会社が2018年3月に国内製造販売の承認を受けた[126] (商品名:アジレクト。劇薬に指定[127]。同年5月22日、薬価基準に収載され[128]、6月11日に販売を開始[129])。
その他の抗パーキンソン病薬
- COMT阻害薬
- 中枢外に存在するドーパミン代謝経路の酵素であるカテコール-O-メチル基転移酵素(COMT)を阻害する薬剤である。末梢でのレボドパ分解を抑制して中枢への移行性を高めるための薬剤であり、レボドパとの併用のみで用いられる。エンタカポン(商品名:コムタン)およびトルカポンが開発されているが、トルカポンは致死的な肝障害の副作用が見られたため、現在米国以外では使用されていない。日本ではエンタカポンが2007年1月に承認されている。ウェアリングオフ現象の改善に有効であるが、ジスキネジア、精神症状の増悪が認められることがある。
- ドパミン放出促進薬
- アマンタジン(商品名:シンメトレルなど)は、もともとインフルエンザ治療薬として開発されたが、本剤を投与されたパーキンソン病患者の運動症状が改善されたことから、抗パーキンソン病薬としても認められるようになった。NMDA型グルタミン酸受容体に対する拮抗作用があり、これが抗パーキンソン作用の原因となっているという考えがある。アマンタジンはセレギリンと同様に覚醒させる方向に働くとされており、朝、昼に内服する場合が多い。初期パーキンソン病の運動障害の改善の他、運動障害を悪化させずにジスキネジアを改善させる作用がある。運動障害の改善のためには100 - 200mg/dayの投与で十分であるが抗ジスキネジア作用を期待するには300mg/day以上の投与が必要である。腎排泄性の薬物であり高齢者の投与の場合は減量が必要である。血液透析で除去されにくいのも特徴である。また高齢者、腎機能障害者に投与した場合、副作用である幻覚やミオクローヌスが出現しやすい。ミオクローヌスと振戦の区別が難しい場合もある。その他の副作用としては網状皮膚斑などが知られている。
- 抗コリン薬
- アセチルコリン受容体のうち、ムスカリン受容体をブロックしてアセチルコリンを減少させる薬剤である。最も古くから使用されている抗パーキンソン病薬であり、19世紀から天然アルカロイドが用いられていた。1949年に合成薬トリヘキシフェニジルが開発されて以来、様々な薬剤が使われている。主な抗コリン薬としては他にビペリデン、プロフェナミン、メチキセンなどがある。2002年のガイドラインではあくまで補助的な薬物として位置づけられている。前立腺肥大症、緑内障の患者では禁忌であり、幻覚、妄想、せん妄、認知症の増悪も認められるため認知症が認められる患者や高齢者ではあまり用いられない。少量から開始し、中止する場合もゆっくりと減量をする。
- フェノチアジン系抗ヒスタミン薬であるプロメタジン(商品名ピレチアなど)は安静時振戦の緩和作用が知られている。中枢性抗コリン作用を持つためである。鎮静作用が強く、不眠改善の作用もある。
- ノルアドレナリン作動薬
- ドロキシドパは日本で開発されたノルアドレナリンの非生理的な前駆物質である。すくみ足やアキネジア(無動)、起立性低血圧に効果があるとされる。
- ゾニサミド
- 元来は日本で開発された抗てんかん薬である。てんかんを合併したパーキンソン病患者の治療過程で、偶然にパーキンソン病の運動症状に対する効果のあることが示唆された[130]。その後の大規模二重盲検試験では進行期パーキンソン病の運動症状を改善し、特に進行期のウェアリングオフ現象のオフ時間を短縮する効果が明らかにされた[131]。その作用機序は、線条体でのチロシン水酸化酵素(チロシンからドパミンを生成する反応の律速酵素)産生を高めてドパミン合成量を増やすこと、ある程度のMAO-B阻害作用を持つことなどが考えられている[132]。
新しい抗パーキンソン病薬
既に実用化されている、もしくは臨床試験の段階にあるもの。新薬ではないが、新しい概念・目的で作られた剤型のものも解説する。
持続性ドパミン刺激
CDS(continuous dopaminergic stimulation)の訳語。レボドパの長期間投与の副作用であるウェアリングオフ・ジスキネジアなどの出現を遅らせたり抑止したりすること、あるいは出現した症状を軽減することが長年課題となってきた。この目的のために、ドーパミン受容体を持続的に刺激する方法が指向されている (運動合併症の機序は後述)。
- レボドパ/カルビドパの持続的空腸内投与(商品名デュオドーパ)
- レボドパとカルビドパの合剤をゲル状にしたものを、造設した胃瘻を通じて空腸内に留置したチューブから持続的に投与する方法、薬液はポンプにいれて携帯する[115]。進行期パーキンソン病において、既存の多剤内服療法に比べてオン時間の延長を認め、ジスキネジアの増悪もなくQOLの向上が見られる[133]。また安全性も高く、そのためアポモルヒネ持続注射法や (視床下核脳深部刺激に代表される) 外科的治療が無効だったり、適応が元々なかったりする場合には最後の砦となる治療法である[134]。2016年に日本でも承認された。
- レボドパ徐放剤
- IPX066は経口のレボドパ/カルビドパ合剤で、導入が検討されている。
- エチレボドパ
- レボドパのエチル化誘導体であるエチレボドパ[135]やメチル化誘導体のメレボドパ[136]。水溶性でレボドパに比べて吸収が早くなること、それによってno on、delayed onの改善が予想され、レボドパに代わるという期待がかけられている。
- ロチゴチン(商品名ニュープロパッチ)
- 非麦角系ドーパミンアゴニストの貼付剤 (皮下投与薬)。経口の徐放剤に同じく1日1回貼付となる。早期・進行期でともに有意な運動症状の改善を認め、進行期でのオフ時間の短縮もプラミペキソールと同等である[115]。
- ドパミンアゴニスト徐放剤
- プラミペキソール徐放剤、ロピニロール徐放剤が開発され製品化されている。いずれも1日1回の内服となり、ドーパミン受容体への持続的な刺激が期待できるだけでなく、患者にとっても利便性が向上する。
アデノシン受容体拮抗薬
アデノシンA2a受容体に対する選択的拮抗薬であるイストラデフィリン は、低容量のレボドパとの併用で抗パーキンソン効果をあらわした。さらに維持量のレボドパ投与に比べてジスキネジアを軽減し、レボドパの半減期を延長した[137]。アデノシンA2a受容体は線条体から淡蒼球に投射するニューロン上で多く発現しており、ドパミンD2受容体・代謝型グルタミン酸受容体などと機能的な2量体を形成することもある。この受容体への刺激はドパミンD2受容体の働きに拮抗している。そのためA2a受容体を遮断することは、ドパミン刺激を介さずに抗パーキンソン作用を示すことになる[138]。2013年に日本でイストラデフィリンが発売された(商品名:ノウリアスト)。一方で2013年にメルクはプレラデナントは臨床試験で効果なしとして中断された。
グルタミン酸受容体作動薬
ドパミン放出効果を持つアマンタジンはグルタミン酸受容体のうちNMDA型の拮抗薬である。その他の受容体ではAMPA型の拮抗薬の抗パーキンソン効果が期待された[139]。AMPA受容体拮抗薬であるペランパネルは臨床試験で安全性は認められたもののパーキンソン病の運動症状を改善する効果は認められなかった[140]。このような状況で、エーザイはペランパネルの抗パーキンソン病薬としての開発を断念した[141]。
新薬開発
英国キュー王立植物園の2017年年次報告書によれば、医療に利用できる植物は全世界に2万8000種以上存在し、それにはパーキンソン病治療に利用されるツル植物9種も含まれるが、規制当局による文書化が進んでおらず大半が未活用のままであると指摘している[142]。
外科療法

パーキンソン病に対する外科的アプローチは20世紀前半から行われていた。1950年代に視床VL,Vim核、淡蒼球内節、視床下核破壊術が確立したが、その後にこれらの部位に電極を埋め込む脳深部刺激療法(Deep brain stimulation therapy, DBS)が開発され、現在はこの方法が一般的である。
外科療法の適応となるのは、レボドパによる治療効果があり、治療が十分に行われたが日常生活動作(ADL)に障害をきたしている場合である。ただし認知障害があったり著しい精神症状がある場合、重篤な全身疾患がある場合には適応除外となる。年齢による適応の制限はない。施設によって適応の基準も異なるため、70歳以下であること、薬が効いているときに独歩可能なレベルであることなどが適応の基準になる場合もある[143]。
- 視床の手術
- 視床Vim核の刺激術は振戦の改善に有効であり、本態性振戦で用いられることもある。VL核の刺激術は筋固縮やジストニアのような筋緊張の亢進は改善するものの無動に対しては効果が薄い。
- 淡蒼球内節の手術
- GPiの刺激術は全てのパーキンソン病の症状を改善させる。特にオン時のジスキネジアの改善に効果的である。しかし振戦の改善は視床Vim核の手術ほどの改善は見込めない。レボドパの減量効果も視床下核の手術ほどではない。ジストニアの治療のターゲットとしても注目されている。
- 腹側視床後部、不確帯尾側部の手術
- 振戦や筋固縮を強く抑制し、小字症、アキネジア(無動)、姿勢保持反射や歩行障害に有効である。ジスキネジアに対する抑制効果も報告されている。
- 視床下核の手術
- 効果がレボドパに類似しておりレボドパの減量が期待できる。しかし長期的には認知機能の低下や歩行障害、うつの発生などが認められる。
- 脚橋被蓋の手術
- 十分なデータが蓄積されていない。
リハビリテーション
非運動症状に対する治療薬
自律神経症状や精神症状に対しては、それぞれの症状に対する治療薬を用いる。抗精神病薬は、フェノチアジン系やブチロフェノン系などの定型抗精神病薬にパーキンソニズムを誘発する副作用があるためほとんど用いられない。現在推奨されているのは、クロザピン、クエチアピン、オランザピン、リスペリドンなどの非定型抗精神病薬である。
早期パーキンソン病の治療
まず最初になされることは、パーキンソン病がどのようなものか (経過と治療法、予後など)をきちんと説明されること。次には薬物治療開始のタイミングを観察すること、さらにリハビリテーションを開始することなどである。
- 診断がついた時点ですぐに始めるべきとする意見
- ある程度日常生活に支障が出た時点で始めるべきという意見
- できるだけ開始を遅らせるべきとする意見
上記3つの内の第2の意見がコンセンサスとなっていた。レボドパの長期服用による運動合併症の発現をできるだけ遅らせるため、またレボドパ自体が神経毒であるという説があった[145]ためである。しかし、いくつかのランダム化比較試験(たとえば[146])でレボドパがプラセボ群に対して有意に運動症状の改善を認め、レボドパ投与によるパーキンソン病の進行ではなく、逆に早期からのレボドパ投与で運動機能がよく保たれる可能性が認められた。また(レボドパの投与期間を短縮する目的でも)治療開始を遅らせることは、それによって神経変性が予防されて病気の進行が遅くなるわけではない。
進行期パーキンソン病の治療
レボドパ長期内服で生じる運動障害の対応
パーキンソン病が進行すると、いずれはほぼレボドパ治療が必須となるが、レボドパの長期服用は 日内変動や運動合併症という問題を引き起こす。
- ウェアリングオフ
- レボドパ製剤の半減期は60 - 90分であるが早期パーキンソン病ではその効果が切れることを体感することはほとんどない。しかし進行期パーキンソン病では次の内服時間の前に運動障害が悪化するウェアリングオフが認められることがある。この場合は症状日誌[149]や、パーキンソン病患者自己評価スケール[150]で症状の変動、オフ期の有無を評価する。そしてジスキネジアが増悪しないように内服調節を行う。具体的には、オフの時間帯に合わせてレボドパを追加する、COMT阻害薬を追加する、ドパミンアゴニストを追加、変更、増量しオフ時状態の改善(底上げ)を行う、MAO-B阻害薬を追加するといった方法がある。内服調節でコントロールが困難な場合は脳深部刺激療法も考慮する。
- 不随意運動
- 振戦以外にパーキンソン病治療薬によって不随意運動が生じることがある。ジスキネジアが一般的であるが、ジストニア、バリズムが起こることも知られている。レボドパの血中濃度が最大の時に生じるピークドーズジスキネジア、急激な濃度変化でおこる二相性ジスキネジア、薬効が切れた時に生じるオフジストニアがよく知られている。内服調節で改善することもあるが治療は難渋する場合が多い。定位脳手術が施行されることもある。
先端的な治療
遺伝子治療
パーキンソン病に対する遺伝子治療では、3 種類の戦略に基づく臨床試験が実施されている。第一はドパミン合成に必要な酵素遺伝子を被殻に導入してドパミン産生を行なう方法、第二は神経栄養因子ニュールツリンの遺伝子を被殻で持続的に発現させることにより黒質緻密部ドパミン神経細胞の変性を抑制する方法、第三は抑制性神経伝達物質GABAの合成に必要なグルタミン酸脱炭酸酵素(GAD-65,GAD-67)の遺伝子を視床下核に導入して神経活動の調整を行なう方法である[151]。
パーキンソン病や、全身の筋肉が衰える難病である筋萎縮性側索硬化症(ALS)の患者に、正常な遺伝子を投与する遺伝子治療の臨床試験(治験)を、2019年にも自治医科大学などのチームがそれぞれ始める予定で、1回の治療で長期間、症状改善や病気の進行を抑えられる可能性があり、数年後の治療薬の実用化を目指している。[152]。
細胞移植治療
2008年4月、人工多能性幹細胞(iPS細胞)から作り出した神経細胞を使い、パーキンソン病のラットを治療することに、マサチューセッツ工科大学のルドルフ・ヤニッシュ教授らのグループが成功した[153]。研究グループはマウスの皮膚からiPS細胞を作り、神経伝達物質のドパミンを分泌する細胞に分化させた。パーキンソン病を人工的に発症させたラット9匹の脳に移植したところ、8匹の症状が改善、特有の異常動作がなくなった。移植した細胞がラットの脳内に定着し、ドパミンを正常に分泌したとしている。2017年8月30日、京都大学iPS細胞研究所が人間のiPS細胞から作ったドーパミン神経細胞をパーキンソン病のサル11頭に移植し経過を観察した結果を発表した。その結果、運動能力の低下や手足の震えなどの症状が軽減し、運動量が増えた[154][155][156][157]。
2014年2月、京都大学iPS細胞研究所の高橋淳らのグループがドーパミンを分泌する神経細胞を大量に作製する方法に成功[158][159]。研究グループは同年6月に、パーキンソン病の臨床研究のための安全性の審査手続きを厚労省に申請した[158]。同申請は2013年11月に成立した再生医療安全性確保法に基づいた初めての臨床研究になる見込みとなった[158]。
2018年11月9日、京都大学の高橋淳らのグループは、iPS細胞から育てたドーパミンを分泌する神経細胞を作製し、2018年10月に患者の脳の左側に約240万個の細胞を、特殊な注射針で移植したと発表した[160][161][162][163]。iPS細胞から作った神経細胞をパーキンソン病患者に移植した手術は世界初の成果となり、日本国内でのiPS細胞の移植は加齢黄斑変性に続いて2番目となる[160][161][162][163]。また本研究は「臨床研究」ではなく、保険収載を念頭においた「臨床試験(治験)」であり、iPS細胞の移植の臨床試験は日本国内において初となる[160][161][162][163]。研究チームは今後2年をかけて安全性と治療効果を評価するとしている[160][161][162][163]。
2023年12月、iPS細胞を利用した治験がアメリカで行なわれることが報道される[164][165]。
2025年4月、iPS細胞で作った神経細胞の移植による治験で4名の患者の症状が改善したと報道された[166][167]。
→「人工多能性幹細胞 § パーキンソン病の治療」も参照
経頭蓋磁気刺激(TMS)療法
経頭蓋磁気刺激(TMS)療法ならびに、反復経頭蓋磁気刺激(rTMS)療法がパーキンソン病に効果があることが示されている[168]。
その他の知見
タンパク質のSept4が、パーキンソン病の原因物質と考えられるα-シヌクレインの蓄積を抑える性質を持っていることが確認された[169]。
パーキンソン病の患者の血液中にはアミノ酸のトリプトファン、カフェイン、タモギタケ(品種:えぞの霞晴れ33号など)などに含まれるエルゴチオネインの濃度が低く、病気との関係性が示唆されている[170]。in vitroの試験では、エルゴチオネインはパーキンソン病様症状を誘発する神経毒である6-ヒドロキシドーパミン(6-OHDA)から神経細胞死を抑制することが報告された[171]。
東洋医学的な治療
漢方薬や鍼灸では、証を見分け個別に治療を変えることから、患者一人一人に対して治療方針が大きく変わるため、下記は症例、治療例となる[172]。
漢方薬
パーキンソン病に対して、基礎体力をつけることを目的とし柴胡桂枝湯、五苓散、八味丸といった漢方薬を処方する。その後、小承気湯と芍薬甘草湯を処方した。個別事例では、手の震えがほとんど止まるという効果が出た[173][174]。茨城県内における2007年の調査ではパーキンソン病患者で漢方薬治療を受けた経験があるのは11.7%である[175]。
パーキンソン病に伴う幻覚などの精神症状は頻度の高い症状であるが、抑肝散が時に有効である。また、胃排出能低下はL-ドパの吸収を遅延させ運動症状を悪化させる。これに対しては六君子湯が推奨される。排便障害も代表的な非運動症状である。多系統萎縮症およびパーキンソン病に対して大建中湯を用いた報告では、大建中湯は大腸通過時間を短縮させることが示された。患者20例に対する六君子湯の3カ月連続投与での検討では、67%の症例で改善を認めている[176]。麻子仁丸でも患者の便秘に対する報告があり、便秘のある患者23例に対する1カ月後の評価では、有効率は78.8%であった[177][178]。食欲について評価するため、六君子湯を投与する前後の食欲スコア(食欲に対するVisualAnalog Scale:VAS)の変化、副次評価項目は胃排出時間、血漿中アシルグレリン濃度、抑うつ(Self-rating Depression Scale:SDS)、消化器症状QOL(Gastrointestinal Symptom Rating Scale:GSRS)の変化についてオープンクロスオーバー比較試験を行い、4週間投与後においてSDSとGSRSにおける腹痛スコアで改善が認められている[179]。
鍼灸治療
明治国際医療大学の調査では、パーキンソン病そのものの完治は見られなかったもののパーキンソン症状や運動機能の改善が見られた[180]茨城県内における2007年の調査ではパーキンソン病患者で鍼灸治療を受けた経験があるのは10%以下である[175]。
予後
要約
視点
パーキンソン病は、それ自体で生命を落とす疾患ではない。パーキンソン病患者の死因としては、臥床生活となった後の身体機能低下による感染症(気道感染や尿路感染症)、転落による外傷などが原因となることが多い。運動症状を改善させる治療法が進んだために、生命予後は改善しているとみられるが、総合的な検討はまだなされていない[181]。
遺伝子異常
近年、少なからぬ数の特定遺伝子の突然変異がパーキンソン病の原因となることが発見されている。この中には相当数の患者が存在する地域(イタリアのコントゥルシ・テルメ)もある。遺伝子の変異で、パーキンソン病患者のごくわずかについては説明がつく。患者の中には、血縁者の中にやはりパーキンソン病患者がいることがある。
家族性パーキンソン病の原因として同定されている遺伝子には以下のものがある[182][183]。
遺伝子異常と家族性パーキンソン病
- ピンク1(PTEN 誘導性推定キナーゼ1タンパク、PINK1)をコードする PINK1 遺伝子の突然変異による。ピンク1はミトコンドリアに局在するキナーゼで、その変異による発症数はまれではある[191]が、臨床型は PARK2 と非常によく似ており、ピンク1がパーキンと同じ経路で働いていることが明らかになった[192][193]。ミトコンドリアは活性酸素やその他の毒素などに傷害されると呼吸能が低下し、その結果外膜の膜電位が低下する[194]。するとピンク1が膜上で自己リン酸化してパーキンを外膜に蓄積させ、パーキンは膜上のタンパクをユビキチン化する[195]。このように、ピンク1はパーキンと協調して損傷した異常ミトコンドリアを処分する(オートファジー = ミトファジーを誘導する)ことで「ミトコンドリアの品質管理」を行なう。ピンク1遺伝子の変異は不良なミトコンドリアを蓄積させ、神経細胞の変性につながると考えられる[196]。
- リソソームに局在するタイプ5-P型ATPアーゼ をエンコードする ATP13A2 遺伝子の変異によって起こり、Kufor-Rakeb症候群としても知られる[201]。レボドパに反応するパーキンソン症状、錐体路徴候、認知機能障害、核上性上方注視麻痺などを表現型とする[202]。本来、α-シヌクレインは選択的に、シャペロン介在性オートファジー (リソソームに運ばれて分解される) を受ける (ミトファジー) [203]。ATP13A2の変異によってタイプ5-P型ATPはリソソームではなく小胞体に集積しており[204]、その結果リソソームの機能不全が起こってα-シヌクレインが蓄積し、神経変性を引き起こすのだろう[205]。
- Parkinson-pyramidal症候群またはPallido-pyramidal症候群とも呼ばれ、FBXO7遺伝子の突然変異によって起こる。臨床症状はPARK9に類似する。
孤発性パーキンソン病の原因仮説
孤発性パーキンソン病は、多くの遺伝子と環境因子が原因となる多因子疾患だと考えられている。上記の家族性パーキンソン病の研究などから様々な原因やその機序の仮説が立てられ、ほぼ一致をみているものも多い。以下に説明する仮説も競合・排他的なものではなく、これらの要因が積み重なることで発病に至ると考えられる。
- ミトコンドリア機能障害仮説
- MPTPやロテノン[211]、アンノナシン[212]といったミトコンドリアに機能障害を起こす薬物により、ヒトや実験動物においてパーキンソン病様の病態が起こること、孤発性のパーキンソン病においてミトコンドリアの呼吸鎖の機能障害が観察されることから、パーキンソン病原因の一つの仮説としてミトコンドリアの機能障害が想定されている。
- ミトコンドリアは外膜と内膜の二重の膜からなり、好気呼吸が行われる場所である。特に内膜上には酸化的リン酸化を行い、最終的にATP産生にかかわるタンパク複合体およびATP合成酵素が存在する。タンパク複合体は4種類あって、順にIからIVと呼ばれる。このタンパク複合体が電子伝達を行いながらH+(プロトン)を内膜の内側(マトリックス側)から外側に輸送することでプロトン勾配を形成、その結果生じる膜電位によって、ATP(アデノシン三リン酸)が産生される。このプロトン勾配=膜電位は、さらに細胞質内のCa2+濃度維持、TCAサイクルなどの代謝反応、ミトコンドリアと細胞質相互間の物質輸送などのもととなる[213]。詳細は「ミトコンドリア」の項を参照。
- MPTPは1970年代にデザイナードラッグとして合成されたMPPPという物質に混入していた[214]。MPTPは脳内(主にアストロサイトとセロトニン作動神経)に存在するモノアミン酸化酵素(MAO, 主としてMAO-B)に代謝されてMPP+となり、これが毒性を持つ。ロテノンは農薬として長く使用されている。またカリブ海諸島で常食されるトゲバンレイシ(サワーソップ)中にアンノナシンが含まれている。これらの物質はいずれもミトコンドリア複合体Iの阻害薬である。また一酸化炭素(CO)中毒でもパーキンソニズムを呈し、淡蒼球の壊死が見られた[215]、COは複合体IVの阻害薬である。
- 遺伝子異常の項でも説明したように、ミトコンドリアが傷害されて内膜の膜電位が低下すると、ピンク1タンパクがミトコンドリアに蓄積し、このピンク1がパーキンタンパクをミトコンドリア外膜上に移動させる[216]。パーキンは膜タンパクをユビキチン化し[195]、オートファジー機構を介して傷害ミトコンドリアを選択的に除去する[217]。パーキンソン病ではこのシステムが破綻していると考えられる。
- 酸化ストレス仮説
- 好気的呼吸における電子伝達系の過程では、必然的に活性酸素種(reactive oxygen species, ROS)や活性窒素種(reactive nitrogen species, RNS)が生成する。ROSにはスーパーオキシド、過酸化水素、ヒドロキシルラジカル、一重項酸素などがあるが、これらは生成されるとすぐに生体内の抗酸化酵素・抗酸化物によって取り除かれる。抗酸化酵素にはスーパーオキシドジスムターゼ(SOD)、カタラーゼ、グルタチオンペルオキシダーゼなどが、抗酸化物には水素、ビタミンA、ビタミンC、ビタミンE、尿酸、ユビキノンなどがある。もし何らかの理由で抗酸化作用が不十分になると、活性酸素種は脂質過酸化を起こし、さらにタンパク・DNAを酸化させて細胞を傷害する。これが酸化ストレスである[218]。慶應義塾大学等は水素分子のヒドロキシラジカル消去の作用に着目し、4名のパーキンソン病の患者に水素ガス吸入療法を行ったところパーキンソン病に特徴的な緩慢動作、手足の震え、前屈姿勢などの症状が改善されることを見出した[219]。
- ドパミンがモノアミン酸化酵素で代謝される際に過酸化水素が生じる。過酸化水素は2価の鉄イオンと反応して非常に反応性の高いヒドロキシラジカルを生じる(フェントン反応)。ドパミンの酸化物ドパミン合成の律速段階であるチロシン水酸化酵素の活性には補因子として鉄が必要であり、ドパミン作動性細胞内には鉄が豊富に含まれている。抗酸化作用が不十分になると、これらの活性酸素種はドパミン作動性細胞の変性につながる可能性がある[220]。さらにドパミンの酸化による中間代謝産物そのものが、酸化ストレスの原因となる(ドパミンは最終的に神経メラニンとなって細胞内に沈着し、黒質の「黒さ」の原因となる)。
- 酸化ストレスはユビキチン化を阻害し、酸化されたタンパクによってプロテアソームも損傷を受ける。そしてプロテアソームの障害は活性酸素種を生じてさらなる酸化ストレスを生み出すという悪循環となる[221]。
- 抗酸化作用を持つDJ-1タンパクをコードするDJ-1遺伝子の変異が家族性パーキン病の原因 (PINK7)となることから、酸化ストレスがパーキンソン病の原因となる。
- 感受性遺伝子
- 一般にある疾患にかかるリスクを高める遺伝因子を疾患感受性遺伝子と呼ぶ。パーキンソン病患者と非患者 (対照) のゲノムワイド関連解析(多数の遺伝子の一塩基多型を比較することで感受性の高い遺伝子を選び出す解析)によって、α-シヌクレイン(α-synuclein、これについては既に症例対照研究でも明らかにされている[222])および LRRK2が白人と日本人に共通な感受性遺伝子、Tauはヨーロッパだけで感受性が見られた。さらに日本では新たな遺伝子 PARK16(推定責任遺伝子NUCKS1)、BST1 が感受性を持つことが分かった[223][224][225]。
- また稀な遺伝疾患であるゴーシェ病のユダヤ人家系に、有意にパーキンソン病患者が多い[226]ことから、さまざまな国でゴーシェ病の原因遺伝子 GBA変異を調べたところ、孤発性パーキンソン病患者で有意に GBA保因者が多いことが分かった[227][228]。ただしその機序は不明である。
トピックス
要約
視点
特発性正常圧水頭症の合併
特発性正常圧水頭症の多くは神経変性疾患を合併しており真の特発性正常圧水頭症は極めて稀と考えられている[229][230]。神経変性疾患を背景とした水頭症はneurodegenerative NPHと呼ばれることがある[231]。neurodegenerative NPHの例としてはアルツハイマー病やパーキンソン病や進行性核上性麻痺と特発性正常圧水頭症の合併がしばしば報告されている[232][233][234]。アルツハイマー病と特発性正常圧水頭症の合併例でシャント術の効果が限定的で症状の改善が一時的になることから[235]その他の神経変性疾患の合併がある場合も同様と考えられている[236]。パーキンソン病を合併する特発性正常圧水頭症ではシャント術の効果が一時的ではないという報告もある[237]。
パーキンソン病と神経炎症
パーキンソン病に対して免疫治療が有効な可能性が示唆されている。
橋本脳症
レビー小体病に橋本脳症を合併し、免疫治療で歩行障害や認知機能障害が改善した例が報告されている[238][239]。これらの例では抗NAE抗体が陽性であった。パーキンソン病において抗NAE抗体の陽性率は10.3%と報告されている[240]。
IgLON5抗体関連疾患
IgLON5抗体関連疾患は病理学的には神経変性とタウ沈着を起こす自己免疫性脳炎である。眼球運動障害、運動異常症、認知機能障害、球麻痺、自律神経障害、睡眠障害、神経筋障害など多彩な症状を呈する[241]。これらの症候の組み合わせにより進行性核上性麻痺[242]、大脳皮質基底核症候群[243]、多系統萎縮症[244]、筋萎縮性側索硬化症[245]といった神経変性疾患の臨床像に類似することがある。原著の8例では免疫治療の改善例は1例で不変が7例であった[246]。最終的な転帰は死亡が6例で、そのうち3例が就寝中の突然死であった。上記報告のため当初は予後不良な疾患と考えられていた。その後、免疫治療での症状改善例が報告され、40%程度が治療に反応すると報告されている[247]。過去のIgLON5抗体関連疾患の報告例の17%はレビー小体型認知症の可能性があるという研究がある。probable MSAの基準を満たしたものは5例、パーキンソン病の基準を満たしたものも5例であった[248]。IgLON5抗体関連疾患例がパーキンソン病と診断され免疫治療で軽快する可能性があり、そのような報告例もある[249]。
神経炎症
神経変性疾患では病気の進行に伴ってグリア細胞の活性化や増生が認められる。これを神経炎症と呼ぶ[250]。神経炎症は神経変性疾患に共通する特徴である[251]。かつては神経炎症は神経変性に対する反応とみなされていたが、疾患の引き金になったり重要な役割を担うと考えられるようになった[252]。パーキンソン病においても神経炎症がパーキンソン病発症を促進すると考えられている[253]。事実、免疫治療がパーキンソン病のリスクを低下させる報告がある[254]。しかし神経炎症を標的とする治療は有効性を示していない[255][256]。
基礎実験ではαシヌクレインが免疫応答を促進させる報告がある[257][258]。そしてミクログリアのTLR2とαシヌクレインの相互作用が神経炎症に関与する[259]。モデルマウスでTLR2/MyD88/NF-κB経路の阻害でαシヌクレインの拡散が抑制される[260]。
パーキンソン病の病態には不均一性があり、パーキンソン病の共通病態をターゲットとした治療と特定のサブグループに有効な特異的な治療がある。αシヌクレインをターゲットとする治療や神経炎症をターゲットとする治療は共通病態をターゲットとした治療と考えられる[261][262]。自然免疫系だけではなく、獲得免疫系もパーキンソン病の病態に関わっている[263][264]。パーキンソン病の初期段階にCD8陽性T細胞が中脳黒質に浸潤するという報告がある[265]。CD8陽性T細胞が中脳黒質に浸潤する以前に血液脳関門の障害が予想されるが十分に明らかになっていない[266]。しかし血液脳関門の障害がパーキンソン病の進行に関与すると考えられている。
全身性炎症との関係
神経変性疾患は感染症などの全身性炎症で進行が加速することが知られている[267]。炎症性シグナル伝達を介して、脳内のミクログリアやアストロサイトの活性化を促進する神経炎症の結果と考えられている[268]。パーキンソン病においては全身性感染症で運動機能が低下することは広く知らており、薬剤の影響、脳内ドパミン代謝変化、線条体におけるドパミン伝達の変化、神経炎症の関与が考えられている[269]。
COVID-19はパーキンソン病を悪化させると報告されている[270][271][272]。
パーキンソン病の患者は誤嚥性肺炎のリスクが高い[273][274][275]。そして誤嚥性肺炎発症後の1年以内の死亡率は65.2%と非常に高い[276]。誤嚥性肺炎も全身性炎症であるためパーキンソン病の進行に関わる可能性がある[277]。
罹患した著名人
- アーサー・ケストラー
- アドルフ・ヒトラー
- E・H・エリック
- 石母田正
- 梅原達也(44MAGNUM)
- 永六輔
- 江戸川乱歩
- 岡本太郎
- オジー・オズボーン[278]
- オトマール・スウィトナー
- 萱野茂
- 金槿泰
- キャサリン・ヘプバーン
- ギリヤーク尼ヶ崎
- クラウス・フォン・アムスベルク
- グレン・ティプトン
- 小森和子
- 春風亭栄橋
- 薄田泣菫
- ジェレミー・ブロック[279]
- ソニア・リキエル
- 佃公彦
- 神部和夫
- デボラ・カー
- 鄧小平
- 富田哲也
- 二世西川鯉三郎
- はしだのりひこ
- パット・トーピー
- 樋口了一
- ヒクソン・グレイシー
- ビリー・グラハム
- フィデル・カストロ
- フィル・ヒル
- フランシスコ・フランコ
- フレディ・ローチ
- ペーター・ホーフマン
- 別役実
- マイケル・J・フォックス
- 前川國男
- マサ斎藤
- 松村厚久
- マンフレート・ロンメル
- みのもんた
- モーリス・ホワイト
- モハメド・アリ
- 三浦綾子
- 山田風太郎
- 横井庄一
- ヨハネ・パウロ2世
- レアルコ・グエッラ
- リンダ・ロンシュタット
- リー・アイアコッカ
脚注
参考文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

