শীর্ষ প্রশ্ন
সময়রেখা
চ্যাট
প্রসঙ্গ
নাইওবিয়াম
একটি মৌলিক পদার্থ উইকিপিডিয়া থেকে, বিনামূল্যে একটি বিশ্বকোষ
Remove ads
নাইওবিয়াম, পূর্বে কলাম্বিয়াম নামে পরিচিত, হলো ৪১ পারমাণবিক সংখ্যাবিশিষ্ট একটি মৌল, যার প্রতীক Nb (পূর্বে Cb)। নাইওবিয়াম হালকা ধূসর, স্ফটিকাকার ও নমনীয় অবস্থান্তর ধাতু। বিশুদ্ধ নাইওবিয়াম বিশুদ্ধ টাইটেনিয়ামের মতো কঠিন,[বৈপরীত্য][৪] ও লৌহের মতো নমনীয়। নাইওবিয়াম পৃথিবীর বায়ুমণ্ডলকে খুব ধীরে জারিত করে, তবুও গহনাশিল্পে নাইওবিয়ামকে নিকেলের হাইপোঅ্যালার্জেনিক বিকল্প হিসেবে ব্যবহার করা হয়। নাইওবিয়াম খনিতে পাইরোক্লোর ও কলাম্বাইট হিসেবে পাওয়া যায়, যার কারণে এর পূর্ব নাম ছিল কলাম্বিয়াম। গ্রিক পুরাণের ট্যান্টালুসের (যার নাম থেকে ট্যানটালাম (Ta) মৌলের নামের উৎপত্তি) কন্যা নাইওবের নামানুসারে মৌলটির নামকরণ করা হয়েছে। এরূপ নামকরণ মৌল দুটির গাঠনিক ও রাসায়নিক বৈশিষ্ট্যের সাদৃশ্যকে নির্দেশ করে। এরূপ সাদৃশ্যের জন্য কখনো কখনো মৌল দুটিকে আলাদা করা যায় না।[৫]
১৮০১ সালে ইংরেজ রসায়নবিদ চার্লস হ্যাচেট ট্যানটালামের সদৃশ একটি মৌল প্রত্যক্ষ করেন ও নাম দেন কলাম্বিয়াম। ১৮০৯ সালে উইলিয়াম হাইড ওলাস্টোন ভুল সিদ্ধান্তে উপনীত হন যে, ট্যানটালাম ও কলাম্বিয়াম একই ধাতুর রূপভেদ। ১৮৬৪ সালে জার্মান রসায়নবিদ হেনরিখ রোজ ট্যানটালাম আকরিকে দ্বিতীয় আরেকটি মৌল শনাক্ত করেন, যার নাম দেন নাইওবিয়াম। ১৮৬৪ ও ৬৫ সালে বেশ কিছু বৈজ্ঞানিক গবেষণায় প্রমাণিত হয় যে নাইওবিয়াম ও কলাম্বিয়াম একই মৌল (ট্যানটালুম থেকে পৃথক করায়)। এরপর প্রায় একশত বছর দুইটি নামই বিভিন্ন বিজ্ঞানী ব্যবহার করেন। ১৯৪৯ সালে আনুষ্ঠানিকভাবে মৌলটির নামকরণ করা হয় নাইওবিয়াম। কিন্তু যুক্তরাষ্ট্রে কলাম্বিয়াম নামটি ধাতুবিদ্যায় এখনও ব্যবহৃত হয়।
২০ শতাব্দীর পূর্বে নাইওবিয়াম বাণিজ্যিকভাবে ব্যবহৃত হয় নি। ব্রাজিল নাইওবিয়াম ও ফেরোনাইওবিয়ামের শীর্ষ উৎপাদক। ফেরোনাইওবিয়াম হলো নাইওবিয়াম ও লোহার সংকর, যাতে ৬০-৭০% নাইওবিয়াম থাকে। সংকর ধাতু হিসেবে নাইওবিয়ামের অধিক ব্যবহার হয়, যার মধ্যে বেশিরভাগ গ্যাস সরবরাহকারী পাইপের ইস্পাত তৈরিতে ব্যবহৃত হয়। যদিও এই সকল সংকর ধাতুতে সর্বোচ্চ ০.১% নাইওবিয়াম ব্যবহৃত হয়, তবুও তা ইস্পাতের দৃঢ়তা যথেষ্ট বৃদ্ধি করে। নাইওবিয়াম সংকর ধাতুসমূহের উচ্চ তাপমাত্রা-সহনশীলতার জন্য জেট ও রকেট ইঞ্জিন তৈরিতে ব্যবহৃত হয়।
বিভিন্ন অতিপরিবাহী সামগ্রী তৈরিতে নাইওবিয়াম ব্যবহৃত হয়। টাইটেনিয়াম ও টিনযুক্ত এই অতিপরিবাহী সংকর ধাতুগুলো এমআরআই যন্ত্রের অতিপরিবাহী চুম্বক হিসেবে ব্যাপকভাবে ব্যবহৃত হয়। এছাড়াও ঝালাই, পরমাণু শিল্প, ইলেক্ট্রনিক্স, আলোকবিদ্যা, মুদ্রাশিল্প ও গহনাশিল্পে নাইওবিয়াম ব্যবহৃত হয়। মুদ্রা ও গহনাশিল্পে অ্যানোডিকরণের ফলে উৎপাদের নিম্ন বিষাক্ততা ও বর্ণিলতা অতি আকাঙ্ক্ষিত। নাইওবিয়ামকে শিল্পের জন্য একটি গুরুত্বপূর্ণ মৌল হিসেবে বিবেচনা করা হয়।
Remove ads
ইতিহাস
সারাংশ
প্রসঙ্গ


১৮০১ সালে ইংরেজ রসায়নবিদ চার্লস হ্যাচেট নাইওবিয়াম শনাক্ত করেন।[৬][৭][৮] তিনি যুক্তরাষ্ট্রের কানেকটিকাট থেকে পাঠানো একটি খনিজ নমুনায় নতুন মৌলটি শনাক্ত করেন। জন উইনথ্রপ দ্য ইয়ঙ্গারের নাতি জন উইনথ্রপ এফআরএস নমুনাটি ইংল্যান্ডে প্রেরণ করেন। হ্যাচেট যুক্তরাষ্ট্রের সাহিত্যিক উপনাম কলাম্বিয়া অনুসারে খনিজটির নাম দেন কলাম্বাইট ও মৌলটির নামকরণ করেন কলাম্বিয়াম।[৯][১০][১১] হ্যাচেটের আবিষ্কৃত কলাম্বিয়াম ছিল সম্ভবত নতুন আবিষ্কৃত মৌল ও ট্যানটালামের মিশ্রণ।[৯]
পরবর্তীকালে কলাম্বিয়াম ও এর নিকট সম্পর্কিত মৌল ট্যানটালামের পার্থক্যকরণে বেশ কিছু বিভ্রান্তি সৃষ্টি হয়।[১২] ১৮০৯ সালে ইংরেজ রসায়নবিদ উইলিয়াম হাইড ওলাস্টোন কলাম্বিয়াম ও ট্যানটালাম থেকে প্রাপ্ত অক্সাইড কলাম্বাইট (ঘনত্ব ৫.৯১৮ গ্রা/সেমি৩) ও ট্যানটালাইটের (ঘনত্ব ৮ গ্রা/সেমি৩ এর উপর) তুলনা করেন। উভয় অক্সাইডের ঘনত্বের লক্ষণীয় পার্থক্য সত্ত্বেও তিনি সিদ্ধান্ত দেন যে উভয় মৌল একই এবং ট্যানটালাম নামটি অপরিবর্তিত রাখেন।[১২] ১৮৪৬ সালে জার্মান রসায়নবিদ হেনরিখ রোজ এই সিদ্ধান্তের বিরুদ্ধে বিতর্ক উত্থাপন করেন। তিনি ট্যানটালাইট নমুনায় দুই ধরনের মৌল দেখতে পান এবং নতুন মৌলটির জন্য ট্যানটালুসের সন্তান নাইওবের নামানুসারে নাইওবিয়াম ও পেলোপসের নামানুসারে পেলোপিয়াম নাম দুটি প্রস্তাব করেন।[১৩][১৪] ট্যানটালাম ও নাইওবিয়ামের মধ্যকার দৃশ্যমান নগণ্য পার্থক্যের জন্যই মূলত এই বিভ্রান্তির সৃষ্টি হয়। প্রস্তাবিত পেলোপিয়াম, ইলমেনিয়াম ও ডায়ানিয়াম[১৫] বস্তুত নাইওবিয়াম অথবা নাইওবিয়াম ও ট্যানটালামের মিশ্রণের অনুরূপ।[১৬]

১৮৬৪ সালে ক্রিস্টিয়ান উইলহেম ব্লমস্ট্র্যান্ড[১৬] এবং হেনরি ইতিয়েন সান্তা-ক্লারা দাভিল ট্যানটালুম ও নাইওবিয়ামের মধ্যে সুস্পষ্ট পার্থক্য নির্দেশ করেন। সেই সাথে ১৮৬৫ সালে লুইস জোসেফ ট্রুস্ট কয়েকটি নাইওবিয়াম যৌগের সংকেত নির্ণয় করেন।[১৬][১৭] অবশেষে ১৮৬৬ সালে সুইস রসায়নবিদ জিয়ান চার্লস গালিসার্ড দ্য ম্যারিগনাক[১৮] সম্পূর্ণরূপে প্রমাণ করেন যে, সেখানে দুটিমাত্র মৌল রয়েছে। যদিও ১৮৭১ সাল পর্যন্ত ইলমেনিয়াম-এর অস্তিত্ব নিয়ে বেশ কিছু নিবন্ধ বের হয়।[১৯]
১৮৬৪ সালে দ্য ম্যারিগনাক উত্তপ্ত বায়ুমণ্ডলের হাইড্রোজেনের সাথে নাইওবিয়াম ক্লোরাইডকে জারিত করে সর্বপ্রথম ধাতু নিষ্কাশন করেন।[২০] যদিও দ্য ম্যারিগনাক ১৮৬৬ সালে যথেষ্ট পরিমাণ ট্যানটালুম-মুক্ত নাইওবিয়াম উৎপাদন করতে সক্ষম হলেও বিশ শতাব্দীর পূর্বে এর বাণিজ্যিক ব্যবহার করা হয়নি। বিশ শতাব্দীর শুরুর দিকে বৈদ্যুতিক বাতির ফিলামেন্টে এর প্রথম বাণিজ্যিক ব্যবহার শুরু হয়।[১৭] কিন্তু উচ্চ গলনাঙ্কের টাংস্টেনের ব্যবহারের ফলে নাইওবিয়ামের ব্যবহার কমে যায়। ১৯২০ এর দশকে আবিষ্কৃত হয় যে নাইওবিয়াম ইস্পাতের দৃঢ়তা বৃদ্ধি করে এবং এখন পর্যন্ত ইস্পাত তৈরিতেই নাইওবিয়াম সবচেয়ে বেশি ব্যবহৃত হয়।[১৭] ১৯৬১ সালে বেল ল্যাবরেটরিজে মার্কিন পদার্থবিদ ইউজিন কাঞ্জলার এবং তার সহকর্মীরা আবিষ্কার করেন যে শক্তিশালী তড়িৎপ্রবাহ ও চৌম্বকক্ষেত্রের প্রভাবে নাইওবিয়াম-টিন অতিপরিবাহিতা প্রদর্শন করে।[২১] এটি উচ্চ-শক্তির চুম্বক এবং বিদ্যুৎচালিত মেশিনের জন্য প্রয়োজনীয় উচ্চ তড়িৎপ্রবাহ ও ক্ষেত্র সহনীয় প্রথম বস্তু। এই আবিষ্কারের সূত্রে দুই দশক পর ঘূর্ণনশীল মেশিন, কণা গতিবৃদ্ধিকরণ ও কণা শনাক্তকরণের যন্ত্রে ব্যবহৃত শক্তিশালী বৈদ্যুতিক চুম্বকের কয়েলের তার তৈরি করা হয়।[২২][২৩]
নামকরণ
১৮০১ সালে নাইওবিয়ামের আবিষ্কারের পর মূলত হ্যাচেট কলাম্বিয়াম (প্রতীক "Cb") নাম দেন।[৭][২৪] এই নামটি দ্বারা বোঝানো হয় যে আকরিকের নমুনাটি আমেরিকা (কলাম্বিয়া) থেকে আগত।[২৫] আমেরিকান ক্যামিকাল সোসাইটি ১৯৫৩ সাল পর্যন্ত কলাম্বিয়াম নামটি ব্যবহার করত।[২৬] যদিও ইউরোপের দেশগুলোতে নাইওবিয়াম ব্যবহৃত হতো। এ সমস্যা সমাধানে ১৯৪৯ সালে আমস্টারডামে ইউনিয়ন অব কেমিস্ট্রির ১৫তম সম্মেলনে ৪১তম মৌলের নাম নাইওবিয়াম গৃহীত হয়।[২৭] প্রায় শত বছরের বিতর্কের পর কলাম্বিয়াম নামের অগ্রাধিকার সত্ত্বেও আন্তর্জাতিক বিশুদ্ধ ও ফলিত রসায়ন সংস্থা (ইউপ্যাক) নাইওবিয়াম নামটি গ্রহণ করে।[২৭] এটি ছিল এক ধরনের আপোস-মীমাংসা;[২৭] ইউপ্যাক ওলফ্রামের পরিবর্তে উত্তর আমেরিকার প্রচলন অনুসারে টাংস্টেন ও ইউরোপের প্রচলন অনুসারে কলাম্বিয়াম-এর পরিবর্তে নাইওবিয়াম গ্রহণ করে। যদিও যুক্তরাষ্ট্রের ক্যামিকাল সোসাইটি ও সরকারি দপ্তরসমূহ ইউপ্যাক নাম ব্যবহার করে, কিছু ধাতুবিদ ও ধাতু গবেষকরা এখনও "কলাম্বিয়াম" ব্যবহার করে থাকে।[২৮][২৯][৩০]
Remove ads
বৈশিষ্ট্য
সারাংশ
প্রসঙ্গ
গাঠনিক ধর্ম
নাইওবিয়াম পর্যায় সারণির পঞ্চম শ্রেণির (টেবিলে দেখুন) চকচকে, ধূসর, নমনীয়, প্যারাচুম্বক ধাতু। এর সর্বশেষ শক্তিস্তরে ৫টি ইলেকট্রন বিদ্যমান, যা পঞ্চম শ্রেণির মৌলের বৈশিষ্ট্য। রুথিনিয়াম (৪৪), রোডিয়াম (৪৫) ও প্যালেডিয়াম (৪৬) এর আশেপাশের মৌলসমূহেও তা দেখা যায়।
নাইওবিয়ামের আণবিক কাঠামো ঘনকাকৃতি স্ফটিকাকার। তবে ত্রিঅক্ষীয় উচ্চমাত্রার পরীক্ষায় নাইওবিয়ামের অ্যানিসট্রপিক আকৃতি দেখা যায় যা ঘনকাকৃতির সাথে সঙ্গতিহীন।[৩১] তাই, এ সংক্রান্ত আরও গবেষণা ও পরীক্ষা-নিরীক্ষা চলমান।
নাইওবিয়াম ক্রায়োজেনিক তাপমাত্রায় অতিপরিবাহিতা প্রদর্শন করে। বায়ুমণ্ডলীয় চাপে অতিপরিবাহী পদার্থের মধ্যে সর্বোচ্চ ক্রান্তি তাপমাত্রা (৯.২ কে) প্রদর্শন করে।[৩২] যেকোনো মৌলের চাইতে নাইওবিয়ামের চৌম্বকীয় প্রবেশ্য দৈর্ঘ্য বেশি।[৩২] সেই সাথে এটি ভ্যানাডিয়াম ও টেকনিশিয়ামের মতো টাইপ-২ অতিপরিবাহী। তবে নাইওবিয়াম ধাতুর বিশুদ্ধতার ওপর এর অতিপরিবাহিতা ধর্ম নির্ভর।[৩৩]
বিশুদ্ধ অবস্থায় এটি নরম ও নমনীয়, কিন্তু ভেজাল মিশ্রিত করলে এর কাঠিন্য বৃদ্ধি পায়।[৩৪]
নাইওবিয়ামের ক্রস সেকশন নিউট্রন ধারণ ক্ষমতা কম।[৩৫] এ কারণে এটি পারমাণবিক শিল্পে ব্যবহৃত হয় যেখানে নিউট্রনের স্বচ্ছ কাঠামো প্রয়োজন।[৩৬]
রাসায়নিক ধর্ম
অধিক সময় ধরে কক্ষ তাপমাত্রায় বাতাসে উন্মুক্ত থাকলে নাইওবিয়াম ঈষৎ নীলাভ রঙ ধারণ করে।[৩৭] মৌল অবস্থায় উচ্চ গলনাঙ্ক (২,৪৬৮ °সে) হওয়া সত্ত্বেও অন্যান্য দুর্গল ধাতুর চাইতে নিম্ন ঘনমাত্রা বিশিষ্ট। এছাড়া এটি ক্ষয়রোধী, অতিপরিবাহী ধর্ম প্রদর্শন করে এবং দ্বিইলেক্ট্রনীয় অক্সাইডের আবরণ তৈরি করে।
পর্যায় সারণিতে পূর্বের মৌল জিরকোনিয়াম অপেক্ষা নাইওবিয়াম কম ইলেকট্রোধনাত্মক কিন্তু অধিক ঘনবিন্যস্ত। ল্যান্থানাইড সঙ্কোচনের কারণে এটি তুলনামূলক বৃহদাকার ট্যানটালাম পরমাণুর সাথে সাদৃশ্যপূর্ণ।[৩৪] ফলে পর্যায় সারণীতে ঠিক নিচে অবস্থিত অবস্থিত ট্যানটালামের সাথে নাইওবিয়ামের রাসায়নিক ধর্ম অধিক সাদৃশ্যপূর্ণ।[১৭] যদিও টযানটালামের তুলনায় নাইওবিয়ামের ক্ষয়প্রতিরোধক্ষমতা কম, কিন্তু সহজলভ্যতা ও কম দামের জন্য রাসায়নিক কারখানায় ভ্যাট লাইনিং প্রভৃতি কাজে এর ব্যবহার রয়েছে।[৩৪]
আইসোটোপ
পৃথবীর উপরিভাগে নাইওবিয়াম একমাত্র স্থায়ী 93Nb আইসোটোপ গঠন করে।[৩৮] ২০০৩ সালের মধ্যে ৮১ থেকে ১১৩ আণবিক ভরের কমপক্ষে ৩২টি তেজষ্ক্রিয় আইসোটোপ সংশ্লেষিত হয়। এর মধ্যে 92Nb (অর্ধায়ু ৩৪.৭ মিলিয়ন বছর) এর স্থায়িত্ব সবচেয়ে বেশি। আবার 113Nb হলো সবচেয়ে কম স্থায়ীত্বের একটি আইসোটোপ, যার অর্ধায়ু আনুমানিক ৩০ মিলিসেকেন্ড মাত্র। কিছু ব্যতিক্রম ছাড়া অধিক স্থায়ী 93Nb এর চেয়ে হালকা আইসোটোপগুলো β+ এবং ভারী আইসোটোপগুলো β− ক্ষয়প্রাপ্তির প্রবণতা প্রদর্শন করে। 81Nb, 82Nb, এবং 84Nb স্বল্প β+ বিলম্বিত প্রোটন নির্গমনের মাধ্যমে, 91Nb ইলেকট্রন ধারণ ও পজিট্রন নির্গমন, এবং 92Nb β+ ও β− পদ্ধতিতে ক্ষয়প্রাপ্ত হয়।[৩৮]
এখন পর্যন্ত ৮৪ থেকে ১০৪ আণবিক ভরের অন্তত ২৫টি নিউক্লিয়ার আইসোমার বর্ণিত হয়েছে। এর মধ্যে শুধুমাত্র 96Nb, 101Nb, এবং 103Nb আইসোটোপের কোনো আইসোমার আবিষ্কৃত হয়নি। নাইওবিয়ামের সবচেয়ে স্থায়ী আইসোমার হলো 93mNb, যার অর্ধায়ু ১৬.১৩ বছর। আবার সবচেয়ে কম স্থায়ীত্বের আইসোমার হলো 84mNb যার অর্ধায়ু ১০৩ ন্যানোসেকেন্ড। নাইওবিয়ামের সকল আইসোমার আইসোমারিক পরিবর্তন বা বিটা ক্ষয়ের মাধ্যমে ক্ষয়প্রাপ্ত হয়। তবে 92m1Nb এর ব্যতিক্রম। এটি ক্ষুদ্র ইলেকট্রন ধারণ শাখা গঠন করে।[৩৮]
লভ্যতা
নাইওবিয়াম পৃথিবীপৃষ্ঠে ৩৪তম সর্বাধিক প্রাপ্য মৌল। পৃথিবীপৃষ্ঠে ২০ পিপিএম।[৩৯] ধারণা করা হয় পৃথিবীতে এই মৌলের প্রাচুর্যতা আরও বেশি, এবং এই ধাতুর অধিকাংশই পৃথিবীর কেন্দ্রে সীমাবদ্ধ।[২৯] প্রকৃতিতে এটি মুক্তাবস্থায় পাওয়া যায় না। তবে খনিতে অন্যান্য মৌলের সাথে যৌগাবস্থায় সহজলভ্য।[৩৪] নাইওবিয়াম সমৃদ্ধ খনিতে প্রায়ই ট্যানটালামও পাওয়া যায়, যেমন কলাম্বাইট ((Fe,Mn)(Nb,Ta)2O6) এবং কলাম্বাইট–ট্যানটালাইট (বা কোলটান, (Fe,Mn)(Ta,Nb)2O6)।[৪০] কলাম্বাইট–ট্যানটালাইট (এর মধ্যে সর্বাধিক প্রাপ্য হলো কলাম্বাইট-(Fe) এবং ট্যানটালাইট-(Fe), যেখানে "-(Fe)" হলো লেভিনসন উপসর্গ যা ম্যাঙ্গানিজ প্রভৃতি অন্যান্য মৌলের ওপর লৌহের আধিক্য নির্দেশ করে[৪১][৪২][৪৩][৪৪]) প্যাগমাটাইটবহুল ও ক্ষারবহুল পাথরে পাওয়া যায়। ক্যালসিয়াম, ইউরেনিয়াম, থোরিয়াম ও দুর্লভ মৃত্তিকা ধাতুর নাইওবেট সহজলভ্য নয়। এমন একটি নাইওবেট হলো পাইরোক্লোর ((Na,Ca)2Nb2O6(OH,F)) (এটি কয়েকটি যৌগের সম্মিলিত নাম, এর একটি অপেক্ষাকৃত সাধারণ নাম রয়েছে, যেমন ফ্লুওক্যালসিওপাইরোক্লোর[৪৩][৪৪][৪৫][৪৬][৪৭]) এবং ইউক্সিনাইট (সঠিক নাম ইউক্সিনাইট-(Y)[৪৩][৪৪][৪৮]) ((Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6)। এই বিশাল পরিমাণ নাইওবিয়াম কার্বোনাটাইটের সাথে আগ্নেয় শিলায় (কার্বোনেট-সিলিকেট) এবং পাইরোক্লোরের সাথে পাওয়া যায়।[৪৯][৫০]
পাইরোক্লোরের সবচেয়ে বড় তিনটি মজুদের দুইটি ব্রাজিল ও একটি কানাডায় অবস্থিত। এগুলো ১৯৫০ এর দশকে আবিষ্কৃত হয় এবং বর্তমানে বিশ্বের সবচেয়ে বেশি নাইওবিয়াম উৎপাদন করে।[১৭] সবচেয়ে বড় মজুদটি ব্রাজিলের মিনাস গেরাইস রাজ্যের আরাজার কার্বোনাটাইট খনিতে অবস্থিত, যার মালিক ব্রাজিলের প্রতিষ্ঠান সিবিএমএম (কোম্পানিয়া ব্রাসিলিরা ডে মেটালার্জিয়া এ মেইনেরাও)। ব্রাজিলের অন্য সক্রিয় খনিটিও কার্বোনাটাইটের মধ্যে রয়েছে যার অবস্থান গোইয়াস রাজ্যের কাতালাওয়ের নিকটে এবং মালিকানা প্রতিষ্ঠান চায়না মোলিবডেনাম।[৫১] এই দুটো খনি একত্রে বিশ্বের ৮৮% নাইওবিয়াম উৎপাদন করে।[৫২] এছাড়াও ব্রাজিলের আমাজোনাস রাজ্যের সাও গ্যাব্রিয়েল দা কাকোয়েরার নিকটে একটি বৃহৎ অব্যবহৃত খনি এবং রোরাইমা রাজ্যে ছোট ছোট কিছু নাইওবিয়ামের মজুদ রয়েছে।[৫২]
নাইওবিয়ামের তৃতীয় বৃহত্তম মজুদ কানাডার কুইবেকের শিকুওতিমির নিকটে সেন্ট হনরেতে অবস্থিত, যার মালিকানা প্রতিষ্ঠান ম্যাগ্রিস রিসোর্সেস।[৫৩] বৈশ্বিক উৎপাদনের ৭% থেকে ১০% এখান থেকে আসে।[৫১][৫২]
Remove ads
উৎপাদন
সারাংশ
প্রসঙ্গ

অন্যান্য খনিজ অপদ্রব থেকে আলাদা করার পর ট্যানটালাম (Ta2O5) এবং নাইওবিয়ামের (Nb2O5) অক্সাইডের মিশ্রণ পাওয়া যায়। এরপর উৎপাদন প্রক্রিয়ার প্রথম ধাপে অক্সাইডদ্বয়ের সাথে হাইড্রোফ্লোরিক এসিডের বিক্রিয়া করা হয়:[৪০]
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
- Nb2O5 + 10 HF → 2 H2[NbOF5] + 3 H2O
ডি ম্যারিগনাক প্রথম বাণিজ্যিক পর্যায়ে পানিতে নাইওবিয়াম ও ট্যানটালামের ফ্লোরাইড যৌগ, ডাইপটাশিয়াম অক্সিপেন্টাফ্লুরোনাইওবেট মনোহাইড্রেট (K2[NbOF5]·H2O) এবং ডাইপটাশিয়াম হেপ্টাফ্লুরোট্যানটালেট (K2[TaF7]) এর দ্রাব্যতার উপর ভিত্তি করে উভয় মৌলের পৃথকীকরণ করেন। নতুন পদ্ধতিতে ফ্লোরাইডের জৈব দ্রাবকের (যেমন সাইক্লোহেক্সানোন) জলীয় দ্রবণ ব্যবহার করা হয়।[৪০] জৈব দ্রাবক থেকে পানি ও ইথারযোগে নাইওবিয়াম ও ট্যানটালামের জটিল ফ্লোরাইড যৌগ আহরিত হয়। এতে পটাশিয়াম ফ্লোরাইড যোগ করে পটাশিয়ামের জটিল ফ্লোরাইড যৌগ উৎপাদন করা হয় কিংবা পেন্টোক্সাইড হিসেবে অ্যামোনিয়া যোগ করা হয়:[৫৪]
- H2[NbOF5] + 2 KF → K2[NbOF5]↓ + 2 HF
অথবা অ্যামোনিয়াযোগে:
- 2 H2[NbOF5] + 10 NH4OH → Nb2O5↓ + 10 NH4F + 7 H2O
ধাতব নাইওবিয়ামের বিজারণের জন্য বিভিন্ন পদ্ধতি অবলম্বন করা হয়। এর একটি হলো K2[NbOF5] ও সোডিয়াম ক্লোরাইডের গলিত দ্রবণের তড়িৎ বিশ্লেষণ এবং অন্যটি হলো সোডিয়াম দ্বারা ফ্লোরাইডের বিজারণ। এই পদ্ধতিতে তুলনামূলক বেশি বিশুদ্ধ নাইওবিয়াম নিষ্কাশন করা যায়। ব্যাপক আকারের উৎপাদনের জন্য Nb2O5কে হাইডড়োজেন বা কার্বন দ্বারা বিজারিত করা হয়।[৫৪] তাপীয় অ্যালুমিনো বিক্রিয়ায় আয়রন অক্সাইড ও নাইওবিয়াম অক্সাইডের সাথে ্যালুমিনিয়ামের বিক্রিয়া করা হয়:
- 3 Nb2O5 + Fe2O3 + 12 Al → 6 Nb + 2 Fe + 6 Al2O3
বিক্রিয়ার গতিবৃদ্ধির জন্য সোডিয়াম নাইট্রেট প্রভৃতি জারক যোগ করা হয়। বিক্রিয়ায় অ্যালুমিনিয়াম অক্সাইড এবং নাইওবিয়াম ও লোহার সংকর ফেরোনাইওবিয়াম উৎপন্ন হয়, যা ইস্পাত উৎপাদনে ব্যবহৃত হয়।[৫৫][৫৬] ফেরোনাইওবিয়ামে ৬০ থেকে ৭০% নাইওবিয়াম থাকে।[৫১] আয়রন অক্সাইড ব্যতীত অ্যালুমিনোথার্মিক বিক্রিয়ায় নাইওবিয়াম উৎপন্ন হয়। অতিপরিবাহী সংকর তৈরির জন্য আরও বিশুদ্ধিকরণের প্রয়োজন হয়। এজন্য নাইওবিয়ামের বৃহৎ দুইটি বিতরণ প্রতিষ্ঠান শূণ্যস্থানে ইলেকট্রন বিম গলন পদ্ধতি ব্যবহার করে।[৫৭][৫৮]
২০১৩ সালের হিসাব অনুযায়ী ব্রাজিলের সিবিএমএম বিশ্বের নাইওবিয়াম উৎপাদনের ৮৫% নিয়ন্ত্রণ করতো।[৫৯] যুক্তরাষ্ট্রের ভূতত্ত্ব জরিপের হিসাব অনুসারে ২০০৫ সালে উৎপাদন ৩৮,৭০০ টন থেকে ২০০৬ সালে ৪৪,৫০০ টনে বৃদ্ধি পায়।[৬০][৬১] বিশ্বব্যাপী নাইওবিয়ামের গড় মজুদ ধরা হয় ৪৪,০০,০০০ টন।[৬১] ১৯৯৫ থেকে ২০০৫ সাল পর্যন্ত দশ বছরে উৎপাদন প্রায় দ্বিগুণ হয়েছে, যেখানে ১৯৯৫ সালে উৎপাদন ছিল ১৭,৮০০ টন।[৬২] ২০০৯ থেকে ২০১১ পর্যন্ত বার্ষিক উৎপাদন ৬৩,০০০ টনে সীমাবদ্ধ ছিল,[৬৩] ২০১২ সালে সামান্য হ্রাস পেয়ে বার্ষিক উৎপাদন দাঁড়ায় ৫০,০০০ টন।[৬৪]
এছাড়া মালাউইর কান্যিকা খনিতে সামান্য পরিমাণ মজুদের সন্ধান পাওয়া যায়।
Remove ads
যৌগ
সারাংশ
প্রসঙ্গ
বিভিন্নভাবেই নাইওবিয়াম ট্যানটালাম ও জিরকোনিয়ামের সাথে সাদৃশ্যপূর্ণ। এটি উচ তাপমাত্রায় অধিকাংশ অধাতুর সাথে বিক্রিয়া করে; কক্ষ তাপমাত্রায় ফ্লোরিন, প্রায় ২০০ °সে তাপমাত্রায় ক্লোরিন ও হাইড্রোজেন এবং প্রায় ৪০০ °সে তাপমাত্রায় নাইট্রোজেনের সাথে বিক্রিয়া করে, যার উৎপাদগুলো দ্রুত পরিবর্তনশীল ও গণনা অযোগ্য।[৩৪] ২০০ °সে তাপমাত্রায় বায়ুর সাথে ধাতুটি জারিত হতে শুরু করে।[৫৪] এটি দ্রবীভূত ক্ষার ধাতু ও অম্ল যেমন রাজাম্ল, হাইড্রোক্লোরিক এসিড, সালফিউরিক এসিড, নাইট্রিক এসিড, ফসফরিক এসিড ইত্যাদি দ্বারা সৃষ্ট ক্ষয় প্রতিরোধ করে।[৩৪] তবে হাইড্রোফ্লোরিক এসিড বা হাইড্রোফ্লোরিক/নাইট্রিক এসিডের মিশ্রণ দ্বারা নাইওবিয়াম ক্ষয়প্রাপ্ত হয়।
নাইওবিয়াম +৫ থেকে -১ পর্যন্ত সবগুলো জারণমান প্রদর্শন করে, তবে সবচেয়ে লভ্য যৌগে নাইওবিয়ামের জারণমান +৫।[৩৪] গুণগতভাবে, +৫ এর কম জারণমান প্রদর্শন করলে Nb–Nb বন্ধন গঠিত হয়। জলীয় দ্রবণে, নাইওবিয়াম শুধুমাত্র +৫ দশা প্রদর্শন করে। এটি সহজেই আর্দ্রবিশ্লেষিত হয় তবে দ্রবণে জলীয় নাইওবিয়াম অক্সাইডের অধঃক্ষেপের কারণে হাইড্রোক্লোরিক এসিড, সালফিউরিক এসিড, নাইট্রিক এসিড, ফসফরিক এসিড প্রভৃতির লঘু দ্রবণে খুব কম দ্রবণীয়।[৫৭] দ্রবণীয় পলিঅক্সোনাইওবেট জাতীয় যৌগ উৎপন্ন হওয়ায় Nb(V) ক্ষারীয় মাধ্যমে সামান্য দ্রবণীয়।[৬৬][৬৭]
অক্সাইড ও সালফাইড
নাইওবিয়াম +৫ জারণ অবস্থায় (Nb2O5),[৬৮] +৪ জারণ অবস্থায় (NbO2), +৩ জারণ অবস্থায় (Nb
2O
3),[৫৪] এবং সবচেয়ে দুর্লভ +২ জারণ অবস্থায় (NbO) প্রভৃতি গঠন অক্সাইড করে।[৬৯] এর মধ্যে সবচেয়ে বেশি পাওয়া যায় পেন্টোক্সাইড, যা থেকে প্রায় সকল নাইওবিয়াম যৌগ ও সংকর তৈরি করা হয়।[৫৪][৭০] ক্ষারীয় হাইড্রক্সাইড দ্রবণে পেন্টোক্সাইড দ্রবীভূত করে কিংবা ক্ষার ধাতুর অক্সাইডের সাথে গলিয়ে নাইওবেট তৈরি করা হয়। যেমন লিথিয়াম নাইওবেট (LiNbO3) এবং ল্যান্থানাম নাইওবেট (LaNbO4)। লিথিয়াম নাইওবেট বিকৃত ত্রিকোণাকার পেরভস্কাইট কাঠামো গঠন করে, অন্যদিকে ল্যান্থানাম নাইওবেটে মুক্ত NbO3−
4 আয়ন থাকে।[৫৪] এছাড়া আবৃত নাইওবিয়াম সালফাইড (NbS2) যৌগের কথা জানা যায়।[৩৪]
৩৫০ °সে তাপমাত্রার উপরে নাইওবিয়াম(V) ইথোক্সাইড-এর তাপীয় বিয়োজনের মাধ্যমে রাসায়নিক বাষ্প অবক্ষেপন বা পারমাণবিক স্তর অবক্ষেপন পদ্ধতিতে বস্তুর উপর নাইওবিয়াম(V) অক্সাইডের পাতলা স্তর সৃষ্টি করা যায়।[৭১][৭২]
হ্যালাইড


+৫ ও +৪ জারণ অবস্থায় নাইওবিয়াম হ্যালাইড এবং সেই সাথে বেশ কিছু সাব-স্টোচিওমেট্রিক যৌগ গঠন করে।[৫৪][৫৭] পেণ্টাহ্যালাইড (NbX
5) যৌগে Nb কেন্দ্রীয় অষ্টতলকীয় কাঠামো দেখা যায়। নাইওবিয়াম পেন্টাফ্লোরাইড (NbF5) সাদা কঠিন পদার্থ যার গলনাঙ্ক ৭৯.০ °সে এবং নাইওবিয়াম পেন্টাক্লোরাইড (NbCl5) হলুদ রঙের পদার্থ (চিত্রে) যার গলনাঙ্ক ২০৩.৪ °সে। উভয়টিকে আর্দ্রবিশ্লেষণ করলে পাওয়া যায় অক্সাইড ও অক্সিহ্যালাইড, যেমন NbOCl3। পেন্টাক্লোরাইড একটি বহুমুখী বিকারক যা জৈব-ধাতব যৌগ যেমন নাইওবোসিন ডাইক্লোরাইড ((C
5H
5)
2NbCl
2) উৎপন্ন করে।[৭৩] টেট্রাহ্যালাইডগুলো (NbX
4) হলো Nb-Nb বন্ধনযুক্ত গাঢ় রঙের পলিমার। উদাহরণস্বরূপ, কালো রঙের জলগ্রাহী নাইওবিয়াম টেট্রাফ্লোরাইড (NbF4) ও বাদামি বর্ণের নাইওবিয়াম টেট্রাক্লোরাইড (NbCl4)।
নাইওবিয়ামের অ্যানায়নিক হ্যালাইড যৌগসমূহ সুপরিচিত, বিশেষ করে পেন্টাহ্যালাইডগুলো লুইস এসিডের অংশ। এর মধ্যে [NbF7]2− গুরুত্বপূর্ণ। আকরিক থেকে Nb এবং Ta আলাদা করার সময় মধ্যবর্তী পর্যায়ে এটি উৎপন্ন হয়।[৪০] ট্যানটালামের চাইতে নাইওবিয়ামের হেপ্টাফ্লোরাইড অধিক সক্রিয়ভাবে অক্সোপেন্টাফ্লোরাইড গঠনের প্রবণতা দেখায়। অন্যান্য হ্যালাইড অক্টাহেড্রাল [NbCl6]− গঠন করে:
- Nb2Cl10 + 2 Cl− → 2 [NbCl6]−
নিম্ন আণবিক সংখ্যার অন্যান্য ধাতুর মতোই হ্রাসীকৃত হ্যালাইড আয়নের গুচ্ছ দেখা যায়, যার প্রধান উদাহরণ [Nb6Cl18]4−.[৭৪]
নাইট্রাইড ও কার্বাইড
নাইওবিয়ামের অন্যান্য দ্বিমৌল যৌগের মধ্যে নাইওবিয়াম নাইট্রাইড (NbN) নিম্ন তাপমাত্রায় অতিপরিবাহীর মতো আচরণ করে এবং অবলোহিত আলো শনাক্তকরণে ব্যবহৃত হয়।[৭৫] প্রধান কার্বাইড যৌগ নাইওবিয়াম কার্বাইড (NbC) একটি অত্যন্ত কঠিন, তাপসহ, সেরামিক পদার্থ, যা বাণিজ্যিকভাবে ধাতু কাটার যন্ত্র তৈরি করতে ব্যবহৃত হয়।
Remove ads
ব্যবহার
সারাংশ
প্রসঙ্গ

২০০৬ সালে আহরিত ৪৪,৫০০ টন নাইওবিয়ামের মধ্যে প্রায় ৯০% উচ্চমানের ইস্পাত তৈরিতে ব্যবহৃত হয়েছিল। দ্বিতীয় বৃহত্তম ব্যবহার হয় উচ্চ মানের সংকর ধাতু তৈরিতে।[৭৬] বৈশ্বিক উৎপাদনের অতি সামান্য অংশ নাইওবিয়াম সংকর অতিপরিবাহী ও ইলেকট্রনিক উপাদান তৈরিতে ব্যবহৃত হয়।[৭৬]
ইস্পাত উৎপাদন
নাইওবিয়াম মাইক্রোসংকর ইস্পাত তৈরির অন্যতম কার্যকরী উপাদান, যা ইস্পাতের অভ্যন্তরে নাইওবিয়াম কার্বাইড ও নাইওবিয়াম নাইট্রাইড উৎপন্ন করে।[২৯] এই যৌগগুলো ইস্পাতের উপাদানসমূহকে দৃঢ় করে, পুনঃস্ফটিকীকরণ ও অধঃক্ষেপনকে বাধা দেয়। এর প্রভাবে ইস্পাতের কাঠিন্য ও শক্তি বৃদ্ধি করে এবং দৃঢ় সংযুক্তি সৃষ্টি করে।[২৯] মাইক্রোসংকর স্টেইনলেস স্টিলে নাইওবিয়ামের পরিমাণ অত্যন্ত কম (০.১% এর কম[৭৭]) কিন্তু উচ্চ শক্তির নিম্ন মাত্রার সংকর ইস্পাতের একটি গুরুত্বপূর্ণ সংযোজন যা আধুনিক মোটরগাড়ির কাঠামোতে ব্যবহৃত হয়।[২৯] কখনো কখনো ক্ষয়-প্রতিরোধী যন্ত্রাংশ ও ছুরি তৈরিতে অধিক নাইওবিয়াম ব্যবহৃত হয়, যেমন ক্রুসিবল সিপিএম এস১১০ভি মরিচারোধক ইস্পাতে ৩% পর্যন্ত নাইওবিয়াম ব্যবহৃত হয়।[৭৮]
একই নাইওবিয়াম সংকর ধাতু পাইপলাইন তৈরিতেও ব্যবহৃত হয়।[৭৯][৮০]
সুপার সংকর ধাতু

নিকেল-, কোবাল্ট- ও লোহা-ভিত্তিক সুপার সংকর ধাতুগুলোতে ৬.৫% পর্যন্ত নাইওবিয়াম ব্যবহৃত হয়।[৭৭] জেট ইঞ্জিন, গ্যাস টার্বাইন, রকেট সাবঅ্যাসেম্বলি, টার্বো চার্জার সিস্টেম, তাপ প্রতিরোধী ও দহন সম্পাদনকারী যন্ত্রপাতিতে এই ধরনের সুপার সংকর ধাতু ব্যবহৃত হয়। নাইওবিয়াম কাঠিন্য বৃদ্ধিকারী γ''-দশার অধঃক্ষেপন বৃদ্ধি করে যা সুপার সংকর ধাতুর উপাদানসমূহের মধ্যে দৃঢ়তা বৃদ্ধি করে।[৮১]
সুপার সংকর ধাতুর একটি উদাহরণ হলো ইঙ্কোনেল ৭১৮, এর প্রায় ৫০% নিকেল, ১৮.৬% ক্রোমিয়াম, ১৮.৫% লোহা, ৫% নাইওবিয়াম, ৩.১% মলিবডেনাম, ০.৯% টাইটানিয়াম, এবং ০.৪% অ্যালুমিনিয়াম।[৮২][৮৩] এই সুপার সংকর ধাতু নাসার প্রজেক্ট জেমিনির আধুনিক বায়ু কাঠামোয় ব্যবহৃত হয়। অ্যাপোলো অভিযানে নজল হিসেবেও একটি নাইওবিয়াম সংকর ব্যবহৃত হয়। কারণ নাইওবিয়াম ৪০০ °সে তাপমাত্রার উপরে জারিত হয়, তাই সংকর ধাতুগুলো নষ্ট হওয়ার হাত থেকে বাঁচাতে একটি রক্ষাকারী আবরণ তৈরি করে[৮৪]
নাইওবিয়াম-ভিত্তিক সংকরসমূহ
১৯৬০ এর দশকের শুরুর দিকে ওয়াহ চ্যাং কর্পোরেশন ও বোয়িং কোম্পানি যুগ্মভাবে সি-১০৩ সংকর ধাতু উৎপাদন করে। বিশ্বব্যাপী স্নায়ুযুদ্ধ ও মহাকাশ প্রতিযোগিতার কারণে ডুপন্ট, ইউনিয়ন কার্বাইড কর্পোরেশন, জেনারেল ইলেকট্রিক কোম্পানি ও অন্যান্য প্রতিষ্ঠানগুলো একই সময়কালের মধ্যে নাইওবিয়াম সংকর ধাতু তৈরির প্রচেষ্টা চালাতে থাকে। ৮৯% নাইওবিয়াম, ১০% হ্যাফনিয়াম ও ১% টাইটানিয়াম দিয়ে এটি তৈরি এবং লিকুইড রকেট উৎক্ষেপন নজলে ব্যবহৃত হয়। অ্যাপোলো চন্দ্রাভিযানে এটি ব্যবহৃত হয়।[৮৪]
স্পেস এক্সের ফ্যালকন ৯ রকেটের জন্য মার্লিন ভ্যাকুয়াম শ্রেণির ইঞ্জিনের নজল নাইওবিয়াম সংকর থেকে তৈরি।[৮৫]
অক্সিজেনের সাথে নাইওবিয়ামের বিক্রিয়া প্রবণতার ফলে শূণ্যস্থান বা নিষ্ক্রিয় পরিবেশে কাজ করতে হয়, যা উৎপাদন ব্যয় অত্যন্ত বাড়িয়ে দেয়। ভ্যাকুয়াম আর্ক রিমেল্টিং (ভার) ও ইলেকট্রন বিম মেল্টিং (ইবিএম)-কে তৎকালে অত্যন্ত গুরুত্বপূর্ণ পদ্ধতি হিসেবে বিবেচনা করা হয়, কেননা তা নাইওবিয়াম ও অন্যান্য বিকারক ধাতুর উন্নয়নে বেশ কাজে দেয়। সি-১০৩ উৎপাদনকারী প্রকল্পটি ১৯৫৯ সালে শুরু হয় এবং প্রায় সি সিরিজের (সম্ভবত কলাম্বিয়ামের আদ্যক্ষর c থেকে) ২৫৬টি পরীক্ষামূলক নাইওবিয়াম সংকর তৈরি করা হয় যা ধাতুর পাত হিসেবে পরিণত করা যেত। ওয়াহ চ্যাং-এর নিউক্লিয়ার মানের জিরকোনিয়াম সংকর থেকে প্রস্তুত হ্যাফনিয়ামের প্রণালী ছিল, যা তারা বাণিজ্যিকভাবে ব্যবহার করতে চাইছিল। সি-সিরিজের ১০৩তম সংকর ধাতু, Nb-10Hf-1Ti, উচ্চতাপীয় বৈশিষ্ট্য এবং আকার প্রদানযোগ্যতার সুষম সমবায় প্রদর্শন করে। ওয়াহ চ্যাং ১৯৬১ সালে ইবিএম ও ভার ব্যবহার করে সি-১০৩ ব্যবহার করে নির্মিত বাট থেকে শুরু করে পাতে প্রথম ৫০০-পাউন্ড তাপ প্রদান করে। এর উদ্দেশ্যমূলক ব্যবহারের মধ্যে উল্লেখযোগ্য হলো টার্বাইন ইঞ্জিন ও তাপ বিনিমায়ক। সেই সময় থেকে নাইওবিয়ামের উল্লেখযোগ্য সংকরের মধ্যে উল্লেখযোগ্য হলো ফ্যানস্টিল ম্যাটালার্জিক কর্পোরেশনের এফএস৮৫ (Nb-10W-28Ta-1Zr), ওয়াহ চ্যাং ও বোয়িং-এর সিবি১২৯ওয়াই (Nb-10W-10Hf-0.2Y), ইউনিয়ন কার্বাইডের সিবি৭৫২ (Nb-10W-2.5Zr) এবং সুপিরিয়র টার্বো কোম্পানির Nb1Zr।[৮৪]
অতিপরিবাহী চুম্বক
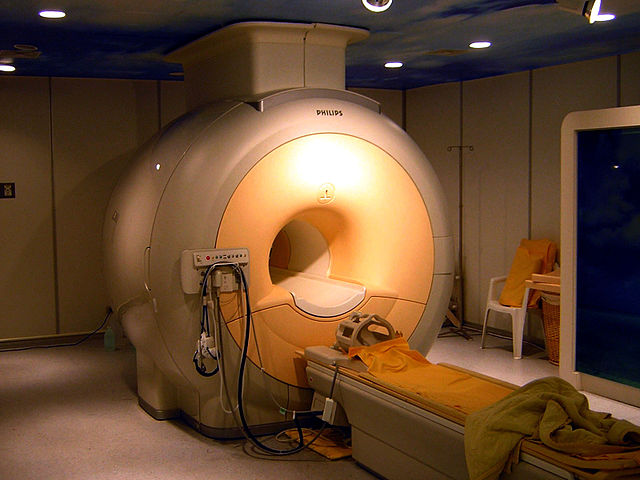
অতিপরিবাহী চুম্বক তৈরির জন্য নাইওবিয়াম-জার্মেনিয়াম (Nb
3Ge), নাইওবিয়াম-টিন (Nb
3Sn), এমনকি নাইওবিয়াম-টাইটানিয়াম সংকর ধাতুর টাইপ-২ অতিপরিবাহী তার ব্যবহার করা হয়।[৮৬][৮৭] এই সকল অতিপরিবাহী চুম্বকগুলো ম্যাগনেটিক রিসোণ্যন্স ইমেজিং ও নিউক্লীয় চৌম্বক অনুনাদ যন্ত্রে ও পার্টিকল এক্সেলারেটর যন্ত্রে ব্যবহৃত হয়।[৮৮] যেমন, লার্জ হ্যাড্রন কলাইডারে ৬০০ টন অতিপরিবাহী তন্তু ব্যবহৃত হয়, আবার আন্তর্জাতিক তাপনিউক্লীয় পরীক্ষা যন্ত্রে প্রায় ৬০০ টন Nb3Sn তন্তু ও প্রায় ২৫০ টন NbTi তন্তু ব্যবহৃত হয়েছে।[৮৯] শুধুমাত্র ১৯৯২ সালেই নাইওবিয়াম-টাইটানিয়াম তার ব্যবহার করে ১ বিলিয়ন মার্কিন ডলারের চেয়ে বেশি মূল্যের ক্লিনিক্যাল চৌম্বকীয় অনুনাদ প্রতিবিম্ব যন্ত্র (এমআরআই) তৈরি করা হয়।<refgeballe" />
অন্যান্য অতিপরিবাহী

মুক্ত ইলেকট্রন লেজার ফ্ল্যাশ (টেসলা লিনিয়ার অ্যাক্সেলারেটর প্রকল্প বাতিলের পর) ও এক্সফেল-এ বিশুদ্ধ নাইওবিয়াম থেকে তৈরি অতিপরিবাহী রেডিও কম্পাঙ্ক (এসআরএফ) গহ্বর ব্যবহৃত হয়েছে।[৯০] ফ্ল্যাশ প্রকল্পের একই এসআরএফ প্রযুক্তি ব্যবহার করে ফার্মিল্যাবের নিম্নতাপীয় মডিউল দল বিশুদ্ধ নাইওবিয়াম থেকে ১.৩ গিগাহার্জ নয় কোষের এসআরএফ গহ্বর তৈরি করে। এই গহ্বরটি আন্তর্জাতিক রৈখিক সংঘর্ষকের ৩০-কিলোমিটার (১৯-মাইল) দীর্ঘ লিনিয়ার পার্টিকল অ্যাক্সেলারেটরে ব্যবহৃত হয়।[৯১] স্ল্যাক ন্যাশনাল অ্যাক্সেলারেটর ল্যাবরেটরির এলসিএলএস-২ ও ফার্মিল্যাবের পিপ-২ -এ একই প্রযুক্তি ব্যবহৃত হয়।[৯২]
অতিপরিবাহী নাইওবিয়াম নাইট্রাইড নির্মিত বোলোমিটারের সংবেদনশীলতার জন্য টেরাহার্জ ফ্রিকুয়েন্সি ব্যান্ডে তড়িৎ-চৌম্বকীয় তোরঙ্গ নিরূপণে একে আদর্শ নির্দেশক হিসেবে গণ্য করা হয়। এই নির্দেশকগুলো হেনরিখ হার্জ সাবমিলিমিটার টেলিস্কোপ, দক্ষিণ মেরু টেলিস্কোপ, রিসিভার ল্যাব টেলিস্কোপ এবং এপেক্স টেলিস্কোপে পরীক্ষা করা হয় এবং [[হারশেল স্পেস অবজারভেটরিতে হাইফাই (HIFI) যন্ত্রপাতিতে ব্যবহৃত হয়।[৯৩]
অন্যান্য ব্যবহার
ইলেক্ট্রোসেরামিক
লিথিয়াম নাইওবেট, যা একটি ফেরোইলেকট্রিক পদার্থ, মোবাইল ফোন ও আলোক মডুলেটরে ও পৃষ্ঠীয় শাব্দিক তরঙ্গ সৃষ্টিকারী যন্ত্র তৈরিতে বিশাল পরিমাণে ব্যবহৃত হয়। লিথিয়াম ট্যানটালেট ও বেরিয়াম টাইটানেটের মতো এটি ABO3 কাঠামোর ফেরোইলেকট্রিক।[৯৪] ট্যানটালাম তড়িৎ ধারকের বিকল্প হিসেবে নাইওবিয়াম তড়িৎ ধারক ব্যবহৃত হলেও,[৯৫] ট্যানটালাম তড়িৎ ধারকের ব্যবহার বেশি দেখা যায়। কাচে নাইওবিয়াম যোগ করে উচ্চ অপবর্তনাঙ্ক পাওয়া যায়, যা থেকে পাতলা ও হালকা চশমা তৈরি করা সম্ভব হয়।
ঔষধ ও গহনা শিল্প
নাইওবিয়াম এবং কিছু নাইওবিয়াম সংকর ধাতু শারীরবৃত্তীয়ভাবে নিষ্ক্রিয় এবং কম শারীরবৃত্তিক প্রতিক্রিয়া সৃষ্টি করে। এই কারণে পেসমেকারের মতো কৃত্রিম ও প্রতিস্থাপনীয় যন্ত্রে নাইওবিয়াম ধাতু ব্যবহৃত হয়।[৯৬] সোডিয়াম হাইড্রোক্সাইডের সাথে নাইওবিয়াম বিক্রিয়া করে একটি সছিদ্র আস্তরণ সৃষ্টি করে যা অসোইন্টিগ্রেশন রোগ নিরাময়ে ব্যবহৃত হয়।[৯৭]
টাইটেনিয়াম, ট্যানটালাম এবং অ্যালুমিনিয়ামের মতো নাইওবিয়ামকে তাপ প্রয়োগে অ্যানোডে রূপান্তর (বিকারক ধাতু অনোডীকরণ) করা যায়, যা থেকে গহনায় বর্ণিল ছটা সৃষ্টি করা হয়।[৯৮][৯৯] এক্ষেত্রে ধাতুর নিম্ন অ্যালার্জেনিক ক্রিয়া ধর্মটি অত্যন্ত গুরুত্বপূর্ণ।[১০০]
মুদ্রা
বিভিন্ন স্মারক মুদ্রায় সোনা ও রূপা প্রভৃতির সাথে নাইওবিয়াম মূল্যবান ধাতু হিসেবে ব্যবহৃত হয়। উদাহরণ হিসেবে ২০০৩ সালে অস্ট্রিয়ায় তৈরি রৌপ্য নাইওবিয়াম ইউরো মুদ্রা উল্লেখযোগ্য। এর উপর পাতলা অক্সাইডের অ্যানোড স্তরে আলোর অপবর্তনের জন্য মুদ্রায় বর্ণিলতা সৃষ্টি হয়।[১০১] ২০১২ সালে দশটি মুদ্রা পাওয়া যায় যার কেন্দ্র নীল, সবুজ, বাদামি, রক্তবর্ণ, বেগুনি ও হলুদ রঙে বর্ণিল। এছাড়া ২০০৪ সালে অস্ট্রিয়ার €২৫ সিমারিং আলপাইন রেলওয়ে সার্ধশতবর্ষ স্মারক মুদ্রা[১০২] ও ২০০৬ সালে €২৫ ইউরোপীয় উপগ্রহ পরিভ্রমণ স্মারক মুদ্রা প্রকাশ করে।[১০৩] ২০০৪ ও ২০০৭ সালে অস্ট্রিয়া লাটভিয়ার জন্যও অনুরূপ মুদ্রা তৈরি করে।[১০৪][১০৫] ২০১১ সালে রয়েল কানাডিয়ান মিন্ট $৫ মানের স্টার্লিং রূপা এবং নাইওবিয়ামের কিছু মুদ্রা বাজারে ছাড়ে যা হান্টার'স মুন নামে পরিচিত।[১০৬] এতে নাইওবিয়ামকে বিশেষভাবে জারিত করা হয়, যার ফলে প্রতিটি মুদ্রা একটি আরেকটি থেকে সম্পূর্ণ ভিন্ন হয়।
অন্যান্য
সোডিয়াম বাষ্প বাতির উচ্চ চাপীয় আর্ক-টিউবের বন্ধনী নাইওবিয়াম বা কখনো কখনো ১% জিরকোনিয়াম সংকর দ্বারা তৈরি করা হয়। অ্যালুমিনা আর্ক টিউবের মতোই নাইওবিয়ামের প্রায় সদৃশ তাপীয় প্রসারণ সহগ বিদ্যমান। অ্যালুমিনা আর্ক টিউব একটি স্বচ্ছ পদার্থ যা এর অভ্যন্তরের উত্তপ্ত সোডিয়াম তরল বা বাষ্পের সাথে রাসায়নিক বিক্রিয়া অর্থাৎ জারণ বিজারণ বিক্রিয়া করে না।[১০৭][১০৮][১০৯]
নাইওবিয়াম কয়েক ধরনের স্থিতিশীল মরিচারোধক ইস্পাতের আর্ক ওয়েল্ডিং রড[১১০] ও পানির ট্যাঙ্কের অ্যানোডে ক্যাথোডীয় সুরক্ষার জন্য ব্যবহৃত হয়। সাধারণত প্লাটিনামের সাথে স্থাপন করা হয়।[১১১][১১২]
প্রোপেনের নির্বাচিত জারণের মাধ্যমে অ্যাক্রিলিক অ্যাসিড তৈরির প্রক্রিয়ায় নাইওবিয়াম ভিন্নধর্মী উচ্চ কার্যকরী প্রভাবকের একটি অন্যতম উপাদান।[১১৩][১১৪][১১৫][১১৬]
এছাড়া পার্কার সৌর পর্যবেক্ষণ মহাকাশযানে সৌর মুকুট গ্রাহক যন্ত্রের উচ্চ ভোল্টেজের তারে নাইওবিয়াম ব্যবহৃত হয়েছে।[১১৭]
Remove ads
সতর্কতা
নাইওবিয়ামের কোনো জৈবিক ক্রিয়া এখন পর্যন্ত আবিষ্কৃত হয়নি। যদিও নাইওবিয়ামের গুঁড়ো চোখ ও ত্বকের জন্য অস্বস্তিকর এবং অগ্নি বিপদ ঘটাতে পারে, তবুও ব্যাপকভাবে নাইওবিয়াম মৌল শারীরবৃত্তীয়ভাবে নিষ্ক্রিয় (সেইসাথে অ্যালার্জি সৃষ্টি করে না) এবং অনপকারী। গহনা শিল্পে এটি অহরহ ব্যবহৃত হয় এবং সেই সাথে কিছু ওষুধে ব্যবহারের জন্য এটি পরীক্ষা করা হয়েছে।[১১৯][১২০]
নাইওবিয়ামের যৌগসমূহের ব্যবহারে সাধারণত খুব কম সংখ্যক মানুষই বিরোধিতা করে, তবে এর মধ্যে কিছু যৌগ বিষাক্ত এবং এসবের ব্যবহারে সতর্কতা আবশ্যক। পানিতে দ্রবণীয় নাইওবেট ও নাইওবিয়াম ক্লোরাইডের ওপর স্বল্প ও দীর্ঘ সময়ব্যাপী সূর্যালোক সম্পাত করে ইঁদুরের ওপর পরীক্ষা করা হয়। ১০ থেকে ১০০ মি.গ্রা./কেজি পরিমাণ নাইওবিয়াম পেন্টাক্লোরাইড ও নাইওবেট ইঁদুরের শরীরে মধ্যম মানের বিষাক্ততা (এলডি৫০) প্রদর্শন করে।[১২১][১২২][১২৩] তবে মৌখিক ব্যবহারে বিষক্রিয়ার মাত্রা আরও কম; ইঁদুরের শরীরে সাতদিন ৯৪০ মি.গ্রা./কেজি প্রয়োগের পর এলডি৫০ মানের বিষাক্ততা প্রদর্শন করে।[১২১]
Remove ads
তথ্যসূত্র
বহিঃসংযোগ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



