শীর্ষ প্রশ্ন
সময়রেখা
চ্যাট
প্রসঙ্গ
সিজিয়াম
ক্ষার ধাতু উইকিপিডিয়া থেকে, বিনামূল্যে একটি বিশ্বকোষ
Remove ads
সিজিয়াম (ইংরেজি: Caesium[৭]) একটি রাসায়নিক উপাদান; এর প্রতীক Cs এবং পারমাণবিক সংখ্যা ৫৫। এটি একটি নরম, রূপালী-স্বর্ণাভ ক্ষার ধাতু। এর গলনাঙ্ক ২৮.৫ °C (৮৩.৩ °F; ৩০১.৬ K)। এটি অদ্যাবধি পাওয়া ওই ৫ টি মৌলিক ধাতুগুলির মধ্যে একটি যা কক্ষ তাপমাত্রায় বা তার কাছাকাছি তাপমাত্রায় তরল অবস্থায় থাকে। সিজিয়ামের ভৌত ও রাসায়নিক বৈশিষ্ট্য রুবিডিয়াম ও পটাশিয়ামের মতো। এটি একটি পাইরোফোরিক পদার্থ; এমনকি -১১৬ °C (-১৭৭ °F) তাপমাত্রায়ও জলের সাথে এটি বিক্রিয়া করে। এটি সর্বনিম্ন তড়িৎ ঋণাত্মক স্থিতিশীল উপাদান, পলিং স্কেলে এর মান ০.৭৯। সিজিয়ামের একমাত্র স্থিতিশীল আইসোটোপ হলো সিজিয়াম-১৩৩। সিজিয়াম প্রধানত পলিউসাইট থেকে নিষ্কাশন করা হয়। সিজিয়াম-১৩৭ একটি নিউক্লিয়ার ফিশনজাত পণ্য যা পারমাণবিক চুল্লি হতে উৎপাদিত বর্জ্য থেকে নিষ্কাশিত হয়। এর পারমাণবিক ব্যাসার্ধ সমস্ত মৌলিক পদার্থের মধ্যে বৃহত্তম যা প্রায় ২৬০ পিকোমিটার।

জার্মান রসায়নবিদ রবার্ট বুনসেন এবং পদার্থবিজ্ঞানী গুস্তাভ কিরশফ ১৮৬০ সালে সদ্য উদ্ভাবিত শিখা বর্ণালীবীক্ষণ যন্ত্র ব্যবহার করে সিজিয়াম আবিষ্কার করেন। প্রথম দিকে সিজিয়ামের প্রয়োগ নির্বাত নলের (ভ্যাকুয়াম টিউব) "গেটার" এবং আলোক-তড়িৎ কোষের মধ্যে সীমাবদ্ধ ছিল। সূক্ষ্ম পারমাণবিক ঘড়িতে সিজিয়াম ব্যাপকভাবে ব্যবহৃত হয়। ১৯৬৭ সালে আন্তর্জাতিক একক পদ্ধতিতে সময়ের সংজ্ঞা নিরূপণ করতে নিস্তেজ সিজিয়াম-১৩৩ পরমাণুর ব্যবহার শুরু হয়। বিজ্ঞানের ভাষায় সেকেন্ডের সংজ্ঞা হল “সিজিয়াম-১৩৩ পরমাণুর নিষ্ক্রিয় অবস্থায় ২টি হাইপারফাইন লেভেলের মধ্যে হওয়া বিকিরণের ৯,১৯২,৬৩১,৭৭০ টি পর্যায়কাল এর সমান সময়”।[৮]
১৯৯০-এর দশক থেকে সিজিয়াম ফরমেট ও খনন কাজে ব্যবহৃত তরল রূপে উপাদানটির ব্যাপক প্রয়োগ হচ্ছে। তবে বিদ্যুৎ উৎপাদন, ইলেকট্রনিক্স এবং রসায়নেও এর বিভিন্ন প্রয়োগ রয়েছে। তেজস্ক্রিয় আইসোটোপ সিজিয়াম-১৩৭ এর অর্ধায়ু প্রায় ৩০ বছর এবং এটি চিকিৎসা সংক্রান্ত যন্ত্রপাতি, ইন্ডাস্ট্রিয়াল গেজ এবং জলবিদ্যায় ব্যবহৃত হয়। অ-তেজস্ক্রিয় সিজিয়াম যৌগগুলি স্বল্পমাত্রায় বিষাক্ত, তবে ধাতুটির বিশুদ্ধ দশায় জলের সাথে বিস্ফোরক প্রতিক্রিয়া করার প্রবণতার কারণে সিজিয়ামকে একটি বিপজ্জনক উপাদান হিসাবে বিবেচনা করা হয়। এর রেডিওআইসোটোপগুলিও স্বাস্থ্য ও পরিবেশের জন্য ক্ষতিকর।
Remove ads
ধর্ম
সারাংশ
প্রসঙ্গ
ভৌত ধর্ম

এর কঠিন অবস্থায়, সমস্ত কঠিন পদার্থের মধ্যে সিজিয়াম সবচেয়ে নমনীয়। মোহজ স্কেলে এটির কাঠিন্য মাত্র ০.২ মোহ। এটি একটি অতিনমনীয়, ফ্যাকাশে সোনালি ধাতু যা স্বল্প পরিমাণ অক্সিজেনের উপস্থিতিতেও তার সঙ্গে বিক্রিয়া করে ধূসর বর্ণ ধারণ করে।[৯][১০][১১] তাই পরিবহনের সময় একে খনিজতেলের (পেট্রোলিয়াম বা ক্রুড অয়েল নয়) মধ্যে রাখা হয়। এটির গলনাঙ্ক ২৮.৫ °C (৮৩.৩ °F) যার ফলে এটি অদ্যাবধি পাওয়া ওই ৫ টি মৌলিক ধাতুগুলির মধ্যে একটি যা কক্ষ তাপমাত্রায় বা তার কাছাকাছি তাপমাত্রায় তরল অবস্থায় থাকে। অন্য ধাতুগুলো হলো রুবিডিয়াম (৩৯°C [১০২°F]), ফ্রান্সিয়াম (আনুমানিক ২৭°C [৮১°F]), পারদ (−৩৯°C [−৩৮°F]) এবং গ্যালিয়াম (৩০°C [৮৬°F])। ব্রোমিনও কক্ষ তাপমাত্রায় তরল (− ৭.২ °C [১৯.০ °F]) তবে এটি একটি হ্যালোজেন, ধাতু নয়। পারদ একমাত্র স্থিতিশীল মৌলিক ধাতু যার গলনাঙ্ক সিজিয়ামের চেয়ে কম।[১২] এছাড়া ধাতুটির স্ফুটনাঙ্ক ৬৪১ °C (১,১৮৬ °F) যা পারদ ছাড়া অন্য সব স্থিতিশীল ধাতুর মধ্যে ন্যূনতম।[১৩] ধারণা করা হয় কোপার্নিসিয়াম এবং ফ্লেরোভিয়ামের স্ফুটনাঙ্ক পারদ এবং সিজিয়ামের তুলনায় কম, তবে এগুলি অত্যন্ত তেজস্ক্রিয় এবং এগুলি ধাতু কিনা তা নিশ্চিত নয়।[১৪][১৫]

সিজিয়াম অন্যান্য ক্ষারীয় ধাতু, সোনা এবং পারদের (সংমিশ্রণ) সাথে মিশে সংকর ধাতু গঠন করে। তবে ৬৫০°C (১২০২°F) এর কম তাপমাত্রায় এটি কোবাল্ট, লোহা, মলিবডেনাম, নিকেল, প্ল্যাটিনাম, ট্যানটালাম বা টাংস্টেনের সাথে মিশ্রিত হয় না। এটি অ্যান্টিমনি, গ্যালিয়াম, ইন্ডিয়াম এবং থোরিয়ামের সাথে সুগঠিত আন্তঃধাতব যৌগ গঠন করে, যা আলোক সংবেদনশীল।[৯] এটি লিথিয়াম ব্যতীত অন্যান্য ক্ষার ধাতুর সাথে মিশ্রিত হয়। ৪১% সিজিয়াম, ৪৭% পটাশিয়াম এবং ১২% সোডিয়ামের মোলার বণ্টনে তৈরি সংকর ধাতুটি (alloy) যেকোনো পরিচিত ধাতব সংকর ধাতুর মধ্যে সর্বনিম্ন গলনাঙ্ক ধারণ করে, যা −৭৮ °C (−১০৮ °F)।[১২] এর কিছু অ্যামালগাম (amalgam) নিয়ে গবেষণা করা হয়েছে; যেমন CsHg₂ এর কালো রঙের উপর একটি উজ্জ্বল বেগুনি ধাতব দ্যুতি লক্ষ করা যায়, অন্যদিকে CsHg সোনালি রঙের হয় এবং এটিরও ধাতব দ্যুতি রয়েছে।[১৬]
সিজিয়ামের সোনালি রঙ এর কারণ হলো ক্ষার ধাতুগুলির ইলেকট্রন উত্তেজিত করতে প্রয়োজনীয় আলোর কম্পাঙ্ক (frequency) গ্রুপটি নিচের দিকে নামার সাথে সাথে হ্রাস পাওয়া। লিথিয়াম থেকে রুবিডিয়ামের ক্ষেত্রে এই কম্পাঙ্ক অতিবেগুনি অঞ্চলে থাকে, কিন্তু সিজিয়ামের ক্ষেত্রে এটি নীল-বেগুনি বর্ণালীতে প্রবেশ করে। অন্য কথায়, ক্ষার ধাতুগুলির প্লাজমোনিক কম্পাঙ্ক লিথিয়াম থেকে সিজিয়ামের দিকে হ্রাস পায়। এর ফলে সিজিয়াম বেগুনি আলোকে আংশিকভাবে শোষণ করে এবং অন্যান্য রং (যেগুলির কম্পাঙ্ক কম) প্রতিফলিত করে; তাই এটি হলদে রঙের দেখায়।[১৭] এর যৌগগুলি নীল[১৮][১৯] বা বেগুনি[১৯] রঙের শিখা সৃষ্টি করে।
রূপভেদ
সিজিয়াম বিভিন্ন রূপভেদ রয়েছে, যার মধ্যে একটি ডাইসিজিয়াম নামে পরিচিত যা একটি ডাইমার।[২০]
রাসায়নিক ধর্ম
সিজিয়াম ধাতু অত্যন্ত প্রতিক্রিয়াশীল এবং পাইরোফোরিক। এটি বাতাসের সংস্পর্শে স্বতঃস্ফূর্তভাবে জ্বলে ওঠে এবং নিন্ম তাপমাত্রাতেও পানির সাথে বিস্ফোরক প্রতিক্রিয়া করে, যার প্রবণতা অন্যান্য ক্ষার ধাতুগুলোর চেয়েও বেশি।[৯] এটি −১১৬ °C (−১৭৭ °F) এর মতো নিম্ন তাপমাত্রায় বরফের সাথেও প্রতিক্রিয়া করে।[১২] এই উচ্চ প্রতিক্রিয়াশীলতার কারণে, সিজিয়াম ধাতু স্বাস্থ্য ঝুঁকিপূর্ণ পদার্থ হিসেবে বর্গীভূত। এটি নিরুদ (পানিশূন্য), সম্পৃক্ত হাইড্রোকার্বনে (যেমন খনিজতেল) সংরক্ষণ ও পরিবহন করা হয়। এটি শুধুমাত্র নিষ্ক্রিয় গ্যাসের (যেমন আর্গন) উপস্থিতিতে নাড়াচাড়া করা যেতে পারে। তবে, পানির সংস্পর্শে সিজিয়ামের বিস্ফোরণ সাধারণত পানির সংস্পর্শে সোডিয়ামের বিস্ফোরণের চেয়ে কম শক্তিশালী হয়, কারণ সিজিয়াম পানির সাথে স্পর্শের সাথে সাথে তাৎক্ষণিকভাবে বিস্ফোরণ ঘটায়, যার ফলে হাইড্রোজেন জমা হওয়ার সময় কম পায়।[২১] সিজিয়াম বায়ুশূন্য বোরোসিলিকেট গ্লাস অ্যাম্পুলে সংরক্ষণ করা যেতে পারে। পরিমাণে ১০০ গ্রাম (৩.৫ আউন্স) এর বেশি হলে, সিজিয়াম বায়ুনিরোধক স্টেইনলেস স্টিলের পাত্রে পরিবহন করা হয়।[৯]
সিজিয়ামের রসায়ন অন্যান্য ক্ষার ধাতুর মতোই, বিশেষ করে রুবিডিয়ামের, যা পর্যায় সারণিতে সিজিয়ামের ওপরে অবস্থান করে।[২২] অন্যান্য সব ক্ষার ধাতুর মতই সিজিয়াম সাধারণভাবেই +১ জারন অবস্থায় থাকে। তবে, সিজাইডে (সিজিয়াম এর অ্যালকালাইড অবস্থা) এই ধর্মের ব্যতিক্রম লক্ষ করা যায় এখানে এটি Cs− অ্যানায়ন ধারণ করে এবং −১ জারন অবস্থায় থাকতে পারে।[২৩] তাত্ত্বিক গবেষণায় দেখা গেছে যে, চরম চাপের (৩০ GPa এর বেশি) অবস্থায় এর অভ্যন্তরীণ ৫p ইলেকট্রনগুলো রাসায়নিক বন্ধন তৈরি করতে পারে, যেখানে সিজিয়াম সপ্তম ৫p উপাদানের মতো আচরণ করে। এই ব্যাপারটি ইঙ্গিত করে যে এমন অবস্থায় সিজিয়াম উচ্চতর জারন অবস্থায় (+২ থেকে +৬) অবস্থান করতে পারে।[২৪][২৫] সিজিয়াম অন্যান্য ক্ষার ধাতুর (অ-তেজস্ক্রিয়) তুলনায় বেশি পারমাণবিক ভর এবং বেশি তড়িৎধনাত্মক হওয়ায় কিছু সামান্য পার্থক্য লক্ষ করা যেতে পারে।[২৬] সিজিয়াম সবচেয়ে তড়িৎধনাত্মক রাসায়নিক উপাদান।[১২] সিজিয়াম আয়ন অন্যান্য হালকা ক্ষার ধাতুর আয়নগুলোর তুলনায় বড় এবং কম "শক্তিশালী"।
যৌগসমূহ
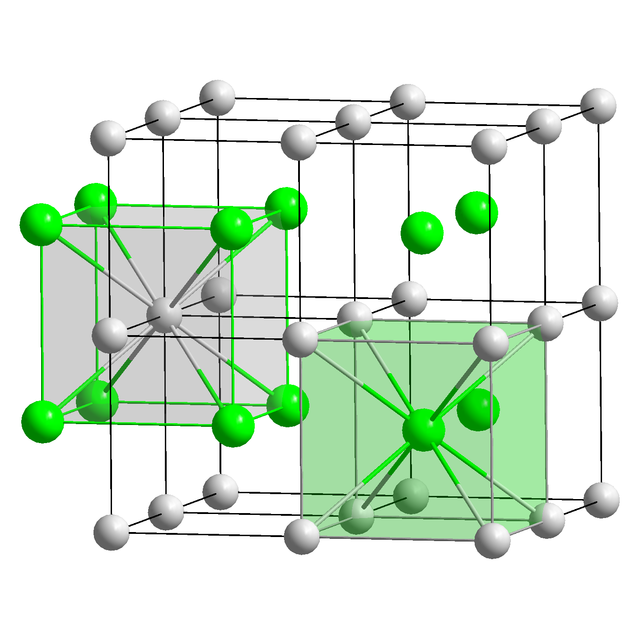
বেশিরভাগ সিজিয়াম যৌগে এই উপাদানটি ক্যাটায়ন (Cs⁺) আকারে থাকে, যা বিভিন্ন ধরণের ঋণাত্মক আয়ন তথা অ্যানায়নের সাথে আয়নিক বন্ধন গঠন করে। তবে একটি বিশেষ ব্যতিক্রম হল সিজাইড আয়ন (Cs⁻)[২৩] এবং আরও কিছু সাবঅক্সাইড (অক্সাইড পরিচ্ছেদে দেখুন)। সাম্প্রতিককালে, ধারণা করা হয় যে উচ্চ চাপের অধীনে সিজিয়াম পি-ব্লকের উপাদানের মত আচরণ করতে পারে এবং আরও উচ্চ জারণ অবস্থার (যেমন CsFn যেখানে n > 1) ফ্লোরাইড গঠন করতে সক্ষম হতে পারে।[২৭] তবে এই ধারণাটি আরও পরীক্ষার মাধ্যমে প্রমাণিত হওয়া প্রয়োজন।[২৮]
Cs⁺ এর লবণ সাধারণত বর্ণহীন হয়, যদি না ঋণাত্মক আয়নটি নিজেই রঙিন হয়। অনেক সাধারণ লবণ জল শোষণ করে (জলাকর্ষী), তবে তা কোমল ক্ষার ধাতুসমূহের সংশ্লিষ্ট লবণের তুলনায় কম। ফসফেট,[২৯] অ্যাসিটেট, কার্বনেট, হ্যালাইড, অক্সাইড, নাইট্রেট, এবং সালফেট লবণ পানিতে দ্রবণীয়। তবে এর দ্বৈত লবণগুলো (অথবা যুগ্ম বা দ্বি) সাধারণত কম দ্রবণীয় হয়। আর সিজিয়াম অ্যালুমিনিয়াম সালফেটের কম দ্রবণীয়তার ব্যাপারটিকে Cs কে আকরিক থেকে পরিশোধনের সময় কাজে লাগানো হয়। অ্যান্টিমনি (যেমন CsSbCl₄), বিসমাথ, ক্যাডমিয়াম, তামা, লোহা এবং সীসার সাথে এর দ্বৈত লবণগুলিও কম দ্রবণীয়।[৯]
সিজিয়াম হাইড্রোক্সাইড (CsOH) অত্যন্ত জলাকর্ষী এবং শক্তিশালী ক্ষারক।[২২] এটি দ্রুত সিলিকন-এর মতো অর্ধপরিবাহীর পৃষ্ঠ ক্ষয় করে ফেলে।[৩০] রসায়নবিদরা পূর্বে CsOH-কে "শক্তিশালীতম ক্ষারক" হিসেবে গণ্য করতেন, যা মূলত বৃহৎ সিজিয়াম (Cs⁺) আয়ন এবং হাইড্রক্সাইড (OH⁻)-এর মধ্যে অপেক্ষাকৃত দুর্বল আকর্ষণের দিকটিকে প্রতিফলিত করে।[১৮] এটি আসলে সবচেয়ে শক্তিশালী আরহেনিয়াস ক্ষারক। তবে কিছু যৌগ যেমন এন-বিউটাইলিথিয়াম, সোডিয়াম অ্যামাইড, সোডিয়াম হাইড্রাইড, সিজিয়াম হাইড্রাইড ইত্যাদি, যা পানির সাথে প্রবলভাবে বিক্রিয়া করে এবং পানিতে দ্রবীভূত হতে পারে না, তবে কেবলমাত্র অনাদ্র পোলার অ্যাপ্রোটিক দ্রাবকে ব্যবহৃত হয়, ব্রনস্টেড-লাউরি অম্ল-ক্ষার তত্ত্বের ভিত্তিতে আরও ক্ষারীয়।[২২]
সিজিয়াম এবং সোনার একটি স্টয়কিওমিতিক মিশ্রণ উত্তপ্ত করা হলে হলুদ সিজিয়াম অরাইড (Cs⁺Au⁻) তৈরি হয়। এখানে অরাইড অ্যানায়ন একটি ছদ্মহ্যালোজেন হিসাবে কাজ করে। যৌগটি পানির সাথে তীব্র প্রতিক্রিয়া করে সিজিয়াম হাইড্রোক্সাইড, ধাতব সোনা এবং হাইড্রোজেন গ্যাস উৎপন্ন করে। তরল অ্যামোনিয়াতে এটি সিজিয়াম-নির্দিষ্ট আয়ন বিনিময় রজনের সাথে প্রতিক্রিয়া করে টেট্রামিথাইলঅ্যামোনিয়াম অরাইড তৈরি করতে পারে। অনুরূপ প্লাটিনাম যৌগ, লাল সিজিয়াম প্লাটিনাইড (Cs₂Pt), প্লাটিনাইড আয়ন ধারণ করে, যা একটি ছদ্মক্যালকোজেন হিসাবে আচরণ করে।
জটিল যৌগ
অন্যান্য ধাতব ক্যাটায়নের মতো, দ্রবণে Cs⁺ লুইস ক্ষারের সাথে জটিল যৌগ গঠন করে। এর বড় আকারের কারণে Cs⁺ সাধারণত ৬-এর অধিক সমন্বয় সংখ্যা গ্রহণ করে। যা ছোট ধাতব ক্ষার ক্যাটায়নের জন্য আদর্শ সংখ্যা (সাধারণত ৪-৬)। CsCl-এর অষ্টক-সমন্বয়ে (8-coordination) এই পার্থক্যটি স্পষ্ট হয়ে উঠে। এই উচ্চ সমন্বয় সংখ্যা এবং দুর্বলতার (সমযোজী বন্ধন গঠনের প্রবণতা) ব্যাপারটিকে Cs⁺-কে অন্যান্য ক্যাটায়ন থেকে আলাদা করতে কাজে লাগানো হয়। বিশেষ করে পারমাণবিক বর্জ্য ব্যবস্থাপনার ক্ষেত্রে, যেখানে ¹³⁷Cs⁺-কে প্রচুর পরিমাণ অ-তেজস্ক্রিয় K⁺ থেকে আলাদা করতে হয়।[৩১]
হ্যালাইড

সিজিয়াম ফ্লোরাইড (CsF) একটি জলাকর্ষী সাদা কঠিন পদার্থ যা অর্গানোফ্লোরিন রসায়নে ফ্লোরাইড আয়নের উৎস হিসাবে ব্যাপকভাবে ব্যবহৃত হয়।[৩২] সিজিয়াম ফ্লোরাইডের কাঠামো হ্যালাইট ধরনের, যার অর্থ Cs+ এবং F− একটি ঘনকাকার ঘনসন্নিবেশ বিন্যাস তৈরি করে, যেমনটা দেখা যায় সোডিয়াম ক্লোরাইডে Na+ এবং Cl− এর মধ্যে।[২২] লক্ষণীয় ব্যাপার হচ্ছে, সিজিয়াম এবং ফ্লোরিন যথাক্রমে সকল পরিচিত মৌলগুলোর মধ্যে সর্বনিম্ন এবং সর্বোচ্চ তড়িৎঋণাত্মকতা প্রদর্শন করে।
সিজিয়াম ক্লোরাইড (CsCl) অতি পরিচিত ঘনকাকার কেলাসন পদ্ধতিতে কেলাস গঠন করে। এটিকে "সিজিয়াম ক্লোরাইড কাঠামো"ও বলা হয়।[২৬] এই কাঠামোগত মোটিফটি একটি সরল ঘনকাকার ল্যাটিস নিয়ে গঠিত, যেখানে প্রতিটি সিজিয়াম পরমাণু আটটি ক্লোরাইড পরমাণু দ্বারা এবং প্রতিটি ক্লোরাইড পরমাণু আটটি সিজিয়াম পরমাণু দ্বারা বেষ্টিত থাকে। ক্লোরাইড পরমাণুগুলি ঘনক্ষেত্রের প্রান্তে ল্যাটিস বিন্দুতে অবস্থান করে অন্যদিকে সিজিয়াম পরমাণুগুলি ঘনক্ষেত্রের কেন্দ্রে থাকা গহ্বরে অবস্থান করে। এই কাঠামোটি CsBr এবং CsI ছাড়াও আরও অনেক যৌগের ক্ষেত্রে দেখা যায় যদিও তাতে সিজিয়াম উপস্থিত নেই। অন্যদিকে, অন্যান্য বেশিরভাগ ক্ষারীয় হ্যালাইডের সোডিয়াম ক্লোরাইড (NaCl) কাঠামো থাকে।[২৬] CsCl কেলাস কাঠামোটি তার ধরণের জন্য উপযুক্ত, কারণ Cs⁺ (১৭৪ pm) এবং Cl⁻ (১৮১ pm) এর আয়নিক ব্যাসার্ধ তাদের মধ্যে ঘনকাকার ঘনসন্নিবেশের জন্য আদর্শ।[৩৩]
অক্সাইড

11O
3 ক্লাস্টার
অন্য ক্ষার ধাতুগুলোর তুলনায় সিজিয়াম অক্সিজেনের সাথে অসংখ্য পরিমাণে যুগ্ম যৌগ তৈরি করে। যখন সিজিয়াম বাতাসে প্রজ্জ্বলিত হয় তখন প্রধান পণ্য হিসেবে সুপারঅক্সাইড CsO₂ তৈরি হয়।[৩৪] "স্বাভাবিক" সিজিয়াম অক্সাইড (Cs₂O) হলুদ-কমলা রঙের ষড়ভুজাকৃতির কেলাস গঠন করে।[৩৫] এটি একমাত্র অক্সাইড যা অ-CdCl₂ ধরনের।[৩৬] এটি ২৫০ °C (৪৮২ °F)-এ বাষ্পীভূত হয় এবং ৪০০ °C (৭৫২ °F)-এর উপরের তাপমাত্রায় সিজিয়াম ধাতু এবং পারঅক্সাইড Cs₂O₂-এ ভেঙে যায়। সুপারঅক্সাইড এবং ওজোনাইড CsO₃ ছাড়াও,[৩৭][৩৮] বেশ কয়েকটি উজ্জ্বল রঙের সাবঅক্সাইড নিয়েও গবেষণা করা হয়েছে।[৩৯] এর মধ্যে রয়েছে Cs₇O, Cs₄O, Cs₁₁O₃, Cs₃O (গাঢ় সবুজ[৪০]), CsO, Cs₃O₂,[৪১] এবং Cs₇O₂।[৪২][৪৩] শেষেরটিকে (Cs₇O₂) বায়ুশূন্য পরিবেশে উত্তপ্ত করে Cs₂O তৈরি করা যেতে পারে।[৩৬] সিজিয়াম সালফার, সেলেনিয়াম এবং টেলুরিয়ামের সাথেও যুগ্ম যৌগ তৈরি করে।[৯]
আইসোটোপ
এ পর্যন্ত সিজিয়ামের ৪১টি আইসোটোপ পাওয়া গিয়েছে। যার ভর সংখ্যা (অর্থাৎ নিউক্লিয়াসে নিউক্লিয়নের সংখ্যা) ১১২ থেকে ১৫২ পর্যন্ত। এর মধ্যে কয়েকটি জড় তারার অভ্যন্তরে ধীর নিউট্রন অধিগ্রহণ প্রক্রিয়া (এস-প্রক্রিয়া)[৪৪] এবং অতিনবতারা বিস্ফোরণের আর-প্রক্রিয়ার মাধ্যমে হালকা পদার্থ থেকে সংশ্লেষিত হয়।[৪৫] সিজিয়ামের একমাত্র স্থিতিশীল আইসোটোপ হলো ১৩৩Cs। যার মধ্যে ৭৮টি নিউট্রন রয়েছে। যদিও এর পারমাণবিক ঘূর্ণন বিপুল (+৭/২+), এটি নিউক্লীয় চৌম্বক অনুরণন (NMR) গবেষণার জন্য ১১.৭ MHz অনুনাদী কম্পাঙ্কে ব্যবহৃত হতে পারে।[৪৬]
তেজস্ক্রিয় আইসোটোপ ১৩৫Cs-এর অর্ধায়ু প্রায় ২.৩ মিলিয়ন বছর, যা সিজিয়ামের সব তেজস্ক্রিয় আইসোটোপের মধ্যে দীর্ঘতম। ১৩৭Cs এবং ১৩৪Cs-এর অর্ধায়ু যথাক্রমে ৩০ বছর এবং ২ বছর। ১৩৭Cs বিটা ক্ষয়ের মাধ্যমে স্বল্পস্থায়ী ১৩৭mBa-তে রূপান্তরিত হয় এবং পরে অ-তেজস্ক্রিয় বেরিয়ামে পরিণত হয়। অন্যদিকে ১৩৪Cs সরাসরি ১৩৪Ba-তে রূপান্তরিত হয়। ১২৯, ১৩১, ১৩২ এবং ১৩৬ ভর সংখ্যাযুক্ত আইসোটোপগুলোর অর্ধায়ু একদিন থেকে দুই সপ্তাহ পর্যন্ত। অপরদিকে অন্যান্য বেশিরভাগ আইসোটোপের অর্ধায়ু কয়েক সেকেন্ড থেকে এক সেকেন্ডেরও কম। অন্তত ২১টি স্বল্প-সুস্থিত নিউক্লিয়ার আইসোমার বিদ্যমান রয়েছে। ১৩৪mCs ছাড়া (যার অর্ধায়ু প্রায় ৩ ঘণ্টা) অন্যান্য সবগুলোই খুবই অস্থির এবং কয়েক মিনিট বা তার কম অর্ধায়ুতে ক্ষয়প্রাপ্ত হয়।[৪৭][৪৮]
১৩৫Cs পারমাণবিক চুল্লিতে উৎপন্ন ইউরেনিয়ামের দীর্ঘস্থায়ী ফিশন পণ্যগুলোর একটি।[৪৯] তবে এই ফিশন পণ্যের উৎপাদন বেশিরভাগ পারমাণবিক চুল্লিতে কমে যায়, কারণ এর পূর্ববর্তী পদার্থ ১৩৫Xe একটি শক্তিশালী নিউট্রন শোষক (neutron poison/neutron absorber) এবং প্রায়শই ১৩৫Cs-এ ক্ষয় হওয়ার আগে স্থিতিশীল ১৩৬Xe-তে রূপান্তরিত হয়।[৫০][৫১]
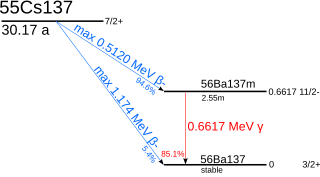
১৩৭Cs থেকে ১৩৭mBa-তে আসার সময় বিটা ক্ষয়ের ফলে ১৩৭mBa স্থিতিশীল অবস্থা (গ্রাউন্ড স্টেট) ১৩৭Ba-তে শিথিল হওয়ার সময় গামা রশ্মি নির্গত হয়, যেখানে নির্গত ফোটনের শক্তি ০.৬৬১৭ MeV।[৫২] ১৩৭Cs এবং ৯০Sr হল নিউক্লিয়ার ফিশনের প্রধানণ্য এবং ব্যবহৃত পারমাণবিক জ্বালানির কয়েক বছর ঠান্ডা হওয়ার পরও তেজস্ক্রিয়ধর্মিতার প্রধান উৎস, যা কয়েক শত বছর পর্যন্ত স্থায়ী হয়।[৫৩] এই দুই আইসোটোপ চেরনোবিল বিপর্যয়ের এলাকায় অবশিষ্ট তেজস্ক্রিয়ধর্মিতার প্রধান উৎস।[৫৪] কম অধিগ্রহণ হারের কারণে, ১৩৭Cs-কে নিউট্রন অধিগ্রহণের মাধ্যমে নিঃশেষ করা সম্ভব নয়। বর্তমানে এর একমাত্র সমাধান হল সময়ের সঙ্গে সঙ্গে ক্ষয়প্রাপ্ত হওয়া।[৫৫]
নিউক্লিয়ার ফিশন থেকে উৎপন্ন প্রায় সব সিজিয়াম মূলত নিউট্রন-সমৃদ্ধ বিভাজন পণ্যগুলোর বিটা ক্ষয়ের মাধ্যমে আসে। যেখানে এটি আয়োডিন এবং জেননের বিভিন্ন আইসোটোপ অতিক্রম করে।[৫৬] যেহেতু আয়োডিন এবং জেনন উদ্বায়ী এবং পারমাণবিক জ্বালানি বা বায়ুর মাধ্যমে ছড়িয়ে পড়তে পারে তাই তেজস্ক্রিয়ধর্মী সিজিয়াম প্রায়শই বিভাজনের মূল স্থান থেকে অনেক দূরে তৈরি হয়।[৫৭] ১৯৫০-এর দশক থেকে ১৯৮০-এর দশক পর্যন্ত পারমাণবিক অস্ত্র পরীক্ষার সময় ১৩৭Cs বায়ুমণ্ডলে মুক্তি পায় এবং তেজস্ক্রিয় অবক্ষেপণের একটি উপাদান হিসেবে পৃথিবী-পৃষ্ঠে ফিরে আসে। এটি সেই সময়ে মাটি এবং পললের অবস্থার পরিবর্তনের কারণ।[৯]
উৎপত্তি

সিজিয়াম একটি অপেক্ষাকৃত বিরল মৌল। পৃথিবীর ভূ-ত্বকে গড়ে প্রতি মিলিয়নে ৩ অংশ (৩ পিপিএম) সিজিয়াম পাওয়া যায় বলে ধারণা করা হয়।[৫৮] এটি পদার্থের মধ্যে ৪৫তম সর্বাধিক প্রতুল মৌল এবং ধাতুর মধ্যে ৩৬তম সর্বাধিক প্রতুল মৌল।[৫৯] সিজিয়াম রাসায়নিকভাবে ঘনিষ্ঠরূপে সম্পর্কিত রুবিডিয়ামের তুলনায় ৩০ গুণ কম প্রতুল।[৯]
সিজিয়াম তার বৃহৎ আয়নিক ব্যাসার্ধের জন্য "বিষম মৌল"গুলোর মধ্যে একটি হয়ে উঠেছে।[৬০] ম্যাগমা কেলাসীভবনের সময় সিজিয়াম তরল অবস্থায় ঘনিভূত হয় এবং শেষে কেলাসে রূপান্তরিত হয়। এই কারণে, সিজিয়ামের বৃহত্তম মজুদ জোন পেগমাটাইট আকরিকের মধ্যে পাওয়া যায়, যা এই সমৃদ্ধকরণ প্রক্রিয়ার মাধ্যমে গঠিত হয়। রুবিডিয়াম যত সহজে পটাশিয়ামকে প্রতিস্থাপিত করতে পারে সিজিয়াম তত সহজে পারে না। তাই ক্ষারীয় বাষ্পীভূত খনিজ যেমন সিলভাইট (KCl) এবং কার্নালাইট (KMgCl₃·6H₂O) মাত্র ০.০০২% সিজিয়াম ধারণ করতে পারে। ফলস্বরূপ, সিজিয়াম খুব কম সংখ্যক খনিজে পাওয়া যায়। কিছু খনিজ, যেমন বেরিল (Be₃Al₂(SiO₃)₆) এবং অ্যাভোগাড্রাইট ((K,Cs)BF₄)-এ সিজিয়ামের শতাংশ পরিমাণ থাকতে পারে। পেজোটাইট (Cs(Be₂Li)Al₂Si₆O₁₈)-এ সিজিয়াম অক্সাইড (Cs₂O) সর্বোচ্চ ১৫ wt% এবং বিরল খনিজ লন্ডোনাইটে ((Cs,K)Al₄Be₄(B,Be)₁₂O₂₈) সর্বোচ্চ ৮.৪ wt% পাওয়া যায়। সাধারণত রোডিজাইটে এর উপস্থিতি আরও কম।[৯] অর্থনৈতিকভাবে গুরুত্বপূর্ণ একমাত্র সিজিয়াম আকরিক হলো পলিউসাইট (Cs(AlSi₂O₆))। যা সারা বিশ্বে কয়েকটি স্থানে জোন পেগমাটাইটে পাওয়া যায়। এটি লিথিয়ামের বাণিজ্যিকভাবে গুরুত্বপূর্ণ খনিজ লেপিডোলাইট ও পেটালাইটের সাথে সম্পর্কিত। পেগমাটাইটে কণার বড় আকার এবং খনিজগুলোর উল্লেখযোগ্যভাবে পৃথক থাকার কারণে এটি খননের জন্য লাভজনক ও আদর্শ, উচ্চ-গ্রেডের আকরিক উৎপাদন করে।[৬১]
বিশ্বের সবচেয়ে গুরুত্বপূর্ণ এবং সমৃদ্ধ সিজিয়াম উৎস হচ্ছে কানাডার ম্যানিটোবায় বার্নিক লেকের ট্যানকো খনি। যেখানে প্রায় ৩৫০,০০০ মেট্রিক টন পলিউসাইট আকরিক আছে বলে অনুমান করা হয়। যা বিশ্বের রিজার্ভের দুই তৃতীয়াংশেরও বেশি।[৬১][৬২] যদিও পলিউসাইটে সিজিয়ামের স্টয়কিওমিতিক পরিমাণ ৪২.৬%, এই ক্ষেত্র থেকে প্রাপ্ত শুদ্ধ পলিউসাইট নমুনাগুলির মধ্যে কেবল ৩৪% সিজিয়াম রয়েছে, এবং এর গড় পরিমাণ হচ্ছে ২৪wt%।[৬২] বাণিজ্যিক পলিউসাইটে ১৯% এর বেশি সিজিয়াম থাকে।[৬৩] জিম্বাবুয়ের বিকিটা পেগমাটাইট ক্ষেত্রটি তার পেটালাইটের জন্য খনন করা হয়, তবে এতে উল্লেখযোগ্য পরিমাণ পলিউসাইটও রয়েছে। পলিউসাইটের আরেকটি উল্লেখযোগ্য উৎস হচ্ছে নামিবিয়ার ক্যারিবিব মরুভূমি।[৬২] বর্তমান বিশ্বে খনন হার প্রতি বছর ৫ থেকে ১০ মেট্রিক টন হওয়ায় এর রিজার্ভ হাজার বছর ধরে টিকে থাকবে।[৯]
Remove ads
উৎপাদন
ইতিহাস
সারাংশ
প্রসঙ্গ

১৮৬০ সালে, রবার্ট বুনসেন এবং গুস্তাভ কিরশফ জার্মানির ডুরখেইম শহরে, খনিজ পানিতে সিজিয়াম আবিষ্কার করেন। নির্গত বর্ণালীতে উজ্জ্বল নীল রেখার কারণে তারা ল্যাটিন শব্দ caesius থেকে নামটি গ্রহণ করেন। যার অর্থ ‘নীলচে ধূসর’।[টীকা ১][৬৪][৬৫][৬৬] সিজিয়াম ছিল প্রথম মৌল যা বর্ণালিবীক্ষণ যন্ত্র ব্যবহার করে আবিষ্কৃত হয়েছিল। বুনসেন এবং কিরশফ মাত্র এক বছর আগে এই যন্ত্রটি উদ্ভাবন করেছিলেন।[১২]
বিশুদ্ধ সিজিয়ামের নমুনা সংগ্রহ করার জন্য ৪৪,০০০ লিটার (৯,৭০০ imp gal; ১২,০০০ US gal) খনিজ জল বাষ্পীভূত করা হয়েছিল, যা থেকে ২৪০ কিলোগ্রাম (৫৩০ পাউন্ড) ঘনীভূত লবণ-দ্রবণ তৈরি হয়। ক্ষারীয় মৃত্তিকা ধাতুগুলোকে সালফেট বা অক্সালেট আকারে পৃথক করা হয়, যাতে ক্ষার ধাতু দ্রবণে থেকে যায়। পরে এই দ্রবণকে নাইট্রেটে রূপান্তর এবং ইথানলের সাহায্যে নিষ্কাশনের মাধ্যমে সোডিয়াম-মুক্ত একটি মিশ্রণ তৈরি করা হয়। এই মিশ্রণ থেকে লিথিয়ামকে অ্যামোনিয়াম কার্বনেট ব্যবহার করে আলাদা করা হয়। পটাসিয়াম, রুবিডিয়াম এবং সিজিয়াম ক্লোরোপ্লাটিনিক অ্যাসিডের সাথে মিলে অদ্রবণীয় লবণ তৈরি করে, তবে গরম পানিতে এই লবণের দ্রবণীয়তার সামান্য পার্থক্য দেখা যায়। ফলে কম দ্রবণীয় সিজিয়াম এবং রুবিডিয়াম হেক্সাক্লোরোপ্লাটিনেট ((Cs,Rb)2PtCl6) আংশিক কেলাসনের মাধ্যমে আলাদা করা হয়। পরবর্তীতে হেক্সাক্লোরোপ্লাটিনেটকে হাইড্রোজেনের সাহায্যে বিজারণের মাধ্যমে সিজিয়াম এবং রুবিডিয়াম পৃথক করা হয়। এরপর তাদের কার্বনেটের অ্যালকোহলে দ্রবণীয়তার পার্থক্যকে কাজে লাগিয়ে তাদের আলাদা করা হয়। এই প্রক্রিয়ায় ৪৪,০০০ লিটার খনিজ জল থেকে ৯.২ গ্রাম (০.৩২ আউন্স) রুবিডিয়াম ক্লোরাইড এবং ৭.৩ গ্রাম (০.২৬ আউন্স) সিজিয়াম ক্লোরাইড পাওয়া যায়।[৬৫]
সিজিয়াম ক্লোরাইড থেকে দুই বিজ্ঞানী নতুন উপাদানের পারমাণবিক ওজন অনুমান করেছিলেন ১২৩.৩৫ (বর্তমান গ্রহণযোগ্য মান ১৩২.৯)।[৬৫] তারা গলিত সিজিয়াম ক্লোরাইডের তড়িৎ বিশ্লেষণ (ইলেক্ট্রোলাইসিস) করে মৌলিক সিজিয়াম তৈরি করার চেষ্টা করেন কিন্তু ধাতুর পরিবর্তে একটি নীল সমজাতীয় পদার্থ পান যা "খালি চোখে বা অনুবীক্ষণ যন্ত্রের নিচে কোনো ধাতব পদার্থের ক্ষুদ্রতম চিহ্নও দেখায়নি"। ফলে তারা এটিকে একটি সাবক্লোরাইড (Cs₂Cl) হিসেবে চিহ্নিত করেন। প্রকৃতপক্ষে, উৎপন্ন পদার্থটি সম্ভবত ধাতু এবং সিজিয়াম ক্লোরাইডের একটি কোলয়েডাল মিশ্রণ ছিল।[৬৭] ক্লোরাইডের জলীয় দ্রবণের তড়িৎ বিশ্লেষণ যখন পারদ ক্যাথোডের সাহায্যে করা হয় তখন সিজিয়াম অ্যামালগাম উৎপন্ন হয় যা জলীয় অবস্থায় সহজেই ভেঙে যায়।[৬৫] অবশেষে, সুইডিশ রসায়নবিদ কার্ল সিটারবার্গ তার ডক্টরেট গবেষণার সময় কেকুলে এবং বুনসেনের সাথে কাজ করার সময় খাঁটি সিজিয়াম ধাতু পৃথক করতে সক্ষম হন।[৬৬] ১৮৮২ সালে তিনি সিজিয়াম সায়ানাইডের তড়িৎ বিশ্লেষণ করে সিজিয়াম ধাতু তৈরি করেন যা ক্লোরাইডের সমস্যাগুলি এড়িয়ে যায়।[৬৮]
ঐতিহাসিকভাবে সিজিয়ামের সবচেয়ে গুরুত্বপূর্ণ ব্যবহার ছিল গবেষণা ও উন্নয়নে, প্রধানত রসায়ন ও বৈদ্যুতিক ক্ষেত্রে। ১৯২০-এর দশক পর্যন্ত সিজিয়ামের খুব কম ব্যবহার ছিল, যখন এটি রেডিও ভ্যাকুয়াম টিউবে ব্যবহৃত হতে শুরু করে। সেখানে এটি দুটি ভূমিকা পালন করত: একটি গেটার হিসেবে এটি উৎপাদনের পরে অতিরিক্ত অক্সিজেন অপসারণ করত এবং উত্তপ্ত ক্যাথোডের উপর আবরণ হিসেবে এটি তড়িৎ পরিবাহিতা বাড়িয়ে তুলত। ১৯৫০-এর দশক পর্যন্ত সিজিয়ামকে উচ্চ কর্মক্ষমতাসম্পন্ন শিল্প ধাতু হিসেবে স্বীকৃতি দেওয়া হয়নি।[৬৯] সক্রিয় না থাকা সিজিয়ামের ব্যবহারের মধ্যে ছিল আলোক সংবেদনশীল কোষ, ফটোমাল্টিপ্লায়ার টিউব, ইনফ্রারেড স্পেকট্রোফটোমিটারের অপটিক্যাল উপাদান, বিভিন্ন জৈব বিক্রিয়ার অনুঘটক, স্কিন্টিলেশন কাউন্টারের কেলাস, এবং ম্যাগনেটোহাইড্রোডাইনামিক শক্তি জেনারেটরে।[৯] সিজিয়াম ধনাত্মকআয়নের একটি উৎস হিসেবে সেকেন্ডারি আয়ন ভর স্পেকট্রোমেট্রি (SIMS)-তেও ব্যবহৃত হয়।
১৯৬৭ সাল থেকে আন্তর্জাতিক পরিমাপ পদ্ধতি (International System of Measurements) সময়ের প্রধান একক, সেকেন্ড, সিজিয়ামের উপর ভিত্তি করে নির্ধারণ করেছে। আন্তর্জাতিক একক পদ্ধতি (SI) সেকেন্ডকে সংজ্ঞায়িত করে এইভাবে: সিজিয়াম-১৩৩ এর নিষ্ক্রিয়-অবস্থার দুটি হাইপারফাইন শক্তি স্তরের মধ্যে পরিবর্তনের সাথে সম্পর্কিত বিকিরণ রেখার মাইক্রোওয়েভ কম্পাঙ্কের ৯,১৯২,৬৩১,৭৭০ পর্যায়ের সময়কাল।[৭০] ১৯৬৭ সালের ওজন ও পরিমাপের ১৩তম সাধারণ সম্মেলনে সেকেন্ডকে এভাবে সংজ্ঞায়িত করা হয়েছিল: "সিজিয়াম-১৩৩ পরমাণুর নিষ্ক্রিয়-অবস্থায় এবং বাইরের ক্ষেত্র দ্বারা অপ্রভাবিত অবস্থায়, হাইপারফাইন ট্রানজিশনের মাধ্যমে শোষিত বা নির্গত মাইক্রোওয়েভ আলোর ৯,১৯২,৬৩১,৭৭০ টি পর্যায়ের সময়কাল।"
Remove ads
ব্যবহার
সিজিয়াম 133 (Cs 133) পরমাণুর 9,192,631,770 টি স্পন্দন সম্পন্ন করতে যে পরিমাণ সময় নেয়, সেটি হচ্ছে এক সেকেন্ড।
নিরাপত্তা ও স্বাস্থ্য ঝুঁকি
আরও দেখুন
টীকা
- বুনসেন, অলাস গিলিয়াসের নক্টেস অ্যাটিকা II, অধ্যায় ২৬-এর নিগিডিয়াস ফিগুলাসের বক্তব্য উদ্ধৃত করেছেন: "কিন্তু আমাদের পূর্বপুরুষরা একে বলতেন সিজিয়া (caesia)। আবার গ্রিক ভাষায়, যেমনটি নিগিডিয়াস বলেছেন, এটি সেলিয়া (coelia) নামে পরিচিত। আকাশের রঙ থেকে এই নামের উৎপত্তি।"
তথ্যসূত্র
বহিঃসংযোগ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


