শীর্ষ প্রশ্ন
সময়রেখা
চ্যাট
প্রসঙ্গ
পর্যায় সারণি
বিভিন্ন মৌলিক পদার্থকে একত্রে উপস্থাপনের একটি আন্তর্জাতিকভাবে গৃহীত ছক উইকিপিডিয়া থেকে, বিনামূল্যে একটি বিশ্বকোষ
Remove ads
পর্যায় সারণি বা মৌলের পর্যায় সারণি হলো মৌলিক পদার্থগুলোর একটি সুশৃঙ্খল বিন্যাস, যা সারি ("পর্যায়") ও স্তম্ভ ("শ্রেণি বা গ্রুপ") আকারে সাজানো হয়। এটি রসায়নের একটি গুরুত্বপূর্ণ প্রতিভূ এবং পদার্থবিজ্ঞানসহ বিজ্ঞানের অন্যান্য শাখায় ব্যাপকভাবে ব্যবহৃত হয়।
এই নিবন্ধ বা অনুচ্ছেদটি পরিবর্ধন বা বড় কোনো পুনর্গঠনের মধ্যে রয়েছে। এটির উন্নয়নের জন্য আপনার যে কোনো প্রকার সহায়তাকে স্বাগত জানানো হচ্ছে। যদি এই নিবন্ধ বা অনুচ্ছেদটি কয়েকদিনের জন্য সম্পাদনা করা না হয়, তাহলে অনুগ্রহপূর্বক এই টেমপ্লেটটি সরিয়ে ফেলুন। ৪৮ দিন আগে 109.107.229.45 (আলাপ | অবদান) এই নিবন্ধটি সর্বশেষ সম্পাদনা করেছেন। (হালনাগাদ) |

এই সারণি দ্বারা পর্যায়বৃত্ত ধর্মের উপস্থাপন করা হয়, যেখানে উপস্থাপন করা হয় যে মৌলগুলোকে যদি তাদের পারমাণবিক সংখ্যার ক্রমে সাজানো হয়, তবে তাদের ধর্মে একটি পুনরাবৃত্ত ধারা পরিলক্ষিত হয়। সারণিটি আনুমানিক চারটি আয়তাকার অঞ্চলে বিভক্ত, যেগুলোকে ব্লক বলা হয়। একই গ্রুপের মৌলগুলোর রাসায়নিক ধর্ম সাধারণত মিল থাকে।
পর্যায় সারণিতে উল্লম্ব, আনুভূমিক ও তির্যকভাবে বিভিন্ন পর্যায়বৃত্তিক ধর্ম দেখা যায়। একটি গ্রুপে নিচের দিকে নামার সাথে সাথে ধাতব ধর্ম বৃদ্ধি পায় এবং একটি পর্যায়ে ডান দিক থেকে বাম দিকে গেলে ধাতব ধর্ম বাড়ে। অপরদিকে, নিচের বাম কোণ থেকে উপর দিকের ডান কোণের দিকে যাওয়ার সাথে সাথে অধাতব ধর্ম বৃদ্ধি পায়।
রুশ রসায়নবিদ দিমিত্রি মেন্দেলিয়েভ ১৮৬৯ সালে প্রথম যে পর্যায় সারণি প্রস্তাব করেন তা সাধারণভাবে গৃহীত হয়। তিনি রাসায়নিক ধর্মকে পারমাণবিক ভরের ওপর নির্ভর করে সাজান এবং তখনো অজানা থাকা মৌলগুলোর কিছু ধর্ম ভবিষ্যদ্বাণী করতে সক্ষম হন। ১৯শ শতকের শেষ দিকে পর্যায় সূত্রকে মৌলিক একটি আবিষ্কার হিসেবে স্বীকৃতি দেওয়া হয়। ২০শ শতকের শুরুতে পারমাণবিক সংখ্যা ও কোয়ান্টাম বলবিজ্ঞান আবিষ্কারের মাধ্যমে এটিকে ব্যাখ্যা করা সম্ভব হয় এবং পারমাণবিক গঠনের ব্যাখ্যা প্রদান করা হয়। ১৯৪৫ সালে গ্লেন থিওডোর সিবর্গ যখন দেখান যে অ্যাক্টিনাইড উপাদানগুলো আসলে f-ব্লকের অন্তর্ভুক্ত, তখন আধুনিক সারণির রূপটি পূর্ণতা পায়।
পর্যায় সারণি ও পর্যায় সূত্র বর্তমানে আধুনিক রসায়নের কেন্দ্রবিন্দু ও অপরিহার্য অংশ হিসেবে প্রতিষ্ঠিত। বিজ্ঞানের অগ্রগতির সঙ্গে সঙ্গে পর্যায় সারণির পরিসরও বৃদ্ধি পাচ্ছে। প্রকৃতিতে পারমাণবিক সংখ্যা ৯৪ পর্যন্ত (ইউরেনিয়াম) মৌলই বিদ্যমান;[ক] এর পরবর্তী মৌলগুলো প্রয়োগাগারে কৃত্রিমভাবে প্রস্তুত করতে হয়েছে। ২০১০ সালের মধ্যে প্রথম ১১৮টি উপাদান আবিষ্কৃত হয়, যার ফলে সারণির প্রথম সাতটি সারি সম্পূর্ণ হয়।[১] তবে সবচেয়ে ভারী উপাদানগুলোর ধর্ম এখনো পুরোপুরি যাচাই করা হয়নি, অর্থাৎ তারা সারণিতে ঠিকঠাক অবস্থানে আছে কিনা তা নিশ্চিত হওয়া দরকার। ভবিষ্যতের আবিষ্কারগুলোর মাধ্যমে সারণির সাত সারির বাইরেও বিস্তার হতে পারে, তবে কতদূর পর্যন্ত সম্ভব, তা এখনো নিশ্চিত নয়। তত্ত্বগতভাবে বলা হচ্ছে, এই অজানা অঞ্চল সারণির বর্তমান ধারা অনুসরণ নাও করতে পারে। এছাড়াও কিছু উপাদানের বর্তমান অবস্থান নিয়েও বিতর্ক রয়েছে এবং বিভিন্ন বিকল্প উপস্থাপনাগুলো নিয়েও আলোচনা চলছে যে কোনটি সবচেয়ে কার্যকর বিন্যাস।
Remove ads
গঠন
সারাংশ
প্রসঙ্গ
|
আদিম ক্ষয় থেকে সিন্থেটিক সীমানা মৌলটির প্রাকৃতিক উপস্থিতি দেখায় |
|
মানক পারমাণবিক ভর Ar, std(E)[২] |

প্রতিটি রাসায়নিক মৌলের একটি নির্দিষ্ট পারমাণবিক সংখ্যা থাকে, যাকে Z দ্বারা প্রকাশ করা হয় (Z এসেছে জার্মান শব্দ 'Zahl' থেকে, যার অর্থ 'সংখ্যা')। এই সংখ্যা পরমাণুর কেন্দ্রে থাকা প্রোটনের সংখ্যাকে বোঝায়।[৪] প্রতিটি আলাদা পারমাণবিক সংখ্যা একটি নির্দিষ্ট ধরনের পরমাণুকে বোঝায়, যাকে রাসায়নিক মৌল বলা হয়।[৫] এই মৌলগুলোই পর্যায় সারণিতে সাজানো থাকে। উদাহরণস্বরূপ, হাইড্রোজেন মৌলের পারমাণবিক সংখ্যা ১, হিলিয়ামের ২, লিথিয়ামের ৩ — এভাবে সংখ্যা ক্রমান্বয়ে বাড়তে থাকে। প্রতিটি মৌলের একটি বা দুটি অক্ষরের সমন্বয়ে লিখিত রাসায়নিক প্রতীক আছে। যেমন: হাইড্রোজেনের প্রতীক H, হিলিয়ামের He আর লিথিয়ামের Li।[৬] নিউট্রন পরমাণুর ভরকে প্রভাবিত করলেও তার রাসায়নিক পরিচয়ে কোনো পরিবর্তন আনে না। যেসব পরমাণুর প্রোটনের সংখ্যা এক হলেও নিউট্রনের সংখ্যা ভিন্ন, সেগুলোকে বলা হয় পরস্পরের সমস্থানিক বা আইসোটোপ।[৬] প্রাকৃতিকভাবে পাওয়া যায় এমন প্রায় সব মৌলই একাধিক আইসোটোপের মিশ্রণ হিসেবে থাকে। প্রতিটি আইসোটোপ সাধারণত নির্দিষ্ট পরিমাণে বিদ্যমান থাকে। সেই অনুপাতে গড় করে যে পারমাণবিক ভর পাওয়া যায়, সেটিই সাধারণত ব্যবহার করা হয়।[৭] সব মৌলেরই একাধিক আইসোটোপ থাকে। প্রতিটির প্রোটন সংখ্যা একই হলেও নিউট্রনের সংখ্যা ভিন্ন হতে পারে। যেমন কার্বন-এর কথা ধরা যাক — এর প্রতিটি পরমাণুতে ছয়টি প্রোটন থাকে। বেশিরভাগ পরমাণুতে ছয়টি নিউট্রনও থাকে, তবে প্রায় এক শতাংশে সাতটি নিউট্রন এবং খুব সামান্য সংখ্যায় আটটি নিউট্রন থাকে। আইসোটোপগুলো পর্যায় সারণিতে আলাদা করে দেখানো হয় না, বরং একসঙ্গেই রাখা হয়। সাধারণত, কোনো মৌলের পারমাণবিক ভর বলতে বোঝায় তার আইসোটোপগুলোর গড় ভর। তবে যদি কোনো মৌলের আইসোটোপগুলো প্রকৃতিতে উল্লেখযোগ্য পরিমাণে না পাওয়া যায়, তাহলে সবচেয়ে স্থিতিশীল আইসোটোপের ভরই বন্ধনীর ("()") মধ্যে দেখানো হয়।[৮]
পর্যায় সারণিতে মৌলগুলো তাদের পারমাণবিক সংখ্যা অনুযায়ী সাজানো থাকে। প্রতিটি মৌলে ইলেকট্রন নির্দিষ্টভাবে শেল বা খোলের মধ্যে বিন্যস্ত থাকে। যখন ইলেকট্রনগুলো আগের সব শেল পূর্ণ করে নতুন একটি শেলে প্রবেশ করে, তখন সেখান থেকেই একটি নতুন সারি (পর্যায়) শুরু হয়। গ্রুপ বা কলাম নির্ধারণ করা হয় ইলেকট্রনের বিন্যাসের ভিত্তিতে। যেসব মৌলের বাইরের স্তরের নির্দিষ্ট অংশে (যেমন s, p, d, বা f উপশেল) একই সংখ্যক ইলেকট্রন থাকে, তাদের একসঙ্গে একই গ্রুপে রাখা হয়। যেমন অক্সিজেন, সালফার এবং সেলেনিয়াম—এই তিনটি মৌলের বাইরের p-উপশেলে চারটি করে ইলেকট্রন থাকে, তাই তারা একই গ্রুপে পড়ে। একই গ্রুপের মৌলগুলোর রাসায়নিক বৈশিষ্ট্য সাধারণত একইরকম হয়। তবে f-ব্লক এবং কিছুটা d-ব্লকের ক্ষেত্রেও একই সারির (পর্যায়ের) মৌলগুলোর মধ্যেও মিল দেখা যায়। তাই আশেপাশের মৌলগুলোর বৈশিষ্ট্য জানলে, একটি মৌলের বৈশিষ্ট্য বোঝা সহজ হয়।[৯]
বর্তমানে মোট ১১৮টি মৌল আবিষ্কৃত হয়েছে, যার মধ্যে প্রথম ৯৪টি পৃথিবীতে প্রাকৃতিকভাবে পাওয়া যায়।[১০][খ] মৌল ৯৫ (আমেরিসিয়াম) থেকে ১১৮ (ওগানেসন) পর্যন্ত মোট ২৪টি মৌল শুধুমাত্র পরীক্ষাগারে সংশ্লেষণের মাধ্যমে কৃত্রিমভাবে তৈরি করা হয়েছে। ৯৪টি প্রাকৃতিক মৌলের মধ্যে ৮৩টি আদি মৌল হিসেবে বিদ্যমান, অর্থাৎ তারা পৃথিবী গঠনের পর থেকেই টিকে আছে। বাকি ১১টি মৌল বিকিরণ ক্ষয়ের মাধ্যমে আদি মৌল থেকে তৈরি হয়। এই ১১টির মধ্যে কয়েকটি এতটাই বিরল যে প্রথমে সেগুলো কেবল পরীক্ষাগারে তৈরি করা হয়েছিল, পরে তাদের প্রকৃতিতেও উপস্থিতি পাওয়া যায়: টেকনেশিয়াম (৪৩), প্রমিথিয়াম (৬১), অ্যাস্টাটিন (৮৫), নেপচুনিয়াম (৯৩) এবং প্লুটোনিয়াম (৯৪)।[১২] আইনস্টাইনিয়াম (৯৯) এর পরবর্তী কোনো মৌল বিশুদ্ধ অবস্থায় দৃশ্যমান পরিমাণে কখনো পাওয়া যায়নি। অ্যাস্টাটিন-এরও এমন উপস্থিতি দেখা যায়নি। ফ্রান্সিয়াম (৮৭)-এর অস্তিত্ব শনাক্ত করা গেছে শুধুমাত্র এর তেজস্ক্রিয় বিক্রিয়ায় নির্গত আলো পর্যবেক্ষণের মাধ্যমে। তখন এর পরিমাণ ছিল মাত্র প্রায় ৩ লাখ পরমাণু—যা এতটাই অল্প যে তা খালি চোখে দেখা যায় না।[১৪] এই ৯৪টি প্রাকৃতিক মৌলের মধ্যে ৮০টির একটি করে স্থিতিশীল সমস্থানিক (আইসোটোপ) আছে। আরও একটি মৌল বিসমাথ-এর এমন একটি সমস্থানিক রয়েছে, যা এত দীর্ঘস্থায়ী যে বিজ্ঞানীরা একে "প্রায় স্থিতিশীল" মনে করেন। এর অর্ধায়ু ২.০১×১০¹⁹ বছর—অর্থাৎ এটি ক্ষয় হতে যে সময় লাগে, তা মহাবিশ্বের বয়সেরও এক বিলিয়ন গুণ বেশি।[১৫][গ] আরও দুটি মৌল—থোরিয়াম ও ইউরেনিয়াম—এর সমস্থানিক রয়েছে, যেগুলোর অর্ধায়ু পৃথিবীর বয়সের সঙ্গে তুলনীয়। এই দুইটি, বিসমাথ এবং ৮০টি স্থিতিশীল মৌল মিলিয়ে মোট ৮৩টি আদি মৌল আছে, যেগুলো পৃথিবী গঠনের সময় থেকেই রয়েছে।[ঘ] বাকি ১১টি প্রাকৃতিক মৌল এত দ্রুত ক্ষয়প্রাপ্ত হয় যে, এগুলো পৃথিবীতে খুব সামান্য পরিমাণে পাওয়া যায়—মূলত থোরিয়াম ও ইউরেনিয়াম ক্ষয়ের মধ্যবর্তী ধাপে এগুলোর পুনঃউৎপত্তি ঘটে বলেই এদের অস্তিত্ব বজায় থাকে।[ঙ] বর্তমানে আবিষ্কৃত সব কৃত্রিম মৌলই তেজস্ক্রিয়।[৬]
গ্রুপের নাম ও সংখ্যা
আন্তর্জাতিকভাবে গৃহীত একটি নামকরণ পদ্ধতি অনুযায়ী, পর্যায় সারণির গ্রুপগুলোকে বাম দিকের প্রথম কলাম (ক্ষার ধাতু) থেকে ডান দিকের শেষ কলাম (নিষ্ক্রিয় গ্যাস) পর্যন্ত ১ থেকে ১৮ পর্যন্ত সংখ্যা দিয়ে চিহ্নিত করা হয়। এই গণনায় f-ব্লকের গ্রুপগুলো অন্তর্ভুক্ত নয়।[২২] প্রতিটি গ্রুপকে তার প্রথম মৌলটির নামেও ডাকা যায়। যেমন, তৃতীয় গ্রুপকে "স্ক্যান্ডিয়াম গ্রুপ" বলা হয়।[২২] আগে গ্রুপগুলোকে রোমান সংখ্যায় প্রকাশ করা হতো। যুক্তরাষ্ট্রে রোমান সংখ্যার সঙ্গে "A" বা "B" যোগ করা হতো। s-ব্লক বা p-ব্লকের গ্রুপগুলোতে "A" এবং d-ব্লকের গ্রুপগুলোতে "B" বসানো হতো। এই রোমান সংখ্যাগুলো আধুনিক নামকরণের সংখ্যার সঙ্গে সম্পর্কিত ছিল। যেমন, এখন যাকে গ্রুপ ৪ বলা হয়, আগে তাকে বলা হতো IVB; আর এখনকার গ্রুপ ১৪ আগে পরিচিত ছিল IVA নামে। ইউরোপে এই পদ্ধতি কিছুটা ভিন্ন ছিল। সেখানে গ্রুপ ১ থেকে ৭ পর্যন্ত "A" এবং গ্রুপ ১১ থেকে ১৭ পর্যন্ত "B" ব্যবহৃত হতো। গ্রুপ ৮, ৯ ও ১০-কে একত্রে একটি বৃহৎ গ্রুপ হিসেবে বিবেচনা করা হতো এবং একে "গ্রুপ VIII" বলা হতো। ১৯৮৮ সালে আন্তর্জাতিক বিশুদ্ধ ও ফলিত রসায়ন সংস্থা (IUPAC) গ্রুপগুলোর জন্য ১ থেকে ১৮ পর্যন্ত সংখ্যায় নির্ধারিত একটি নতুন নামকরণ পদ্ধতি চালু করে। একই সঙ্গে রোমান সংখ্যা ব্যবহার করে যে পুরোনো নামকরণ পদ্ধতি চালু ছিল, সেগুলোও তখন বাতিল করা হয়।[২৩]
a গ্রুপ ১-এ হাইড্রোজেন (H) এবং ক্ষার ধাতুগুলি অন্তর্ভুক্ত। এই গ্রুপের মৌলগুলির বাইরের ইলেকট্রন স্তরে একটি করে s-ইলেকট্রন থাকে। যদিও হাইড্রোজেন ধাতু নয়, এটি ক্ষার ধাতুর সঙ্গে অন্যান্য গ্রুপের তুলনায় বেশি মিল রাখে। এই কারণে গ্রুপটি কিছুটা ব্যতিক্রমী।
b f-ব্লক-এর ১৪টি কলামের (গ্রুপের) নির্দিষ্ট কোনো গ্রুপ নম্বর নেই।
c গ্রুপ ৩-এর সঠিক গঠন হলো স্ক্যান্ডিয়াম (Sc), ইট্রিয়াম (Y), লুটেটিয়াম (Lu), এবং লরেন্সিয়াম (Lr)। এই বিন্যাস ১৯৮৮[২৩] এবং ২০২১[২৪] সালের IUPAC-এর প্রতিবেদনে অনুমোদিত। তবে অনেক সাধারণ অজৈব রসায়নের পাঠ্যে গ্রুপ ৩ হিসেবে স্ক্যান্ডিয়াম (Sc), ইট্রিয়াম (Y), ল্যান্থানাম (La), এবং অ্যাক্টিনিয়াম (Ac)-কে দেখানো হয়, যাতে Ce–Lu এবং Th–Lr উপাদানসমূহকে গ্রুপ ৩ ও ৪-এর মধ্যবর্তী f-ব্লক হিসেবে রাখা যায়। তবে এই বিন্যাস পুরনো, ভুলভাবে পরিমাপ করা ইলেকট্রন কনফিগারেশনের উপর ভিত্তি করে তৈরি হয়েছিল।[২৫] লেভ ল্যান্ডাউ এবং ইভগেনি লিফশিট্জ ১৯৪৮ সালেই এই বিন্যাসকে ভুল বলে চিহ্নিত করেছিলেন।[২৬] যদিও সমসাময়িক গবেষণাতেও এই পুরনো বিন্যাসকে সমর্থনের কিছু প্রচেষ্টা দেখা যায়, অধিকাংশ বিজ্ঞানী তা যুক্তিহীন বলে মনে করেন।[২৭][২৮][২৯] কিছু উৎস একটি আপসের প্রস্তাব দেয়, যেখানে La–Lu এবং Ac–Lr কে f-ব্লকের সারি হিসেবে ধরা হয়। যদিও এতে প্রতিটি সারিতে ১৫টি করে f-ব্লকের উপাদান থাকে, যা কোয়ান্টাম মেকানিক্সের সঙ্গে সাংঘর্ষিক। ফলে গ্রুপ ৩-এর ভারী সদস্যদের বিষয়টি অস্পষ্ট থাকে।[২৪] বিস্তারিত জানার জন্য দেখুন Group 3 element#Composition।
d গ্রুপ ১৮, অর্থাৎ নিষ্ক্রিয় গ্যাসগুলি, মেন্ডেলিফের মূল পর্যায় সারণিতে আবিষ্কৃত ছিল না। পরবর্তীকালে (১৯০২ সালে) মেন্ডেলিফ তাদের অস্তিত্ব মেনে নেন এবং এই গ্যাসগুলোকে একটি নতুন "গ্রুপ ০"-তে যুক্ত করা যায়, যা পর্যায় সারণির মূল নীতিকে বজায় রাখে।
উপস্থাপনের ধরনসমূহ
জায়গার সীমাবদ্ধতার কারণে,[৩০][৩১] পর্যায়সারণী প্রায়শই এমনভাবে দেখানো হয়, যেখানে f-ব্লকের মৌলগুলো মূল কাঠামো থেকে সরিয়ে নিচে আলাদা করে রাখা হয়।[২৩][৩০][৩২] এতে মৌলগুলোর সারির সংখ্যা ৩২ থেকে কমে ১৮ হয়ে যায়।[৩০]
তবে এই দুটি ধরনই একই মৌলসমূহ ও বিন্যাস উপস্থাপন করে।[৬] যেখানে f-ব্লক মূল সারণীর মধ্যেই থাকে, সেটিকে ৩২-কলামের[৬] বা দীর্ঘ রূপ[৩৩] বলা হয়। আর যেখানে f-ব্লক নিচে আলাদা করে দেখানো হয়, সেটিকে ১৮-কলামের[৬] বা মধ্য-দীর্ঘ রূপ[৩৩] বলা হয়। ৩২-কলামের রূপে সব মৌল তাদের প্রকৃত ক্রমে দেখা যায়, যা একটি বড় সুবিধা। তবে এটি উপস্থাপনের জন্য বেশি জায়গা প্রয়োজন হয়।[৩৪] ১৮-কলামের বা ৩২-কলামের কোন ধরণের পর্যায়সারণী ব্যবহৃত হবে, সেটা বৈজ্ঞানিকভাবে বাধ্যতামূলক নয়। বরং এটি নির্ভর করে লেখক বা প্রকাশকের পছন্দের ওপর—তারা কোন রূপে তথ্য উপস্থাপন করতে চান, সেটিই এখানে গুরুত্বপূর্ণ। এই পছন্দ শুধুই দৃশ্য উপস্থাপনার জন্য, এর ফলে মৌলিক বৈজ্ঞানিক তথ্যের কোনো পরিবর্তন হয় না। যেমন, গ্রুপ ৩-এ কোন মৌল থাকবে তা ১৮-কলাম হোক বা ৩২-কলাম—দুইভাবেই বৈজ্ঞানিকভাবে সঠিক ও নিরপেক্ষভাবে ব্যাখ্যা করা যায়।[৩৫]
পর্যায়সারণীতে সাধারণত মৌলগুলোর প্রতীক অন্তত দেখানো হয়। অনেক সারণীতে এ ছাড়াও অতিরিক্ত তথ্য থাকে—যেমন, রঙ দিয়ে বিভিন্ন শ্রেণির মৌল আলাদা করে দেখানো হয়, অথবা প্রতিটি ঘরে মৌলটির সম্পর্কে কিছু সংক্ষিপ্ত তথ্য যেমন নাম, ভর বা অবস্থা উল্লেখ থাকে। উপরের সারণীতে মৌলগুলোর নাম, পারমাণবিক সংখ্যা, তারা কোন ব্লকে পড়ে, প্রাকৃতিকভাবে কোথায় পাওয়া যায় এবং তাদের মানক পারমাণবিক ভর দেখানো হয়েছে। যেসব মৌল খুব অল্প সময়ের জন্য স্থায়ী থাকে এবং যাদের মানক ভর নির্ধারিত নয়, তাদের ক্ষেত্রে সবচেয়ে স্থিতিশীল আইসোটোপের ভরসংখ্যা দেখানো হয়। অন্যান্য সারণীতে মৌলগুলোর অবস্থা (গ্যাস, তরল বা কঠিন), গলন ও স্ফুটন বিন্দু, ঘনত্বের মতো বৈশিষ্ট্য এবং বিভিন্ন ধরনের শ্রেণিবিন্যাসও থাকতে পারে।[চ]
ইলেকট্রন বিন্যাস
পর্যায় সারণি হলো পর্যায়বৃত্ত সূত্রের একটি চিত্রভিত্তিক উপস্থাপন।[৩৬] এই সূত্র অনুযায়ী, মৌলের পারমাণবিক সংখ্যা যেভাবে বাড়ে, সেভাবেই তাদের পারমাণবিক গঠন ও রাসায়নিক ধর্মেও ধারাবাহিক ও পূর্বানুমানযোগ্য পরিবর্তন দেখা যায়।[৩৭] মৌলগুলোকে তাদের ইলেকট্রন বিন্যাস অনুযায়ী পর্যায় সারণিতে সাজানো হয়।[৩৮] কারণ, এই বিন্যাসে নির্দিষ্ট একটি ধারা বারবার ফিরে আসে এবং সেই পুনরাবৃত্তির ফলেই মৌলগুলোর রাসায়নিক ধর্মেও ধারাবাহিক পরিবর্তন দেখা যায়।[৩৯]
একটি ইলেকট্রন সাধারণত একটি নির্দিষ্ট অরবিটালে অবস্থান করে, যা ইলেকট্রনটি পরমাণুর চারপাশে কোথায় থাকার সম্ভাবনা বেশি, তা নির্দেশ করে। ইলেকট্রনের শক্তি ক্রমাগত পরিবর্তন হতে পারে না; এটি নির্দিষ্ট নির্দিষ্ট মানে ভাগ করা থাকে, যাকে কোয়ান্টাইজড বলা হয়। এছাড়া, পাউলির অপবর্জন নীতি অনুযায়ী, দুটি ইলেকট্রন একসঙ্গে ঠিক একই অবস্থায় থাকতে পারে না। তাই পরমাণুর মধ্যে ইলেকট্রনগুলোকে বিভিন্ন শক্তিস্তরে ভাগ করে রাখা হয়, যেগুলোকে শেল বলা হয়। প্রতিটি শেল আরও ছোট অংশে ভাগ করা হয়, যেগুলোকে উপ-শেল বলা হয়। প্রতিটি উপ-শেলে এক বা একাধিক অরবিটাল থাকতে পারে। প্রতিটি অরবিটালে সর্বাধিক দুইটি ইলেকট্রন থাকতে পারে। এই দুইটি ইলেকট্রনকে আলাদা করতে ‘স্পিন’ নামে একটি বৈশিষ্ট্য ব্যবহার করা হয়, যা সাধারণভাবে "আপ" বা "ডাউন" স্পিন হিসেবে পরিচিত।[৪০][ছ] যখন একটি পরমাণু স্বাভাবিক বা স্থির অবস্থায় থাকে (যেটিকে গ্রাউন্ড স্টেট বলা হয়), তখন ইলেকট্রনগুলো এমন অরবিটাল বেছে নেয় যেগুলোর শক্তি সবচেয়ে কম। কারণ, ইলেকট্রন সবসময় এমনভাবে বিন্যস্ত হয় যাতে তাদের মোট শক্তি যতটা সম্ভব কম থাকে। ফলে, কম শক্তির অরবিটালগুলো আগে পূর্ণ হয়, তারপর ধাপে ধাপে বেশি শক্তির অরবিটালগুলোতে ইলেকট্রন যোগ হয়।[৪২] পরমাণুর সবচেয়ে বাইরের স্তরে যে ইলেকট্রনগুলো থাকে, তাদেরকে যোজ্যতা ইলেকট্রন বলা হয়। এই ইলেকট্রনগুলোর পারমাণবিক কেন্দ্রের (নিউক্লিয়াস) আকর্ষণ থেকে মুক্ত হওয়ার সম্ভাবনা বেশি থাকে, কারণ তারা কেন্দ্র থেকে সবচেয়ে দূরে অবস্থান করে এবং শক্তিও তুলনামূলকভাবে বেশি থাকে। ফলে, রাসায়নিক বিক্রিয়ায় অংশ নেওয়ার সময় এই ইলেকট্রনগুলোই মূল ভূমিকা রাখে। অন্যদিকে, যেসব ইলেকট্রন পরমাণুর ভেতরের দিকের শক্তিস্তরগুলোতে থাকে, তাদের কোর ইলেকট্রন বলা হয়। এরা কেন্দ্রের খুব কাছাকাছি থাকে এবং শক্তি তুলনামূলকভাবে কম হয়। এজন্য তারা সাধারণত রাসায়নিক বিক্রিয়ায় অংশ নেয় না।[৪৩]
এখন পর্যন্ত আবিষ্কৃত সব মৌলের ইলেকট্রন কেবল প্রথম সাতটি শক্তিস্তরের মধ্যেই সীমাবদ্ধ থাকে। প্রথম শক্তিস্তরে মাত্র একটি অরবিটাল থাকে, যার আকৃতি গোলাকার এবং একে s অরবিটাল বলা হয়। এটি যেহেতু প্রথম শক্তিস্তরে রয়েছে, তাই একে 1s অরবিটাল বলা হয়। এই অরবিটালে সর্বোচ্চ দুইটি ইলেকট্রন থাকতে পারে। দ্বিতীয় শক্তিস্তরে একটি 2s অরবিটাল এবং তিনটি 2p অরবিটাল থাকে। 2s অরবিটালটি গোলাকার, আর 2p অরবিটালগুলো ডাম্বেল আকৃতির। প্রতিটি অরবিটালে সর্বোচ্চ দুটি করে ইলেকট্রন থাকতে পারে। তাই এই স্তরে মোট ৮টি ইলেকট্রন ধারণ করা যায় (২×১ + ২×৩ = ৮)। তৃতীয় শক্তিস্তরে থাকে একটি 3s অরবিটাল, তিনটি 3p অরবিটাল এবং পাঁচটি 3d অরবিটাল। প্রতিটি অরবিটালে সর্বোচ্চ দুটি করে ইলেকট্রন থাকতে পারে। ফলে এই স্তর মোট ১৮টি ইলেকট্রন ধারণ করতে পারে (২×১ + ২×৩ + ২×৫ = ১৮)। চতুর্থ শক্তিস্তরে অরবিটালের সংখ্যা আরও বেশি হয়—একটি 4s, তিনটি 4p, পাঁচটি 4d এবং সাতটি 4f অরবিটাল। প্রতিটি অরবিটালে সর্বাধিক দুটি ইলেকট্রন থাকতে পারে বলে এই স্তরে মোট ৩২টি ইলেকট্রন সংবেশ করতে পারে (২×১ + ২×৩ + ২×৫ + ২×৭ = ৩২)।[৪৫] পঞ্চম ও তার পরের শক্তিস্তরগুলোতেও একই নিয়মে আরও নতুন ধরনের অরবিটাল যুক্ত হয়। তবে এখন পর্যন্ত যত মৌল আবিষ্কৃত হয়েছে, তাদের প্রাকৃতিক বা স্থিতিশীল অবস্থায় (ground state) এই উচ্চতর অরবিটালগুলোতে ইলেকট্রন থাকে না।[৪৬] অরবিটালগুলোর গঠন ও বৈশিষ্ট্য নির্ধারণে চারটি কোয়ান্টাম সংখ্যা ব্যবহৃত হয়। এগুলো হলো: প্রধান কোয়ান্টাম সংখ্যা n, সহকারী কোয়ান্টাম সংখ্যা ℓ (যা অরবিটালের ধরন বা রূপ নির্ধারণ করে), চুম্বকীয় কোয়ান্টাম সংখ্যা mℓ এবং স্পিন কোয়ান্টাম সংখ্যা ms। এই চারটি সংখ্যা একসঙ্গে মিলে কোনো একটি অরবিটালের সম্পূর্ণ পরিচয় তুলে ধরে।[৪৭]
উপশেল পূরণের ক্রম

সাধারণভাবে, পরমাণুর উপশেলগুলো যেভাবে ইলেকট্রন দ্বারা পূর্ণ হয়, তা নির্ধারিত হয় আউফবাউ নীতি দ্বারা। এই নীতিটি এরউইন ম্যাডেলুং ও ভসেভলোদ ক্লেচকভস্কি-এর নামানুসারে ম্যাডেলুং বা ক্লেচকভস্কি নিয়ম নামেও পরিচিত। প্রথমে ম্যাডেলুং এই নিয়মটি পরীক্ষামূলকভাবে আবিষ্কার করেন, পরবর্তীতে ক্লেচকভস্কি ও অন্য গবেষকেরা এটির বৈজ্ঞানিক ব্যাখ্যা তুলে ধরেন।[৪৮][৪৯][৫০][৫১][জ] বিভিন্ন শেলের শক্তি কাছাকাছি হওয়ায় তারা আংশিকভাবে একে অপরের সঙ্গে মিশে যায়। তাই ম্যাডেলুং নিয়ম অনুসারে ইলেকট্রন শক্তির ক্রম অনুযায়ী নিচের অরবিটালগুলোতে প্রবেশ করে:[৪৯]
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪ ...
এখানে ≪ চিহ্নটি নির্দেশ করে যে এক অরবিটালের শক্তি অন্যটির তুলনায় অনেক কম, আর < চিহ্নটি বোঝায় শক্তির পার্থক্য তুলনামূলকভাবে কম।[৪৯] সহজভাবে বললে, ইলেকট্রন প্রথমে সেই অরবিটালে প্রবেশ করে, যার n + ℓ মান সবচেয়ে কম। যদি একাধিক অরবিটালের n + ℓ মান সমান হয়, তবে যেটির n মান কম, ইলেকট্রন আগে সেটিকেই পূর্ণ করে।[৪৬][৫১] সাধারণভাবে, যেসব অরবিটালের n + ℓ মান একই, তাদের শক্তিও প্রায় একই রকম হয়। তবে s অরবিটালের ক্ষেত্রে ℓ = 0 হওয়ায় কিছু কোয়ান্টাম প্রভাবের কারণে এর শক্তি তুলনামূলকভাবে বেশি হয়। ফলে এটি প্রায়ই পরবর্তী গ্রুপের অরবিটালগুলোর শক্তির কাছাকাছি চলে যায়। এই কারণে পর্যায়সারির প্রতিটি নতুন সারি একটি নতুন s অরবিটাল পূরণ দিয়ে শুরু হয়, যা নতুন শেলের সূচনা নির্দেশ করে।[৩০][৪৯][৫০] এই কারণে, প্রথম সারিটি ব্যতিক্রম হলেও তার পর থেকে প্রতিটি পর্যায় সাধারণত দুইটি করে সমদৈর্ঘ্যের সারি নিয়ে গঠিত হয়:[৪৯]
- 2, 8, 8, 18, 18, 32, 32, ...
যখন d অরবিটালগুলোর পূরণ শুরু হয়, তখন সংশ্লিষ্ট অরবিটালগুলোর শক্তি স্তর একে অপরের খুব কাছাকাছি থাকে।[৫২] ফলে এই অবস্থায় ইলেকট্রনের পূরণের সুনির্দিষ্ট ক্রম সবসময় একরকম থাকে না; এটি অনেক সময় পরমাণুর পারমাণবিক সংখ্যা[৫৩] এবং আধান অনুযায়ী সামান্য পরিবর্তিত হতে পারে।[৫৪][ঝ]
সবচেয়ে সহজ পরমাণু হাইড্রোজেন থেকে শুরু করে, আমরা পারমাণবিক সংখ্যার ক্রমানুসারে একে একে প্রতিটি মৌল বিবেচনা করে পুরো পর্যায় সারণি গঠন করতে পারি। হাইড্রোজেন পরমাণুর মাত্র একটি ইলেকট্রন থাকে, যা সবচেয়ে কম শক্তির অরবিটাল 1s-এ অবস্থান করে। এই অবস্থানকে লেখা হয় 1s1—এখানে ঊর্ধ্বলিখিত সংখ্যা '¹' বোঝায়, ওই অরবিটালে একটি ইলেকট্রন রয়েছে। হিলিয়ামে একটি অতিরিক্ত ইলেকট্রন যুক্ত হয়, সেটিও 1s অরবিটালেই যায়। ফলে এই অরবিটালটি পূর্ণ হয়ে যায় এবং প্রথম শক্তিস্তর সম্পূর্ণ হয়। হিলিয়ামের ইলেকট্রন বিন্যাস (configuration) হয় 1s2।[৪৭][৫৮][ঞ]
তৃতীয় মৌল লিথিয়ামের ক্ষেত্রে প্রথম শক্তিস্তরটি (1s) আগে থেকেই পূর্ণ থাকে। তাই এর তৃতীয় ইলেকট্রনটি চলে যায় দ্বিতীয় শক্তিস্তরের 2s অরবিটালে। এ কারণে লিথিয়ামের ইলেকট্রন বিন্যাস হয় 1s2 2s1। এখানে 2s ইলেকট্রনটি লিথিয়ামের একমাত্র যোজ্যতা ইলেকট্রন, যেটি রাসায়নিক বিক্রিয়ায় অংশ নিতে পারে। অন্যদিকে, 1s স্তরটি নিউক্লিয়াসের খুব কাছাকাছি এবং এত শক্তভাবে বাঁধা থাকে যে, এটি আর কোনো রাসায়নিক বিক্রিয়ায় যুক্ত হয় না। এমন শক্তভাবে বাঁধা অভ্যন্তরীণ স্তরকে বলা হয় "কোর শেল"। লিথিয়াম থেকে শুরু করে এর পরের সব মৌলের ক্ষেত্রেই 1s স্তরটি কোর শেল হিসেবে থাকে। চতুর্থ মৌল বেরিলিয়ামের ক্ষেত্রে, একটি নতুন ইলেকট্রন 2s অরবিটালে যুক্ত হয় এবং এইভাবে 2s স্তরটি সম্পূর্ণভাবে পূর্ণ হয়। এর ইলেকট্রন বিন্যাস হয় 1s2 2s2। এরপরের মৌলগুলোতে ইলেকট্রন যুক্ত হতে শুরু করে দ্বিতীয় শক্তিস্তরের পরবর্তী স্তর 2p-তে। বোরনের ক্ষেত্রে (1s2 2s2 2p1) নতুন ইলেকট্রনটি দ্বিতীয় শক্তিস্তরের 2p অরবিটালে প্রবেশ করে। কার্বনের ক্ষেত্রে (1s2 2s2 2p2) দ্বিতীয় ইলেকট্রনটি 2p উপস্তরের আরেকটি খালি অরবিটালে প্রবেশ করে। ফলে এখন দুটি 2p অরবিটালে একটি করে ইলেকট্রন থাকে। নাইট্রোজেনের ক্ষেত্রে (1s2 2s2 2p3) তিনটি 2p অরবিটালেই একটি করে ইলেকট্রন অবস্থান করে। এটি হুন্ডের নিয়ম অনুসারে ঘটে। এই নিয়ম অনুসারে, সমশক্তির একাধিক অরবিটাল থাকলে, প্রতিটিতে প্রথমে একটিমাত্র ইলেকট্রন প্রবেশ করে। সবগুলো অরবিটাল একবার করে পূরণ না হওয়া পর্যন্ত, কোনো অরবিটালে দ্বিতীয় ইলেকট্রন দেওয়া হয় না। এরপর অক্সিজেন, ফ্লোরিন এবং নিয়নে পর্যায়ক্রমে অতিরিক্ত ইলেকট্রনগুলো 2p অরবিটালে প্রবেশ করে। অক্সিজেনের ইলেকট্রন বিন্যাস হয় 1s2 2s2 2p4, ফ্লোরিনের 1s2 2s2 2p5 এবং নিয়নের 1s2 2s2 2p6। নিয়নে এসে 2p উপস্তরটি পূর্ণ হয়, ফলে দ্বিতীয় শক্তিস্তর পুরোপুরি সম্পূর্ণ হয়।[৪৭][৬০]
১১ নম্বর মৌল সোডিয়াম থেকে শুরু করে দ্বিতীয় শেল সম্পূর্ণ পূর্ণ হয়ে যায়। তাই সোডিয়াম এবং তার পরবর্তী সব মৌলের জন্য এই স্তরটি অভ্যন্তরীণ বা কোর শেল হিসেবে বিবেচিত হয়। সোডিয়ামের একাদশ ইলেকট্রন তৃতীয় শেলের 3s অরবিটালে প্রবেশ করে। ফলে সোডিয়ামের ইলেকট্রন বিন্যাস দাঁড়ায় 1s2 2s2 2p6 3s1। এই বিন্যাস সংক্ষেপে [Ne] 3s1 হিসেবে লেখা হয়, যেখানে [Ne] প্রতীকটি নিয়নের পূর্ণ ইলেকট্রন বিন্যাসকে নির্দেশ করে। পরবর্তী মৌল ম্যাগনেসিয়ামের ইলেকট্রন বিন্যাস [Ne] 3s2, অর্থাৎ এটি 3s অরবিটাল সম্পূর্ণভাবে পূর্ণ করে। এর পরবর্তী ছয়টি মৌল—অ্যালুমিনিয়াম, সিলিকন, ফসফরাস, সালফার, ক্লোরিন ও আর্গন—পর্যায়ক্রমে 3p অরবিটালে ইলেকট্রন যুক্ত করে। এই মৌলগুলোর ইলেকট্রন বিন্যাস শুরু হয় [Ne] 3s2 3p1 দিয়ে এবং পর্যায়ক্রমে বৃদ্ধি পেয়ে [Ne] 3s2 3p6 পর্যন্ত সম্পূর্ণ হয়।[৪৭][৬১] ফলে সোডিয়াম থেকে আর্গন পর্যন্ত মৌলগুলোর বহিঃশেলের গঠন লিথিয়াম থেকে নিয়ন পর্যন্ত মৌলগুলোর সঙ্গে সাদৃশ্যপূর্ণ হয়। এই সাদৃশ্যের কারণেই নির্দিষ্ট ব্যবধানে মৌলগুলোর রাসায়নিক বৈশিষ্ট্যে একটি পুনরাবৃত্ত ধারা লক্ষ্য করা যায়।[৪৭] এভাবেই মৌলগুলোর বৈশিষ্ট্য পর্যায়ক্রমে ফিরে আসে, যা পর্যায়সারণির মূল ভিত্তি হিসেবে বিবেচিত হয়।[৬২]
প্রথম ১৮টি মৌল নিয়ে পর্যায় সারণির শুরুর অংশ গঠিত হয়। একেকটি কলামে যেসব মৌল থাকে, তাদের ভ্যালেন্স ইলেকট্রনের সংখ্যা একই হয় এবং ইলেকট্রন বিন্যাসেও মিল থাকে। এই কলামগুলোকে "গ্রুপ" বলা হয়। হিলিয়াম একটি গুরুত্বপূর্ণ ব্যতিক্রম হিসেবে বিবেচিত হয়। এর পরমাণুতে মাত্র দুটি ইলেকট্রন থাকে এবং এ দুটিই যোজ্যতা স্তরে অবস্থান করে। এই বৈশিষ্ট্যের কারণে এর ভ্যালেন্স ইলেকট্রনের সংখ্যা বেরিলিয়াম ও ম্যাগনেশিয়ামের মতো—যাদের ভ্যালেন্স শেলে একইভাবে দুটি ইলেকট্রন থাকে। এই মিল থাকার পরও, হিলিয়ামকে সাধারণত নিয়ন ও আর্গনের সঙ্গে একই কলামে (গ্রুপ ১৮) রাখা হয়। এর মূল কারণ হলো—হিলিয়ামের বাইরের শেল সম্পূর্ণ পূর্ণ, যা একে একটি স্থিতিশীল নিষ্ক্রিয় গ্যাস হিসেবে চিহ্নিত করে।(এই দৃষ্টিকোণ থেকে হিলিয়ামের অবস্থান গ্রুপ ১৮-তে যথার্থ মনে হলেও, অনেক আধুনিক গবেষক এ নিয়ে ভিন্ন মত পোষণ করেন। তাদের মতে, পর্যায় সারণিতে মৌলগুলোর স্থান নির্ধারণে ইলেকট্রন বিন্যাস সবচেয়ে গুরুত্বপূর্ণ বিবেচ্য হওয়া উচিত। সে অনুসারে, হিলিয়ামের যোজ্যতা স্তরে দুটি ইলেকট্রন থাকায় তাকে বরং গ্রুপ ২-এ, অর্থাৎ বেরিলিয়ামের ওপরে রাখা উচিত। এই পন্থায় মৌলগুলোর অবস্থান আরও নিয়মতান্ত্রিক ও যুক্তিসংগত হয় বলে তারা মনে করেন।) পর্যায় সারণির এই অংশে মোট আটটি কলাম রয়েছে। প্রতিটি কলাম এমন মৌলগুলোর জন্য নির্ধারিত, যাদের বহিঃস্থ (বাইরের) শেলে সর্বাধিক আটটি ইলেকট্রন থাকতে পারে।[৬৩] যখন একটি নতুন ইলেকট্রন শেল পূরণ হওয়া শুরু করে, তখন একটি নতুন সারি বা "পিরিয়ড" শুরু হয়। এছাড়াও, সারণিতে রঙের সাহায্যে বিভিন্ন ব্লক চিহ্নিত করা হয়েছে।[৪৫] s-ব্লকের মৌলগুলো (লাল রঙে) s-অর্বিটালে ইলেকট্রন নিচ্ছে, আর p-ব্লকের মৌলগুলো (হলুদ রঙে) p-অর্বিটালে ইলেকট্রন নিচ্ছে।[৪৫]
| ১ H |
২ He |
২×১ = ২টি মৌল 1s | ||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
২×(১+৩) = ৮টি মৌল 2s 2p |
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
২×(১+৩) = ৮টি মৌল 3s 3p |
পরবর্তী সারিতে পৌঁছালে দেখা যায়, পটাশিয়াম ও ক্যালসিয়ামের ক্ষেত্রে 4s অরবিটালের শক্তি সবচেয়ে কম হওয়ায় ইলেকট্রন আগে এই অরবিটালেই প্রবেশ করে।[৪৭][৬৪] পটাশিয়াম একটি ইলেকট্রন 4s অরবিটালে যোগ করে ([Ar] 4s1), আর ক্যালসিয়াম সেই অরবিটাল পূর্ণ করে দেয় ([Ar] 4s2)। তবে স্ক্যানডিয়াম থেকে শুরু হলে দৃশ্যপট বদলে যায়। তখন 3d অরবিটালের শক্তি 4s-এর কাছাকাছি বা তার চেয়েও কম হতে পারে, ফলে ইলেকট্রন 3d অরবিটালে প্রবেশ করতে শুরু করে। তাই স্ক্যান্ডিয়ামের ইলেকট্রন বিন্যাস হয় [Ar] 3d1 4s2, যেখানে 3d অরবিটাল নতুনভাবে পূরণ হতে শুরু করে। বস্তুত, 4s ও 3d অরবিটালের শক্তি প্রায় সমান হওয়ায়, কোনটিতে আগে ইলেকট্রন প্রবেশ করবে তা সব সময় নির্ধারিত থাকে না। অনেক সময় এ দুটি অরবিটাল ইলেকট্রনের জন্য একে অপরের সঙ্গে প্রতিযোগিতা করে। একেক মৌলে এদের শক্তির ক্রম ভিন্ন হতে পারে, বিশেষ করে সারির ভেতরে অগ্রসর হওয়ার সঙ্গে সঙ্গে এই পার্থক্য পরিবর্তিত হয়। এমনকি কোনো পরমাণু থেকে ইলেকট্রন সরালে 4s ও 3d অরবিটালের শক্তির অবস্থানও পাল্টে যেতে পারে। উদাহরণস্বরূপ, ক্রোমিয়ামের ইলেকট্রন বিন্যাস হওয়া উচিত [Ar] 3d4 4s2। কিন্তু বাস্তবে দেখা যায়, এর পরিবর্তে বিন্যাস হয় [Ar] 3d5 4s1। এর কারণ হলো—যখন 3d অরবিটালে ঠিক মাঝামাঝি সংখ্যক ইলেকট্রন থাকে, তখন সেটি তুলনামূলকভাবে বেশি স্থিতিশীল হয়। একই রকম ব্যতিক্রম দেখা যায় তামার ক্ষেত্রেও। প্রত্যাশিত ছিল [Ar] 3d9 4s2, কিন্তু প্রকৃত বিন্যাস হয় [Ar] 3d10 4s1, কারণ পূর্ণ 3d অরবিটাল এটিকে আরও স্থিতিশীল করে তোলে।[৪৭] এই ধরনের ব্যতিক্রমগুলোকে বলা হয় ম্যাডেলুং নিয়মের ব্যত্যয়। তবে এই ব্যতিক্রমগুলোর বাস্তব রসায়নে বিশেষ গুরুত্ব নেই। কারণ অধিকাংশ রাসায়নিক বিক্রিয়া ঘটে পরমাণুর পারস্পরিক ক্রিয়ায়,[৬৫] একক গ্যাসীয় পরমাণুতে নয়।[৬৬] আর ব্যতিক্রম ইলেকট্রন বিন্যাসগুলোর শক্তির পার্থক্য এতটাই সামান্য[৬৭] যে আশেপাশে অন্য পরমাণুর প্রভাবেই সেই ভারসাম্য সহজেই বদলে যেতে পারে।[৪৭] তাই পর্যায় সারণিতে এই ক্ষুদ্র পার্থক্যগুলিকে উপেক্ষা করে আদর্শ ইলেকট্রন বিন্যাসই গ্রহণ করা হয়।[৩৮]
জিংকের ইলেকট্রন বিন্যাস [Ar] 3d10 4s2, যেখানে 3d অরবিটালে দশটি ইলেকট্রন পূর্ণভাবে ভরাট থাকে।[৪৭][৬৮] এরপর শুরু হয় 4p অরবিটালে ইলেকট্রন যোগ হওয়া, যা গ্যালিয়াম ([Ar] 3d10 4s2 4p1) থেকে শুরু হয়ে ক্রিপ্টন ([Ar] 3d10 4s2 4p6) পর্যন্ত সম্পন্ন হয়। এই ধারা p-ব্লকের আগের উপাদানগুলোর মতোই নিয়ম মেনে চলে।[৪৭][৬৯] গ্যালিয়াম থেকে শুরু করে 3d অরবিটাল আর রাসায়নিক বিক্রিয়ায় অংশ নেয় না; এগুলো তখন ইলেকট্রনিক কোরের অংশ হিসেবে বিবেচিত হয়।[৭০] যেসব উপাদান তাদের সবচেয়ে বাইরের s এবং p অরবিটালে ইলেকট্রন যোগ করে, সেগুলোকে মূল-শ্রেণী উপাদান (main-group elements) বলা হয়। অন্যদিকে, যেসব উপাদান অভ্যন্তরীণ d অরবিটাল পূরণ করে, তাদের বলা হয় ট্রানজিশন উপাদান বা অবস্থান্তর ধাতু (transition metals)।[৭১] এদের প্রত্যেকটিই ধাতু এবং এদের বৈশিষ্ট্য সাধারণত একে অপরের সঙ্গে মিল রাখে। নিচের চিত্রে d-ব্লকের এই উপাদানগুলোকে নীল রঙে চিহ্নিত করা হয়েছে।
এই পর্যায়ে পরবর্তী ১৮টি উপাদান প্রথমে 5s অরবিটাল পূরণ করে (যেমন রুবিডিয়াম ও স্ট্রনশিয়াম)। এরপর পূরণ হয় 4d অরবিটাল, যা ইট্রিয়াম থেকে ক্যাডমিয়াম পর্যন্ত বিস্তৃত। শেষে পূরণ হয় 5p অরবিটাল, ইন্ডিয়াম থেকে জেনন পর্যন্ত। যদিও এই শ্রেণিতেও কিছু ব্যতিক্রম দেখা যায়, সামগ্রিক ধারা প্রায় একই থাকে।[৪৫][৭২] ইন্ডিয়াম থেকে শুরু করে 4d অরবিটালগুলো ইলেকট্রনিক কোরের অন্তর্ভুক্ত হয়ে যায় এবং আর রাসায়নিক বিক্রিয়ায় অংশ নেয় না।[৭৩][৭৪] ফলে পঞ্চম সারির ইলেকট্রন বিন্যাস চতুর্থ সারির মতোই একটি সুসংগঠিত কাঠামো অনুসরণ করে।[৪৫]
| ১ H |
২ He |
২×১ = ২টি মৌল 1s | ||||||||||||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
২×(১+৩) = ৮টি মৌল 2s 2p | ||||||||||
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
২×(১+৩) = ৮টি মৌল 3s 3p | ||||||||||
| ১৯ K |
২০ Ca |
২১ Sc |
২২ Ti |
২৩ V |
২৪ Cr |
২৫ Mn |
২৬ Fe |
২৭ Co |
২৮ Ni |
২৯ Cu |
৩০ Zn |
৩১ Ga |
৩২ Ge |
৩৩ As |
৩৪ Se |
৩৫ Br |
৩৬ Kr |
২×(১+৩+৫) = ১৮টি মৌল 4s 3d 4p |
| ৩৭ Rb |
৩৮ Sr |
৩৯ Y |
৪০ Zr |
৪১ Nb |
৪২ Mo |
৪৩ Tc |
৪৪ Ru |
৪৫ Rh |
৪৬ Pd |
৪৭ Ag |
৪৮ Cd |
৪৯ In |
৫০ Sn |
৫১ Sb |
৫২ Te |
৫৩ I |
৫৪ Xe |
২×(১+৩+৫) = ১৮টি মৌল 5s 4d 5p |
সারণির ষষ্ঠ সারি শুরু হয় দুটি s-ব্লকের মৌল—সিজিয়াম ও বেরিয়াম দিয়ে।[৭৫] এরপর যুক্ত হয় f-ব্লকের প্রথম শ্রেণির মৌলগুলো (নীচে সবুজ রঙে দেখানো হয়েছে), যার শুরু ল্যান্থানাম দিয়ে। এদেরকে প্রায়ই "অভ্যন্তরীণ স্থানান্তর মৌল" বলা হয়।[৭১] এই পর্যায়ে 4f, 5d এবং 6s সাবশেলগুলোর শক্তি প্রায় একই হওয়ায় ইলেকট্রন কোন অরবিটালে যাবে, তা নিয়ে এক ধরনের প্রতিযোগিতা সৃষ্টি হয়। এর ফলে অনেক মৌলে ইলেকট্রন বিন্যাস প্রত্যাশিত নিয়ম থেকে কিছুটা ভিন্ন হয়ে যায়।[৬৭] একসময় f-ব্লক আসলে কোথা থেকে শুরু হয় তা নিয়ে মতভেদ ছিল, তবে এখন বেশিরভাগ বিজ্ঞানী মনে করেন—'আউফবাউ নীতি' অনুসারে এর সূচনা ল্যান্থানাম থেকেই।[৭৬] ল্যান্থানামের 4f অরবিটাল পুরোপুরি পূর্ণ না হলেও, এর শক্তিস্তর এতটাই নিচু[৬৫] যে এটি রাসায়নিক বিক্রিয়ায় সক্রিয়ভাবে অংশ নিতে পারে।[৫৫][৭৭][৭৮] এরপর ইটারবিয়ামে এসে 4f অরবিটাল পুরোপুরি পূর্ণ হয়, যেখানে মোট ১৪টি ইলেকট্রন থাকে। এরপর আসে দশটি স্থানান্তর মৌল, যেগুলো লুটেশিয়াম থেকে শুরু হয়ে মারকিউরি পর্যন্ত বিস্তৃত।[৭৯][৮০][৮১][৮২] এরপর মূল শ্রেণির ছয়টি মৌল—থ্যালিয়াম থেকে রেডন—এই সারির শেষ অংশ গঠন করে।[৮৩][৮৪] লুটেশিয়াম পর্যন্ত এসে 4f অরবিটালগুলোর ইলেকট্রন পরমাণুর গভীরে, অর্থাৎ কোরে চলে যায়।[৭৮][৮৫] একইভাবে, থ্যালিয়াম থেকে শুরু করে 5d অরবিটালগুলোও আর বাইরের তলের অংশ থাকে না, বরং সেগুলোও কোর অরবিটালে পরিণত হয়।[৭০][৮৬][৮৭]
সপ্তম পর্যায়ের মৌলগুলোর বিন্যাস ষষ্ঠ পর্যায়ের সঙ্গে অনেকটাই মিলে যায়। শুরুতে পূর্ণ হয় 7s অরবিটাল, যার মধ্যে পড়ে ফ্রান্সিয়াম ও রেডিয়াম। এরপর পূরণ হয় 5f অরবিটাল, যেখানে অ্যাক্টিনিয়াম থেকে শুরু করে নোবেলিয়াম পর্যন্ত মৌলগুলো অবস্থান করে। এরপর আসে 6d অরবিটাল, যা লরেন্সিয়াম থেকে কোপার্নিসিয়াম পর্যন্ত বিস্তৃত। সবশেষে পূর্ণ হয় 7p অরবিটাল, যার অন্তর্গত নিহোনিয়াম থেকে শুরু করে ওগানেসন পর্যন্ত মৌল।[৮৮] লরেন্সিয়াম থেকে শুরু করে 5f অরবিটালগুলো সাধারণত পরমাণুর মূল বা কেন্দ্রীয় অংশে (কোর) অবস্থান করে।[৮৯] ধারণা করা হয়, নিহোনিয়াম থেকে শুরু করে 6d অরবিটালগুলোও পর্যায়ক্রমে সেই কেন্দ্রীয় কাঠামোর অংশে পরিণত হয়।[৯০][৯১][ট] তবে এই পর্যায়েও কিছু ব্যতিক্রম দেখা যায়।[৪৫] যেমন, একক পরমাণু অবস্থায় অ্যাক্টিনিয়াম ও থোরিয়াম সাধারণত 5f সাবশেল পূর্ণ করে না এবং লরেন্সিয়ামও 6d সাবশেল পূর্ণ করে না। যদিও এদের স্বাভাবিক অবস্থায় এই সাবশেলগুলো খালি থাকে, তবুও বিভিন্ন রাসায়নিক পরিবেশে এদের এই সাবশেলগুলো পূর্ণ হতে পারে।[৯৩][৯৪][৯৫] সপ্তম পর্যায় দীর্ঘ সময় ধরে অসম্পূর্ণ ছিল, কারণ এই পর্যায়ের অধিকাংশ মৌলই প্রকৃতিতে অনুপস্থিত। ইউরেনিয়ামের পরবর্তী মৌলগুলোর পরীক্ষাগারে সংশ্লেষণ শুরু হয় ১৯৪০ সালে, নেপচুনিয়াম তৈরির মাধ্যমে।[৯৬](তবে প্রকৃতিতে অনুপস্থিত অবস্থায় প্রথম পরীক্ষাগারে তৈরি হওয়া মৌল ছিল টেকনিশিয়াম, যার আবিষ্কার ঘটে ১৯৩৭ সালে।) সপ্তম পর্যায়টি পূর্ণতা পায় ২০১০ সালে, টেনেসিনের সফল সংশ্লেষণের মাধ্যমে[৯৭] (এর আগেই, ২০০২ সালে তৈরি হয়েছিল ওগানেসন)।[৯৮] পরিশেষে, ২০১৬ সালে এই পর্যায়ের সর্বশেষ কয়েকটি মৌলের আনুষ্ঠানিক নামকরণ সম্পন্ন হয়।[৯৯]
| ১ H |
২ He |
২×১ = ২টি মৌল
1s | ||||||||||||||||||||||||||||||
| ৩ Li |
৪ Be |
৫ B |
৬ C |
৭ N |
৮ O |
৯ F |
১০ Ne |
২×(১+৩) = ৮টি মৌল
2s 2p | ||||||||||||||||||||||||
| ১১ Na |
১২ Mg |
১৩ Al |
১৪ Si |
১৫ P |
১৬ S |
১৭ Cl |
১৮ Ar |
২×(১+৩) = ৮টি মৌল
3s 3p | ||||||||||||||||||||||||
| ১৯ K |
২০ Ca |
২১ Sc |
২২ Ti |
২৩ V |
২৪ Cr |
২৫ Mn |
২৬ Fe |
২৭ Co |
২৮ Ni |
২৯ Cu |
৩০ Zn |
৩১ Ga |
৩২ Ge |
৩৩ As |
৩৪ Se |
৩৫ Br |
৩৬ Kr |
২×(১+৩+৫) = ১৮টি মৌল
4s 3d 4p | ||||||||||||||
| ৩৭ Rb |
৩৮ Sr |
৩৯ Y |
৪০ Zr |
৪১ Nb |
৪২ Mo |
৪৩ Tc |
৪৪ Ru |
৪৫ Rh |
৪৬ Pd |
৪৭ Ag |
৪৮ Cd |
৪৯ In |
৫০ Sn |
৫১ Sb |
৫২ Te |
৫৩ I |
৫৪ Xe |
২×(১+৩+৫) = ১৮টি মৌল
5s 4d 5p | ||||||||||||||
| ৫৫ Cs |
৫৬ Ba |
৫৭ La |
৫৮ Ce |
৫৯ Pr |
৬০ Nd |
৬১ Pm |
৬২ Sm |
৬৩ Eu |
৬৪ Gd |
৬৫ Tb |
৬৬ Dy |
৬৭ Ho |
৬৮ Er |
৬৯ Tm |
৭০ Yb |
৭১ Lu |
৭২ Hf |
৭৩ Ta |
৭৪ W |
৭৫ Re |
৭৬ Os |
৭৭ Ir |
৭৮ Pt |
৭৯ Au |
৮০ Hg |
৮১ Tl |
৮২ Pb |
৮৩ Bi |
৮৪ Po |
৮৫ At |
৮৬ Rn |
২×(১+৩+৫+৭) = ৩২টি মৌল
6s 4f 5d 6p |
| ৮৭ Fr |
৮৮ Ra |
৮৯ Ac |
৯০ Th |
৯১ Pa |
৯২ U |
৯৩ Np |
৯৪ Pu |
৯৫ Am |
৯৬ Cm |
৯৭ Bk |
৯৮ Cf |
৯৯ Es |
১০০ Fm |
১০১ Md |
১০২ No |
১০৩ Lr |
১০৪ Rf |
১০৫ Db |
১০৬ Sg |
১০৭ Bh |
১০৮ Hs |
১০৯ Mt |
১১০ Ds |
১১১ Rg |
১১২ Cn |
১১৩ Nh |
১১৪ Fl |
১১৫ Mc |
১১৬ Lv |
১১৭ Ts |
১১৮ Og |
২×(১+৩+৫+৭) = ৩২টি মৌল
7s 5f 6d 7p |
এই আধুনিক পর্যায় সারণিতে এখন পর্যন্ত আবিষ্কৃত সব মৌল যুক্ত হয়েছে, ফলে সাতটি সারিই সম্পূর্ণভাবে পূর্ণ হয়েছে।[৯৯]
ইলেকট্রন বিন্যাসের সারণি
নিচের সারণিতে প্রতিটি মৌলিক উপাদানের নিরপেক্ষ গ্যাসীয় অবস্থায় ইলেকট্রন বিন্যাস দেখানো হয়েছে। সাধারণভাবে, এই বিন্যাস নির্দিষ্ট নিয়ম মেনে চলে। তবে বিভিন্ন রাসায়নিক পরিবেশে এটি কিছুটা ভিন্ন হতে পারে।[৬৫] প্রধান গ্রুপের উপাদানগুলোর ইলেকট্রন বিন্যাস সাধারণত সুনির্দিষ্ট ও নিয়মিত ধাঁচে গঠিত। অন্যদিকে, অবস্থান্তর ও আন্তঃঅবস্থান্তর উপাদানগুলোর ক্ষেত্রে শক্তি স্তরের কাছাকাছি থাকা সাবশেলগুলোর মধ্যে প্রতিযোগিতার কারণে মোট বিশটি ব্যতিক্রম লক্ষ্য করা যায়। শেষ দশটি মৌল (১০৯ থেকে ১১৮) নিয়ে এখনো নির্ভরযোগ্য পরীক্ষামূলক তথ্য পাওয়া যায়নি।[১০০] তাই সেগুলোর ইলেকট্রন বিন্যাস তাত্ত্বিকভাবে হিসাব করে উপস্থাপন করা হয়েছে।[১০১] যেসব সাবশেল পুরোপুরি পূর্ণ, সেগুলো সারণিতে ধূসর রঙে দেখানো হয়েছে।
Remove ads
বৈচিত্র
সারাংশ
প্রসঙ্গ
পর্যায় ১
বর্তমানে আধুনিক পর্যায় সারণি একটি মানক হিসেবে গৃহীত হলেও, প্রথম পর্যায়ের দুটি মৌল—হাইড্রোজেন ও হিলিয়াম—এর অবস্থান নিয়ে এখনও বিতর্ক রয়েছে। এ নিয়ে বিভিন্ন রকম বিন্যাসও দেখা যায়।[১০২][১০৩] তাদের s1 ও s2 ইলেকট্রন বিন্যাস অনুসারে হাইড্রোজেনকে গ্রুপ ১ এবং হিলিয়ামকে গ্রুপ ২-এ রাখা যুক্তিযুক্ত বলে মনে করা হয়।[১০২] হাইড্রোজেন সাধারণত গ্রুপ ১-এ রাখা হলেও, হিলিয়ামকে প্রায় সবসময় গ্রুপ ১৮-এ অন্যান্য নিষ্ক্রিয় গ্যাসের সঙ্গে রাখা হয়।[৬] এই বিতর্কের কেন্দ্রে রয়েছে—পর্যায় সারণিতে মৌলের অবস্থান নির্ধারণে রাসায়নিক বৈশিষ্ট্য বেশি গুরুত্বপূর্ণ, নাকি ইলেকট্রন বিন্যাস।
হাইড্রোজেনের বাইরের কক্ষে একটি ইলেকট্রন থাকে,[১০৪] এবং রাসায়নিক বিক্রিয়ায় সেটি হারিয়ে ফেলে, যেমন গ্রুপ ১-এর ধাতুগুলির ক্ষেত্রে দেখা যায়।[১০৫] এটি কিছু ধাতুর মতো আচরণ করে এবং তাদের লবণ থেকে স্থানচ্যুত করতে পারে।[১০৫] তবে, হাইড্রোজেন স্বাভাবিক অবস্থায় একটি দ্বিমূলক অ-ধাতব গ্যাস, যেখানে ক্ষার ধাতুগুলি কঠিন ও অত্যন্ত প্রতিক্রিয়াশীল। এছাড়াও হাইড্রোজেন ইলেকট্রন গ্রহণ করে হাইড্রাইড (H⁻) তৈরি করতে পারে, যেটি হ্যালোজেনদের মতো আচরণ।[১০৫] যদিও এটি তুলনামূলকভাবে বিরল, কারণ H⁺ আকারে দেখা যাওয়াই বেশি সাধারণ।[১০৬] আরও একটি মিল হলো—হালকা দুটি হ্যালোজেন, যেমন ফ্লোরিন ও ক্লোরিন, স্বাভাবিক অবস্থায় গ্যাসীয় রূপে থাকে, যেটি হাইড্রোজেনের মতোই।[১০৫] তবুও, হাইড্রোজেন অনেক দিক থেকে কোনো একটি নির্দিষ্ট গ্রুপের সঙ্গে পুরোপুরি মেলে না। এটি খুব বেশি অক্সিডাইজিং বা রিডিউসিং নয় এবং জলের সঙ্গে প্রতিক্রিয়া করে না।[১০৬] এই কারণে, হাইড্রোজেনের মধ্যে একদিকে যেমন গ্রুপ ১-এর ধাতুর বৈশিষ্ট্য দেখা যায়, অন্যদিকে আবার হ্যালোজেনদের সঙ্গেও মিল রয়েছে। কিন্তু একটিতেও এটি পুরোপুরি ফিট হয় না।[১০৫] ফলে, যদিও ইলেকট্রন বিন্যাস অনুসারে হাইড্রোজেনকে গ্রুপ ১-এ রাখা প্রচলিত, তবুও কিছু সারণিতে এটিকে গ্রুপ ১৭-এ,[১০৭] একসাথে গ্রুপ ১ ও ১৭—উভয় গ্রুপেই,[১০৮][১০৯] অথবা কোনো গ্রুপ ছাড়াই আলাদাভাবে উপস্থাপন করা হয়েছে।[১০২][১০৯][১১০] তবে এই আলাদা উপস্থাপনাকে সমালোচনা করেছেন রসায়নবিদ ও বিজ্ঞান দর্শনের বিশেষজ্ঞ এরিক স্কেরি। তাঁর মতে, এতে হাইড্রোজেনকে এমনভাবে উপস্থাপন করা হয় যেন এটি পর্যায় সারণির সাধারণ নিয়মের বাইরে একটি মৌল, যেখানে অন্য সব মৌল সেই নিয়মের অধীন।[১১১]
হিলিয়াম এমন একমাত্র মৌল যা পর্যায় সারণিতে এমন একটি অবস্থান দখল করে, যা তার ইলেকট্রনিক বিন্যাসের সাথে পুরোপুরি মেলে না। এর বাইরের শেলে মাত্র দুটি ইলেকট্রন থাকে, যেখানে অন্যান্য নিষ্ক্রিয় গ্যাসগুলোর থাকে আটটি। ইলেকট্রনিক গঠনের দিক থেকে এটি s-ব্লক-এর অন্তর্ভুক্ত, অথচ বাকি নিষ্ক্রিয় গ্যাসগুলো পড়ে p-ব্লক-এ। তবে হিলিয়াম সাধারণ অবস্থায় অত্যন্ত নিষ্ক্রিয় এবং এর বাইরের শেল পূর্ণ থাকে। এই গুণগুলো গ্রুপ ১৮-এর নিষ্ক্রিয় গ্যাসগুলোর সঙ্গে অনেকটা মেলে। কিন্তু গ্রুপ ২-এর প্রতিক্রিয়াশীল ক্ষারধাতুগুলোর সঙ্গে এর কোনও মিল নেই। এই কারণেই হিলিয়ামকে সাধারণত গ্রুপ ১৮-এ রাখা হয়,[১১২] কারণ এই গ্রুপের উপাদানগুলোর বৈশিষ্ট্যের সাথেই এটি সবচেয়ে বেশি সাদৃশ্যপূর্ণ।[৭০] ১৯৮৮ সালে হিলিয়ামকে গ্রুপ ২-এ স্থানান্তরের একটি প্রস্তাব আইইউপিএসি প্রত্যাখ্যান করে।[১১৩] তবে এখনো কিছু ক্ষেত্রে হিলিয়ামকে গ্রুপ ২-এ রাখা হয়,[১১৪] কারণ এর কিছু ভৌত ও রসায়নগত বৈশিষ্ট্য গ্রুপ ২-এর উপাদানগুলোর সঙ্গে মিলে যায়।[৭০][১১৫] উদাহরণস্বরূপ, কঠিন অবস্থায় হিলিয়াম একটি হেক্সাগোনাল ক্লোজ-প্যাকড (hexagonal close-packed) স্ফটিক গঠন করে, যা বেরিলিয়াম ও ম্যাগনেসিয়ামের মতো — অর্থাৎ গ্রুপ ২-এর ধাতুগুলোর অনুরূপ। কিন্তু এটি গ্রুপ ১৮-এর অন্যান্য নিষ্ক্রিয় গ্যাসগুলোর গঠন থেকে আলাদা।[১১৬] নিষ্ক্রিয় গ্যাস রসায়নের সাম্প্রতিক গবেষণায় দেখা গেছে, হিলিয়াম নিয়নের চেয়ে কিছুটা কম নিষ্ক্রিয় এবং এটি (HeO)(LiF)2 নামে একটি যৌগ তৈরি করতে পারে, যার গঠন বেরিলিয়ামের অনুরূপ একটি যৌগের মতো। নিয়নের কোনো অনুরূপ যৌগ নেই। এই পার্থক্যটি ইলেকট্রনিক স্তরের কারণেই—নিয়নের পূর্ণ p-শেল অন্য পদার্থকে প্রবেশ করতে বাধা দেয়, কিন্তু হিলিয়ামের ক্ষেত্রে এমন বাধা নেই। তবে বাস্তবিক অর্থে হিলিয়াম-যুক্ত এই ধরনের যৌগ কেবলমাত্র অতি নিম্ন তাপমাত্রা (প্রায় ১০ কেলভিন) তে টিকতে পারে।[১১৭][১১৮][১১৯][১২০]
পর্যায় সারণির প্রথম সারির বৈসাদৃশ্য-এর ধারণা হেলিয়ামকে গ্রুপ ২-এ স্থানান্তরের পক্ষে একটি যুক্তি হিসেবে উপস্থাপন করা হয়েছে। এই বৈসাদৃশ্যের মূল কারণ হলো, যেকোনো অরবিটালের প্রথম সারির কক্ষপথ (orbital) আকারে ছোট হয়। কারণ, এই কক্ষপথগুলোতে একই ধরনের আরও ছোট কোনো কক্ষপথ থেকে ইলেকট্রনের বিকর্ষণ (repulsion) থাকে না। ফলে প্রতিটি ব্লকের প্রথম সারির মৌলগুলো আকারে তুলনামূলকভাবে ছোট হয় এবং এরা প্রায়শই নিজ নিজ গোষ্ঠীর অন্য সদস্যদের তুলনায় কিছু ব্যতিক্রমধর্মী বৈশিষ্ট্য প্রদর্শন করে। অনেক রসায়নবিদের মতে, হেলিয়ামকে যদি গ্রুপ ২-এ রাখা হয়, তাহলে সে এই প্রথম সারির বৈসাদৃশ্যের বৈশিষ্ট্য দেখায়। কিন্তু গ্রুপ ১৮-এ রাখলে তা দেখা যায় না। অন্যদিকে, যদি হেলিয়ামকে গ্রুপ ১৮ থেকে সরানো হয়, তাহলে নিওন ওই গোষ্ঠীর প্রথম সদস্য হবে, এবং নিওনের ক্ষেত্রে এই বৈসাদৃশ্যগুলো স্পষ্টভাবে দেখা যায়। এই যুক্তির প্রসঙ্গে আরও বলা হয়, হেলিয়াম ও বেরিলিয়ামের সম্পর্ক অনেকটা হাইড্রোজেন ও লিথিয়ামের মতো, যা অধিকাংশ ক্ষেত্রে গ্রহণযোগ্য একটি বিন্যাস। উদাহরণ হিসেবে, অরবিটালের আকারে পার্থক্যের কারণে গ্রুপ ১ এবং ১৩–১৭ পর্যন্ত প্রায় সব প্রধান গোষ্ঠীতেই প্রথম ও দ্বিতীয় সদস্যদের পরমাণু ব্যাসার্ধে বড় পার্থক্য দেখা যায়। এই পার্থক্য নিওন ও আর্জনের মধ্যে যেমন আছে, তেমনই হেলিয়াম ও বেরিলিয়ামের মধ্যেও দেখা যায়; কিন্তু হেলিয়াম ও নিওনের মধ্যে এই পার্থক্য নেই। এই ধারাটি গ্যাসগুলোর স্ফুটনাঙ্ক (boiling point) এবং পানিতে দ্রাব্যতা (solubility) এমনকি অন্যান্য ভৌত বৈশিষ্ট্যেও প্রভাব ফেলে। হেলিয়াম ও নিওনের মাঝে এ পার্থক্য কম, অথচ নিওন ও আর্জনের মাঝে তা স্পষ্ট। হেলিয়ামকে যদি গ্রুপ ২-এ স্থান দেওয়া হয়, তাহলে গ্রুপ ২ ও ১৮-এ এই ধারাবাহিকতা বজায় থাকে। সেক্ষেত্রে হেলিয়াম হবে গ্রুপ ২-এর প্রথম সদস্য এবং নিওন হবে গ্রুপ ১৮-এর প্রথম সদস্য, এবং দুজনই তাদের গোষ্ঠীর প্রথম সদস্য হিসেবে ব্যতিক্রমধর্মী বৈশিষ্ট্য (kainosymmetric বৈশিষ্ট্য) প্রদর্শন করবে। তবে, হেলিয়ামের চরম নিষ্ক্রিয়তা (inertness)-র কারণে একে গ্রুপ ১৮-এ রাখা এখনও অধিকাংশ ক্ষেত্রেই প্রচলিত। যদিও কিছু কিছু পর্যায় সারণিতে হাইড্রোজেন ও হেলিয়ামকে সব গোষ্ঠীর বাইরে আলাদাভাবে দেখানো হয়, তা বিরল।
গ্রুপ ৩
অনেক পর্যায় সারণিতে f-ব্লককে এক ঘর ডানদিকে সরিয়ে দেখানো হয়। এতে ল্যান্থানাম (La) ও অ্যাকটিনিয়াম (Ac) গ্রুপ ৩-এ স্থান পায় এবং d-ব্লকের অন্তর্ভুক্ত হয়। এই অবস্থায় Ce থেকে Lu এবং Th থেকে Lr উপাদানগুলো f-ব্লকে চলে আসে। এর ফলে d-ব্লকটি দুই অসম অংশে বিভক্ত হয়ে যায়। এই বিভাজনের মূল কারণ ছিল প্রাথমিক সময়ে ইলেকট্রন বিন্যাসের ভুল পরিমাপ। তবে আধুনিক বিশ্লেষণে দেখা গেছে, লুটেটিয়াম (Lu) ও লরেন্সিয়াম (Lr)-কে গ্রুপ ৩-এ অন্তর্ভুক্ত করাই অধিক সঙ্গতিপূর্ণ। এক্ষেত্রে f-ব্লক হিসেবে ধরা হয় La থেকে Yb এবং Ac থেকে No পর্যন্ত উপাদানগুলোকে।[২৫][১২১]
4f শেলটি ইটারবিয়াম পর্যন্ত পূর্ণ হয়। এই কারণে ১৯৪৮ সালে লেভ ল্যান্ডাউ ও ইভগেনি লিফশিৎস মত দেন যে, লুটেটিয়ামকে f-ব্লকের উপাদান হিসেবে শ্রেণিবদ্ধ করা ঠিক নয়।[২৬] যদিও তারা তখনও ল্যান্থানামকে d-ব্লক থেকে সরানোর প্রস্তাব দেননি, ১৯৬৩ সালে জুন কন্দো লক্ষ্য করেন, ল্যান্থানামের নিম্ন তাপমাত্রায় সুপারকন্ডাক্টিভিটি দেখানোর ক্ষমতা তার 4f শেলের সক্রিয়তার ইঙ্গিত দেয়।[১২২] এরপর ১৯৬৫ সালে ডেভিড সি. হ্যামিলটন এই পর্যবেক্ষণের ভিত্তিতে যুক্তি দেন যে, f-ব্লকে থাকা উচিত La থেকে Yb এবং Ac থেকে No পর্যন্ত উপাদানগুলো।[১২৩] এর পর থেকে শারীরিক, রাসায়নিক এবং ইলেকট্রনিক প্রমাণও এই বিন্যাসকে সমর্থন করে এসেছে।[২৩][২৫][১২১] এই প্রসঙ্গটি ১৯৮২ সালে উইলিয়াম বি. জেনসেনের লেখার মাধ্যমে বিস্তৃতভাবে আলোচিত হয়।[২৫] এরপর ১৯৮৮ সালের IUPAC-এর প্রতিবেদনে (যখন ১–১৮ গ্রুপ নম্বর প্রবর্তিত হয়) এবং ২০২১ সালের হালনাগাদ প্রতিবেদনে লুটেটিয়াম ও লরেন্সিয়ামকে গ্রুপ ৩-এ অন্তর্ভুক্ত করার প্রস্তাব সমর্থন লাভ করে।[২৩][২৪] তবুও, অনেক পাঠ্যপুস্তক লেখক এখনো এই বিষয়টি সম্পর্কে সচেতন না থাকায় বিভ্রান্তিকর বিভিন্ন বিন্যাস এখনো প্রচলিত আছে।[২৫]
আরও একটি বিন্যাস মাঝে মাঝে দেখা যায়, যেখানে গ্রুপ ৩-এ ইট্রিয়ামের নিচে থাকা ঘর দুটি ফাঁকা রাখা হয়। এমন একটি উপস্থাপন IUPAC-এর ওয়েবসাইটে প্রকাশিত একটি সারণিতেও দেখা যায়।[৬] তবে এতে একটি মৌলিক অসঙ্গতি দেখা যায়: f-ব্লককে ১৫টি উপাদানে বিস্তৃত দেখানো হয় (La–Lu ও Ac–Lr), যদিও কোয়ান্টাম বলবিদ্যা অনুযায়ী একটি f-শেলে সর্বোচ্চ ১৪টি ইলেকট্রনই স্থান পেতে পারে।[২৪] এই ধরনের বিন্যাসে গ্রুপ ৩-এ কোন উপাদানগুলো পড়ে, তা নিয়েও গবেষণাপত্রে বিভ্রান্তি লক্ষ্য করা যায়।[৩৩][২৪][১২৪][১২৫][১২৬] ২০২১ সালের IUPAC প্রতিবেদন জানায়, আপেক্ষিক কোয়ান্টাম বলবিদ্যার একটি বিশেষ শাখায় কাজ করা কিছু গবেষক—যারা অতিভারী উপাদানের ধর্ম নিয়ে গবেষণা করেন—তারা ১৫টি উপাদানে গঠিত f-ব্লক গ্রহণযোগ্য মনে করেন। তবে প্রতিবেদনে স্পষ্টভাবে বলা হয়েছে, এই ধরনের ক্ষেত্রবিশেষ নির্ভর দৃষ্টিভঙ্গি সাধারণ রসায়ন ও বিজ্ঞান সমাজের জন্য প্রযোজ্য হওয়া উচিত নয়।[২৪] পরবর্তীকালে, অতিভারী উপাদান নিয়ে কাজ করা গবেষকেরা ব্যাখ্যা করেছেন যে, f-ব্লকের ১৫তম উপাদান আসলে d-ব্লকের প্রথম ঘর—যেটি ইচ্ছাকৃতভাবে ফাঁকা রাখা হয়, যাতে বোঝানো যায় যে এটি f-ব্লক 'প্রবেশপথ' হিসেবে কাজ করছে। এর মানে হলো, এই বিন্যাসেও লুটেটিয়াম ও লরেন্সিয়াম, যারা সেই ১৫তম অবস্থানে থাকে, প্রকৃতপক্ষে গ্রুপ ৩-এর d-ব্লক উপাদান হিসেবেই বিবেচিত।[১২৭] আসলে, যখন IUPAC ৩২-ঘরবিশিষ্ট বিস্তৃত পর্যায় সারণি প্রকাশ করে, তখন তারা স্পষ্টভাবে লুটেটিয়াম ও লরেন্সিয়ামকে ইট্রিয়ামের নিচে, অর্থাৎ গ্রুপ ৩-এ রাখে।[১২৮][১২৯]
সাহিত্যে Sc–Y–La–Ac বিন্যাসের পক্ষেও কিছু যুক্তি উপস্থাপিত হয়েছে।[১৩০][১৩১] তবে এসব যুক্তিকে অনেক গবেষক যুক্তিবিচারে অসঙ্গত বলে চিহ্নিত করেছেন।[২৮][২৭][২৯] একটি সাধারণ দাবি হলো—ল্যান্থানাম ও অ্যাকটিনিয়াম গ্যাস অবস্থায় থাকাকালে f-অর্বিটালে ইলেকট্রন ভর্তি শুরু করে না, তাই তাদের f-ব্লকের উপাদান বলা যায় না।[১৩২] কিন্তু একই বৈশিষ্ট্য থোরিয়ামেরও রয়েছে, অথচ তাকে f-ব্লকের উপাদান হিসেবে বিবেচনা করা নিয়ে কোনো বিতর্ক নেই।[২৫][২৪] এই যুক্তি আরেকটি গুরুত্বপূর্ণ বিষয়ে নিরব — f-অর্বিটাল পূর্ণ হয় ইটারবিয়াম (Yb) ও নোবেলিয়াম (No)-তে, যা Sc–Y–Lu–Lr বিন্যাসের সঙ্গে সামঞ্জস্যপূর্ণ। অন্যদিকে, যদি লুটেটিয়াম ও লরেন্সিয়ামকে f-ব্লকে ধরা হয়, তাহলে f-শেলের পূর্ণতা বিন্যাসের শেষে ঘটে না, যা মৌলিক পর্যায়বৃত্ততার ধারণার সঙ্গে খাপ খায় না।[১৩৩] উল্লেখযোগ্যভাবে, ইলেকট্রন বিন্যাসের যেসব ব্যতিক্রমী রূপ কপার, প্যালেডিয়াম বা গোল্ডের মতো উপাদানে দেখা যায়, সেগুলোকেও d-ব্লক থেকে সরানো হয়নি। বরং Madelung নিয়ম অনুযায়ী d-ব্লকের পরিসমাপ্তি ধরা হয় জিঙ্ক, ক্যাডমিয়াম ও মারকিউরিতে—এবং এটাই সাধারণভাবে গৃহীত।[৩৩] মূল প্রশ্ন হলো কোন উপাদানগুলোর বহিস্থ f-অর্বিটাল রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করতে সক্ষম? ল্যান্থানাম ও অ্যাকটিনিয়াম—যেমন থোরিয়াম—প্রয়োজনে f-অর্বিটালে ইলেকট্রন রাখতে পারে। কিন্তু লুটেটিয়াম ও লরেন্সিয়ামের ক্ষেত্রে তা হয় না; তাদের f-অর্বিটাল অভ্যন্তরীণ স্তরে আটকে থাকে এবং রাসায়নিকভাবে নিষ্ক্রিয় থাকে।[১৩৪][১৩৫][১৩৬][১৩৭][১৩৮] এই দৃষ্টিকোণ থেকে দেখা যায়, ইট্রিয়াম ও ল্যান্থানামের সম্পর্ক শুধুই বাহ্যিক—দুজনের বহিস্থ ইলেকট্রনের সংখ্যা এক হলেও, তারা ভিন্ন অর্বিটাল ব্যবহার করে। এটি অনেকটা ক্রোমিয়াম ও ইউরেনিয়ামের সম্পর্কের মতো। কিন্তু ইট্রিয়াম ও লুটেটিয়ামের মধ্যে সম্পর্ক আরও গভীর—তারা শুধু ইলেকট্রন সংখ্যায় নয়, অর্বিটালের ধরনেও মিল রাখে। ফলে Sc–Y–Lu–Lr বিন্যাসকে বৈজ্ঞানিকভাবে বেশি সঙ্গত মনে করা হয়।[১৩৪]
Remove ads
পর্যায়বৃত্ত ধারা
সারাংশ
প্রসঙ্গ
রাসায়নিক বিক্রিয়াগুলিতে মূলত মৌলগুলির সর্ববহিঃস্থ ইলেকট্রন বা উপত্বকীয় ইলেকট্রন অংশ নেয়।[৩২] তাই যেসব মৌলের বাইরের ইলেকট্রন বিন্যাস একই রকম, তারা সাধারণত একধরনের রাসায়নিক আচরণ প্রদর্শন করে এবং একই অনুপাতে যৌগ গঠন করে।[১৩৯] এ ধরনের মৌলগুলিকে একই শ্রেণি বা গ্রুপে রাখা হয়। ফলে এক শ্রেণির উপর থেকে নিচে নামার সময় তাদের ধর্মে একটি নির্দিষ্ট ধারা বা প্রবণতা লক্ষ্য করা যায়।[১৪০] একই ধরনের ইলেকট্রন বিন্যাস নির্দিষ্ট ব্যবধানে পুনরাবৃত্ত হওয়ায় মৌলগুলির ধর্মেও একটি নিয়মিত পুনরাবৃত্তি দেখা যায়। এই ধারাবাহিক পুনরাবৃত্তির ভিত্তিতেই তৈরি হয়েছে পর্যায় সারণি ও পর্যায়বৃত্ত নিয়মের ধারণা। এই ধরনের বৈশিষ্ট্যপূর্ণ পুনরাবৃত্তি বৈজ্ঞানিক ব্যাখ্যা আবিষ্কারের আগেই পর্যবেক্ষণ করা হয়েছিল।[১৪১][১৪২]
পরমাণুর ব্যাসার্ধ
২০শ শতকের শুরুর আগে পর্যন্ত পরমাণুর প্রকৃত আকার সম্পর্কে বিজ্ঞানীদের স্পষ্ট ধারণা ছিল না। হাইড্রোজেন পরমাণুর ব্যাসার্ধ নিয়ে প্রথম গণনাকৃত অনুমান প্রকাশ করেন পদার্থবিজ্ঞানী আর্থার হাস ১৯১০ সালে। তিনি যে মানটি নির্ধারণ করেন, তা পরবর্তীতে গৃহীত মানের খুব কাছাকাছি ছিল — প্রায় একটি দশমিক গুণের মধ্যে। এই গৃহীত মানই হলো বোহার ব্যাসার্ধ, যা প্রায় ০.৫২৯ অ্যাংস্ট্রম। হাস তার মডেলে একটিমাত্র ইলেকট্রন বিশিষ্ট পরমাণু গঠনের ধারণা ব্যবহার করেন। এই মডেলটি ভিত্তি করে গড়ে তোলা হয়েছিল জে. জে. থমসন-এর ১৯০৪ সালের ধ্রুপদী পরমাণু তত্ত্বের ওপর, যা সাধারণভাবে "প্লাম-পুডিং মডেল" নামে পরিচিত।[১৪৩]
পরমাণুর ব্যাসার্ধ (অর্থাৎ পরমাণুর আকার) নির্ভর করে তাদের সর্ববহিঃস্থ অরবিটালের আকারের উপর।[১৪৪] মূল-গোষ্ঠীর (main-group) মৌলগুলির ক্ষেত্রে, বাম থেকে ডানে অগ্রসর হওয়ার সময় সাধারণত পরমাণুর ব্যাসার্ধ কমে যায়। এর কারণ হল নিউক্লিয়ার চার্জ বা কেন্দ্রস্থ নিউক্লিয়াসের আধান বাড়ে, কিন্তু বাইরের ইলেকট্রনগুলি একই শেলে (shell) থাকে। ফলে ইলেকট্রনগুলি নিউক্লিয়াসের দিকে আরও দৃঢ়ভাবে আকর্ষিত হয়। অন্যদিকে, কোনো নির্দিষ্ট কলামে উপর থেকে নিচে নামলে ব্যাসার্ধ সাধারণত বাড়ে। কারণ বাইরের ইলেকট্রনগুলি তখন উচ্চতর শেলে অবস্থান করে, যেগুলো নিউক্লিয়াস থেকে দূরে থাকে।[১৪৫][১৪৬] প্রত্যেকটি ব্লকের প্রথম সারির মৌলগুলি তুলনামূলকভাবে অস্বাভাবিকভাবে ছোট হয়। এই ব্যতিক্রমী বৈশিষ্ট্যকে বলা হয় *kainosymmetry* বা *primogenic repulsion*।[১৪৭] এর কারণ, ১s, ২p, ৩d এবং ৪f সাবশেলগুলির ভেতরে কোনো অনুরূপ সাবশেল নেই। উদাহরণস্বরূপ, ২p অরবিটালগুলিতে ১s ও ২s অরবিটালের থেকে তেমন প্রতিকর্ষণ (repulsion) হয় না, কারণ এদের কৌণিক আধান বিতরণ (angular charge distribution) ভিন্ন। ফলে এগুলির ব্যাসার্ধ বড় হয় না। কিন্তু ৩p অরবিটালগুলি ২p অরবিটালের সঙ্গে প্রভাবিত হয়, কারণ তাদের কৌণিক গঠন একরকম। এই কারণে উচ্চতর s-, p-, d- ও f-সাবশেলগুলি তাদের অভ্যন্তরীণ সমপ্রকৃতির অরবিটাল থেকে বেশি প্রতিকর্ষণ অনুভব করে এবং এই প্রতিকর্ষণ এড়াতে এদের প্রসারিত হতে হয়। এই পার্থক্য বিশেষভাবে লক্ষ্য করা যায় ছোট ২p মৌলগুলিতে, যেগুলি একাধিক বন্ধনে অংশ নিতে পারে। কিন্তু তুলনামূলকভাবে বড় ৩p ও তার পরবর্তী p-মৌলগুলি এমন বন্ধনে অংশ নেয় না।[১৪৪] অনুরূপ ব্যতিক্রম ১s, ২p, ৩d, ৪f এবং অনুমানভিত্তিক 5g মৌলগুলিতেও দেখা যায়।[১৪৮] এই প্রথম-সারি ব্যতিক্রম সবচেয়ে স্পষ্টভাবে দেখা যায় s-ব্লকে, অপেক্ষাকৃত কম দেখা যায় p-ব্লকে, এবং আরও কম d ও f-ব্লকে।[১৪৯]
স্থানান্তর মৌলগুলিতে ইলেকট্রন যুক্ত হয় মূলত একটি অভ্যন্তরীণ স্তরে, কিন্তু পরমাণুর আকার নির্ধারিত হয় বাইরের ইলেকট্রনগুলো দ্বারা। সিরিজ জুড়ে নিউক্লিয়ার চার্জ বাড়লেও, অভ্যন্তরীণ ইলেকট্রনগুলোর পর্দাকরণ (shielding) কিছুটা এর প্রভাব কমিয়ে দেয়। ফলে পরমাণুর ব্যাসার্ধে খুব একটা বড় পরিবর্তন দেখা যায় না—কমলেও তা তুলনামূলকভাবে সামান্য।[১৪৬] তবে কিছু ক্ষেত্রে ব্যতিক্রম ঘটে। যেমন, ৪p ও ৫d মৌলগুলির আকার প্রত্যাশার চেয়ে ছোট হয়।[১৫০] এর কারণ, ৩d ও ৪f সাবশেলগুলির পর্দাকরণ ক্ষমতা যথেষ্ট নয়, তাই বাইরের ইলেকট্রনগুলোর উপর নিউক্লিয়াসের আকর্ষণ অনেক বেশি থাকে। এই কারণে গ্যালিয়াম পরমাণুর আকার অ্যালুমিনিয়ামের চেয়েও একটু ছোট, যদিও গ্যালিয়াম নিচের পর্যায়ে রয়েছে।[১৪৪] এই বৈশিষ্ট্যগুলি kainosymmetry নামক একটি প্রভাবের সঙ্গে মিলে তৈরি করে একটি অতিরিক্ত ধারা, যাকে *দ্বিতীয় পর্যায়বৃত্তিতা* (secondary periodicity) বলা হয়। এতে জোড় ও বিজোড় সংখ্যক পর্যায়ের মধ্যে পার্থক্য দেখা যায় (s-ব্লক বাদে)।[ঠ] এই কারণে দেখা যায়, জোড় সংখ্যক পর্যায়ের মৌলগুলি তুলনামূলকভাবে ছোট আকারের হয় এবং সহজে ইলেকট্রন ত্যাগ করে না। অন্যদিকে, বিজোড় পর্যায়ের মৌলগুলি অপেক্ষাকৃত বড় হয় এবং তারা তুলনামূলকভাবে বেশি ইলেকট্রন ত্যাগ করে। এর ফলে p-ব্লকে অনেক ধর্মে একটি 'জিগজ্যাগ' ধারা দেখা যায়—যেখানে গোষ্ঠীর ভেতর মৌলগুলোর আচরণ মসৃণভাবে পরিবর্তিত না হয়ে উঠানামা করে। উদাহরণস্বরূপ, ১৫ নম্বর গোষ্ঠীতে বিজোড় পর্যায়ের ফসফরাস ও অ্যান্টিমনি সহজেই +৫ জারণ অবস্থায় পৌঁছাতে পারে, কিন্তু জোড় পর্যায়ের নাইট্রোজেন, আর্সেনিক ও বিসমাথ সাধারণত +৩ অবস্থায় থাকে।[১১৭][১৫১] d-ব্লকেও অনুরূপ প্রবণতা দেখা যায়। যেমন, লুটেশিয়াম থেকে টাংস্টেন পর্যন্ত মৌলগুলির আকার ইট্রিয়াম থেকে মলিবডেনাম পর্যন্ত মৌলগুলির তুলনায় সামান্য ছোট।[১৫২][১৫৩]

থ্যালিয়াম ও সীসার পরমাণুর আকার যথাক্রমে ইন্ডিয়াম ও টিনের পরমাণুর কাছাকাছি। কিন্তু বিসমাথ থেকে রেডন পর্যন্ত ৬p মৌলগুলির আকার তাদের ৫p সদৃশদের তুলনায় বড়। এর কারণ নিউক্লিয়াসের উচ্চ আধান—যা ইলেকট্রন মেঘের উপর অনেক বেশি প্রভাব ফেলে। এই অবস্থায় পরমাণুর আচরণ বুঝতে বিশেষ আপেক্ষিকতাবাদ অনুযায়ী বিশ্লেষণ করতে হয়। এই ধরনের আপেক্ষিকতাবাদী প্রভাব ভারী মৌলগুলিকে হালকা সদৃশদের তুলনায় ভিন্ন আচরণ করতে বাধ্য করে। এক্ষেত্রে স্পিন–অরবিট অন্তঃক্রিয়া p-সাবশেলকে দুটি ভাগে ভাগ করে ফেলে—একটি অরবিটাল সংকুচিত ও স্থিতিশীল (যা থ্যালিয়াম ও সীসাতে পূর্ণ হয়), অন্য দুটি প্রসারিত ও অপেক্ষাকৃত অস্থিতিশীল (যা বিসমাথ থেকে রেডনে পূর্ণ হয়)।[১৪৪] এই আপেক্ষিকতাবাদী প্রভাবই ব্যাখ্যা করে কেন সোনা সোনালি রঙের এবং কেন পারদ ঘর তাপমাত্রাতেই তরল অবস্থায় থাকে।[১৫৪][১৫৫] বিশেষজ্ঞদের ধারণা, সপ্তম পর্যায়ের শেষদিকে এই প্রভাব এতটাই প্রবল হবে যে, তা মৌলগুলোর স্বাভাবিক পর্যায়বৃত্ত ধর্ম ভেঙে দিতে পারে।[১৫৬] এখন পর্যন্ত কেবল ১০৮ নম্বর মৌল (হ্যাসিয়াম) পর্যন্ত ইলেকট্রন বিন্যাস নির্ভরযোগ্যভাবে জানা গেছে। ১০৮-এর পর ১১২ (কপারনিসিয়াম) থেকে ১১৫ (মস্কোভিয়াম) পর্যন্ত কিছু মৌলের ওপর সীমিত পরীক্ষামূলক গবেষণা হয়েছে। এই কারণেই সবচেয়ে ভারী মৌলগুলোর রাসায়নিক ধর্ম এখনো গবেষণার গুরুত্বপূর্ণ ক্ষেত্র হিসেবে রয়ে গেছে।[১৫৭][১৫৮]
যেভাবে পরমাণুর ব্যাসার্ধ বাম থেকে ডানে গেলে সাধারণত কমে, একই প্রবণতা আয়নিক ব্যাসার্ধেও দেখা যায়। তবে আয়নগুলির ক্ষেত্রে বিষয়টি বিশ্লেষণ করা একটু কঠিন, কারণ ধারাবাহিক মৌলগুলির সবচেয়ে সাধারণ আয়নগুলির আধান প্রায়শই ভিন্ন হয়। যেসব আয়নের ইলেকট্রন সংখ্যা এক হলেও পরমাণু সংখ্যা আলাদা, তাদের মধ্যে পরমাণু সংখ্যার বৃদ্ধির সঙ্গে সঙ্গে নিউক্লিয়াসের ধনাত্মক আধানও বাড়ে। ফলে বাইরের ইলেকট্রনগুলো নিউক্লিয়াসের দিকে আরও বেশি আকর্ষিত হয় এবং আয়নের আকার ছোট হয়ে আসে। যেমন: Se²⁻, Br⁻, Rb⁺, Sr²⁺, Y³⁺, Zr⁴⁺, Nb⁵⁺, Mo⁶⁺, Tc⁷⁺ — এই ধারাবাহিকতায় আয়নের আকার ধীরে ধীরে কমতে থাকে। একই মৌলের বিভিন্ন আয়নের মধ্যেও একই রকম প্রবণতা দেখা যায়। যত বেশি ইলেকট্রন সরিয়ে ফেলা হয়, নিউক্লিয়াসের আকর্ষণ তত তুলনামূলকভাবে শক্তিশালী হয় এবং ইলেকট্রনের পারস্পরিক বিকর্ষণ কমে যায়। ফলে আয়নের আকার ছোট হয়। উদাহরণস্বরূপ: V²⁺ → V³⁺ → V⁴⁺ → V⁵⁺ ধারায় প্রতিটি ধাপে ভ্যানেডিয়াম আয়নের ব্যাসার্ধ আরও কমে যায়।[১৫৯]
আয়নীকরণ শক্তি

কোনো পরমাণু থেকে একটি ইলেকট্রন সরাতে যে পরিমাণ শক্তি লাগে, তাকে বলা হয় প্রথম আয়নীকরণ শক্তি। এই শক্তি মূলত পরমাণুর আকার বা ব্যাসার্ধের ওপর নির্ভর করে। সাধারণভাবে দেখা যায়, বাম থেকে ডানে এবং নিচ থেকে ওপরে গেলে আয়নীকরণ শক্তি বাড়ে। কারণ, ইলেকট্রন যত নিউক্লিয়াসের কাছাকাছি থাকে, তত বেশি শক্তভাবে আকৃষ্ট হয়, ফলে তা সরানো কঠিন হয়। এই কারণে প্রতিটি পর্যায়ের শুরুতে – যেমন হাইড্রোজেন ও ক্ষার ধাতুগুলোতে – আয়নীকরণ শক্তি সবচেয়ে কম থাকে। এরপর ধীরে ধীরে তা বাড়ে এবং এক পর্যায়ে ডান প্রান্তে থাকা নোবেল গ্যাসগুলোতে সর্বোচ্চ হয়।[৩২] তবে এই সাধারণ প্রবণতার কিছু ব্যতিক্রমও রয়েছে। যেমন অক্সিজেন-এর ক্ষেত্রে, যে ইলেকট্রনটি সরানো হচ্ছে তা একটি জোড়ার অংশ। এই ইলেকট্রনজোড়ায় পারস্পরিক বিকর্ষণের কারণে ইলেকট্রনটি তুলনামূলকভাবে সহজেই সরানো যায়, যা প্রত্যাশার তুলনায় আয়নীকরণ শক্তিকে কমিয়ে দেয়।[১৬০]
পরিবর্তন ধাতুদের (transition metals) ক্ষেত্রে দেখা যায়, অভ্যন্তরীণ অরবিটালগুলো পূর্ণ হলেও রাসায়নিক বিক্রিয়ায় বাইরের ইলেকট্রনগুলোই আগে অপসারিত হয়। যেমন, ৩d সিরিজে ৩d অরবিটাল পূরণ হলেও প্রথমে ৪s ইলেকট্রন হারায়। এর কারণ হলো, প্রতিটি নতুন ৩d ইলেকট্রন নিউক্লিয়াসের আকর্ষণ কিছুটা কমিয়ে দেয়, অর্থাৎ শিল্ডিং প্রভাব সৃষ্টি করে। এই শিল্ডিং প্রভাব নিউক্লিয়ার চার্জের বৃদ্ধিকে অনেকাংশে ভারসাম্য দেয়, ফলে আয়নীকরণ শক্তি পুরো সিরিজ জুড়ে প্রায় স্থির থাকে। যদিও সিরিজের শেষদিকে এটি কিছুটা বাড়ে।[১৬১]
ধাতব পরমাণুগুলো সাধারণত রাসায়নিক বিক্রিয়ায় ইলেকট্রন হারায়, তাই আয়নীকরণ শক্তির সঙ্গে তাদের রাসায়নিক প্রতিক্রিয়াশীলতার ঘনিষ্ঠ সম্পর্ক রয়েছে। যদিও এই সম্পর্কের পেছনে আরও কিছু অন্যান্য কারণও কাজ করে।[১৬১]
ইলেকট্রন আসক্তি

আয়নীকরণ শক্তির বিপরীত ধর্ম হলো ইলেকট্রন আসক্তি। এই ধর্মটি মূলত কোনো পরমাণুতে একটি ইলেকট্রন যোগ করার সময় যে শক্তি নির্গত হয় তাকেই নির্দেশ করে। পরমাণুর নিউক্লিয়াসের আকর্ষণ যত বেশি, ইলেকট্রনকে তত বেশি টান অনুভব করবে। বিশেষ করে যদি পরমাণুর কক্ষপথে আংশিক পূর্ণ শক্তিস্তর থাকে যেখানে ইলেকট্রনটি যুক্ত হতে পারে, তখন ইলেকট্রন আসক্তি বৃদ্ধি পায়। তাই, পর্যায় সারণির উপর থেকে নিচের দিকে এবং বাম থেকে ডান দিকে ইলেকট্রন আসক্তি বাড়তে থাকে। ব্যতিক্রম শুধু গ্রুপ ১৮-এর নিষ্ক্রিয় গ্যাসগুলো। এদের শেষ কক্ষপথ সম্পূর্ণ পূর্ণ হওয়ায় নতুন ইলেকট্রন ধারণের স্থান নেই। ফলশ্রুতিতে, পর্যায় সারণির গ্রুপ ১৭-এর হ্যালোজেনসমূহ সর্বোচ্চ ইলেকট্রন আসক্তি প্রদর্শন করে।
নিষ্ক্রিয় গ্যাসের মতো কিছু পরমাণুর শূন্য ইলেকট্রন আসক্তি থাকে; তারা স্থিতিশীল গ্যাস-দশার অ্যানায়ন (ঋণাত্মক আয়ন) গঠন করে না। নিষ্ক্রিয় গ্যাসের আয়নীকরণ শক্তি উচ্চ এবং ইলেকট্রন আসক্তি নেই, সেজন্য এরা ইলেকট্রন গ্রহণ বা বর্জন করতে আগ্রহী হয় না, ফলে সাধারণত নিষ্ক্রিয় থাকে।
তবে কিছু ব্যতিক্রমও আছে: অক্সিজেন ও ফ্লোরিনের ইলেকট্রন আসক্তি তাদের পরের মৌল সালফার ও ক্লোরিনের চেয়ে কম। এর কারণ অক্সিজেন ও ফ্লোরিন খুবই ক্ষুদ্র পরমাণু; নতুন ইলেকট্রন আসলে আগে থেকে বর্তমান ইলেকট্রনগুলোর বিকর্ষণের মুখে পড়ে। অধাতব মৌলের ইলেকট্রন আসক্তি রাসায়নিক সক্রিয়তার সাথে কিছুটা সম্পর্কিত, তবে পুরোপুরি নয়। অন্যান্য কিছু কারণও জড়িত থাকে। যেমন, ফ্লোরিনের ইলেকট্রন আসক্তি ক্লোরিনের চেয়ে কম (ক্ষুদ্র আকারের কারণে বিকর্ষণ), তবে ফ্লোরিন ক্লোরিনের তুলনায় বেশি সক্রিয়।
যোজনী ও জারণ অবস্থা
সীসার দুটি স্থিতিশীল অক্সাইড হল সীসা(II) অক্সাইড (PbO, বামদিকে) এবং সীসা(IV) অক্সাইড (PbO2, ডানদিকে)।
কোনো মৌলের একটি পরমাণুর সাথে যতটি হাইড্রোজেন পরমাণু যুক্ত হয়ে সরল বাইনারি হাইড্রাইড গঠন করতে পারে, সেই সংখ্যাই ঐ মৌলটির যোজনী। এভাবে, কোনো মৌলের একটি পরমাণুর সাথে যতটি অক্সিজেন পরমাণু যুক্ত হয়ে সরল বাইনারি অক্সাইড (পারঅক্সাইড বা সুপারঅক্সাইড নয়) তৈরি করতে পারে, তার দ্বিগুণ সংখ্যাকেও ওই মৌলের যোজনী হিসেবে সংজ্ঞায়িত করা হয়। মূল-গ্রুপের মৌলগুলোর যোজনী সরাসরি গ্রুপ নম্বরের সাথে সম্পর্কিত। ১ম থেকে ২য় এবং ১৩শ থেকে ১৭শ গ্রুপের মৌলগুলোর হাইড্রাইডগুলোর সাধারণ সংকেত যথাক্রমে MH, MH2, MH3, MH4, MH3, MH2, এবং MH। অন্যদিকে, সর্বোচ্চ অক্সাইডগুলোর যোজনী বাড়তে থাকে এবং M2O, MO, M2O3, MO2, M2O5, MO3, M2O7 সংকেতগুলো মেনে চলে।
যোজনীর ধারণাটিকে আজকাল জারণ অবস্থার ধারণায় সম্প্রসারিত করা হয়েছে। কোনো যৌগ থেকে অন্য সকল মৌলকে আয়ন হিসেবে অপসারণ করলে যে আনুষ্ঠানিক (ফর্মাল) চার্জ অবশিষ্ট থাকে, সেটিই হলো ওই যৌগে ঐ মৌলের জারণ অবস্থা। ইলেকট্রন বিন্যাস যোজনীর একটি সহজ ব্যাখ্যা দেয়। ইলেকট্রন বিন্যাস থেকে যোজ্যতা ইলেকট্রনের সংখ্যা জানা যায়, যা বন্ধন গঠনে কাজে লাগে। পর্যায় সারণির ১ম গ্রুপের যোজ্যতা ইলেকট্রন ১ থেকে শুরু হয়ে ডান দিকে বাড়তে থাকে এবং প্রতিটি নতুন ব্লকের শুরুতে তা পুনরায় ৩ এ সেট হয়ে যায়। এভাবে, ষষ্ঠ পর্যায়ে Cs-Ba এর যোজ্যতা ইলেকট্রন ১-২টি, La-Yb এর ৩-১৬টি, Lu-Hg এর ৩-১২টি, এবং Tl-Rn এর ৩-৮টি। তবে, d -ব্লক ও f-ব্লকের ডান দিকে সকল যোজ্যতা ইলেকট্রন বন্ধনে ব্যবহারের সর্বোচ্চ তাত্ত্বিক সীমায় পৌঁছানো যায় না। অক্সিজেন, ফ্লোরিন এবং ক্রিপ্টন পর্যন্ত হালকা নিষ্ক্রিয় গ্যাসগুলোর ক্ষেত্রেও এটিই সত্য।
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H 1 |
He 2 | ||||||||||||||||||||||||||||||
| 2 | Li 1 |
Be 2 |
B 3 |
C 4 |
N 5 |
O 6 |
F 7 |
Ne 8 | ||||||||||||||||||||||||
| 3 | Na 1 |
Mg 2 |
Al 3 |
Si 4 |
P 5 |
S 6 |
Cl 7 |
Ar 8 | ||||||||||||||||||||||||
| 4 | K 1 |
Ca 2 |
Sc 3 |
Ti 4 |
V 5 |
Cr 6 |
Mn 7 |
Fe 8 |
Co 9 |
Ni 10 |
Cu 11 |
Zn 12 |
Ga 3 |
Ge 4 |
As 5 |
Se 6 |
Br 7 |
Kr 8 | ||||||||||||||
| 5 | Rb 1 |
Sr 2 |
Y 3 |
Zr 4 |
Nb 5 |
Mo 6 |
Tc 7 |
Ru 8 |
Rh 9 |
Pd 10 |
Ag 11 |
Cd 12 |
In 3 |
Sn 4 |
Sb 5 |
Te 6 |
I 7 |
Xe 8 | ||||||||||||||
| 6 | Cs 1 |
Ba 2 |
La 3 |
Ce 4 |
Pr 5 |
Nd 6 |
Pm 7 |
Sm 8 |
Eu 9 |
Gd 10 |
Tb 11 |
Dy 12 |
Ho 13 |
Er 14 |
Tm 15 |
Yb 16 |
Lu 3 |
Hf 4 |
Ta 5 |
W 6 |
Re 7 |
Os 8 |
Ir 9 |
Pt 10 |
Au 11 |
Hg 12 |
Tl 3 |
Pb 4 |
Bi 5 |
Po 6 |
At 7 |
Rn 8 |
| 7 | Fr 1 |
Ra 2 |
Ac 3 |
Th 4 |
Pa 5 |
U 6 |
Np 7 |
Pu 8 |
Am 9 |
Cm 10 |
Bk 11 |
Cf 12 |
Es 13 |
Fm 14 |
Md 15 |
No 16 |
Lr 3 |
Rf 4 |
Db 5 |
Sg 6 |
Bh 7 |
Hs 8 |
Mt 9 |
Ds 10 |
Rg 11 |
Cn 12 |
Nh 3 |
Fl 4 |
Mc 5 |
Lv 6 |
Ts 7 |
Og 8 |
শুধুমাত্র ইলেকট্রন বিন্যাসের উপর নির্ভর না করে, কোন মৌল ভিন্ন যোজনীতে যৌগ তৈরি করে তা ব্যাখ্যার সময় সেই যৌগ গঠনের ফলে যে শক্তির নির্গমন হয় তা বিবেচনায় নেওয়া প্রয়োজন। উদাহরণস্বরূপ, ম্যাগনেসিয়াম পানিতে দ্রবীভূত হলে Mg+ এর চেয়ে Mg2+ ক্যাটায়ন তৈরি করে, কারণ Mg+ স্বতঃস্ফূর্তভাবে Mg0 এবং Mg2+ ক্যাটায়নে পরিণত হতে চায়। এই ঘটনার কারণ হল, আয়নের চার্জ এবং ব্যাসার্ধের সাথে হাইড্রেশন এনথালপি (পানির অণু দ্বারা আয়নকে ঘিরে রাখা) বাড়তে থাকে। Mg+ আয়নে, বহিঃস্থ কক্ষপথটি (যা আয়নিক ব্যাসার্ধ নির্ধারণ করে) হল 3s, তাই হাইড্রেশন এনথালপি ছোট এবং একটি ইলেকট্রন অপসারণের জন্য প্রয়োজনীয় শক্তিকে ক্ষতিপূরণের জন্য অপর্যাপ্ত; তবে পুনরায় Mg2+ এ আয়নিত হলে ভেতরের 2p উপকক্ষটি প্রকাশিত হয়, ফলে হাইড্রেশন এনথালপি যথেষ্ট বড় হয় যা ম্যাগনেসিয়াম(II) যৌগ গঠনে সহায়তা করে। একই কারণে, ভারী p-ব্লক মৌলগুলির সাধারণ জারণ অবস্থাও (যেখানে ns ইলেকট্রনগুলি np এর চেয়ে শক্তিতে নিম্নগামী হয়) ২ পরপর বৃদ্ধি পেতে থাকে। এর কারণ হল একটি অভ্যন্তরীণ উপকক্ষ প্রকাশ এবং আয়নিক ব্যাসার্ধ হ্রাসের জন্য দুটি ইলেকট্রন অপসারণ করা প্রয়োজন (উদাহরণস্বরূপ, Tl+ 6s প্রকাশ করে, এবং Tl3+ 5d প্রকাশ করে, তাই থ্যালিয়াম একবার দুটি ইলেকট্রন হারালে এটি তৃতীয়টিও হারাতে চায়)। কম তড়িৎ ঋণাত্মক p-ব্লক মৌলগুলির জন্য কক্ষপথ সংকরণের উপর ভিত্তি করে অনুরূপ যুক্তি ব্যবহার করা যেতে পারে।

ট্রানজিশন ধাতুগুলোর (অবস্থান্তর/পরিবর্তনশীল মৌল) সাধারণ অক্সিডেশন অবস্থা (জারণ অবস্থা) প্রায় সবসময়ই +2 বা তার অধিক হয়, এর কারণ অনুরূপ (পরবর্তী সাবশেল উন্মোচিত করা)। এই প্রবণতা এমনকি ব্যতিক্রমী dx+1s1 বা dx+2s0 কনফিগারেশনযুক্ত ধাতুগুলির জন্যেও প্রযোজ্য (রুপা বাদে), কারণ d-ইলেকট্রনগুলির মধ্যকার বিকর্ষণের ফলে s- থেকে d-সাবশেলের দ্বিতীয় ইলেকট্রনের স্থানান্তর আয়নীকরণ শক্তিকে উল্লেখযোগ্যভাবে পরিবর্তন করে না। যেহেতু ট্রানজিশন ধাতুগুলিকে আরও আয়নিত করা কোনও নতুন অভ্যন্তরীণ সাবশেল প্রকাশ করে না, তাই তাদের অক্সিডেশন অবস্থা ক্রমান্বয়ে ১ ধাপ করে পরিবর্তিত হতে থাকে। ল্যান্থানাইড এবং শেষের দিকের অ্যাক্টিনাইডগুলি সাধারণত একটি স্থিতিশীল +3 অক্সিডেশন অবস্থা দেখায়, বাইরের s-ইলেকট্রনগুলি অপসারণ করে এবং তারপরে (সাধারণত) (n-2)f-অরবিটাল থেকে একটি ইলেকট্রন অপসারিত হয়, যেগুলো ns এর সাথে শক্তিতে অনুরূপ। d- এবং f-ব্লক উপাদানগুলির সাধারণ এবং সর্বাধিক অক্সিডেশন অবস্থা আয়নীকরণ শক্তির উপর নির্ভর করে। প্রতিটি ট্রানজিশন সিরিজের মধ্যে (n−1)d এবং ns অরবিটালগুলির মধ্যে শক্তির পার্থক্য বাড়ার সাথে সাথে, আরও ইলেকট্রনকে আয়নিত করা শক্তিগতভাবে কম অনুকূল হয়ে পড়ে। সুতরাং, প্রাথমিক ট্রানজিশন ধাতব গ্রুপগুলি উচ্চতর অক্সিডেশন অবস্থা পছন্দ করে, তবে +2 অক্সিডেশন অবস্থা পরবর্তী ট্রানজিশন ধাতব গ্রুপগুলির জন্য আরও স্থিতিশীল হয়ে ওঠে। সর্বোচ্চ আনুষ্ঠানিক অক্সিডেশন অবস্থা এইভাবে প্রতিটি d-ব্লক সারির শুরুতে +3 থেকে বৃদ্ধি পায়, মাঝখানে +7 বা +8 এ পৌঁছায় (যেমন OsO4), এবং তারপর শেষে +2 এ নেমে যায়। ল্যান্থানাইড এবং শেষের দিকের অ্যাক্টিনাইডগুলির সাধারণত উচ্চ চতুর্থ আয়নীকরণ শক্তি থাকে এবং তাই খুব কমই +3 অক্সিডেশন অবস্থা ছাড়িয়ে যায়। অপরদিকে, প্রারম্ভিক অ্যাক্টিনাইডগুলির চতুর্থ আয়নীকরণ শক্তি কম থাকে এবং তাই উদাহরণস্বরূপ নেপচুনিয়াম এবং প্লুটোনিয়াম +7 এ পৌঁছাতে পারে। অনেক শেষের অ্যাক্টিনাইডগুলি ল্যান্থানাইডগুলির তুলনায় কম অক্সিডেশন অবস্থাকে প্রাধান্য দেয়: মেন্ডেলিভিয়াম থুলিয়াম বা এমনকি ইউরোপিয়ামের চেয়ে আরও সহজে +2 অবস্থায় হ্রাস পায় (অর্ধ-পূর্ণ f-শেলের কারণে সবচেয়ে স্থিতিশীল +2 অবস্থা সহ ল্যান্থানাইড), এবং নোবেলিয়াম আউটরাইট ভাবে ইটারবিয়ামের বিপরীতে +2 কে +3 এর চেয়ে অধিক প্রাধান্য দেয়।
যৌগের যেকোনো পরমাণুর সর্ববহিঃস্থ শক্তিস্তরের ইলেকট্রন বিন্যাসকে যোজনী কাঠামো বলে। পর্যায় সারণির একই গ্রুপের মৌলগুলোর যোজনী কাঠামো একই রকম হওয়ায় এরা সাধারণত একই ধরনের রাসায়নিক বৈশিষ্ট্য প্রদর্শন করে থাকে। উদাহরণস্বরূপ, প্রথম গ্রুপের ক্ষার ধাতুগুলোর সবার একটি করে যোজনী ইলেকট্রন আছে, যার ফলে এই মৌলগুলোর মধ্যে এক প্রকারের সমসত্ত্বতা দেখা যায়: এগুলো সবই নরম এবং উচ্চ বিক্রিয়াশীল ধাতু। যদিও এই বৈশিষ্ট্যের ক্ষেত্রে আরও অনেক বিষয় জড়িত, তাই কোনো গ্রুপের মধ্যেও প্রায়শই বৈচিত্র্য দেখা যেতে পারে। যেমন, হাইড্রোজেনেরও একটি যোজনী ইলেকট্রন আছে এবং এটি ক্ষার ধাতুগুলোর মতোই একই গ্রুপে অবস্থান করে, কিন্তু রাসায়নিক বৈশিষ্ট্যের দিক থেকে এটি সম্পূর্ণ ভিন্ন। আবার, গ্রুপ ১৪ এর স্থিতিশীল মৌলগুলোর মধ্যে রয়েছে একটি অধাতু (কার্বন), দুটি অর্ধপরিবাহী (সিলিকন ও জার্মেনিয়াম) এবং দুটি ধাতু (টিন ও সীসা)। তবুও এদের সবার চারটি করে যোজনী ইলেকট্রন থাকায় এদের মধ্যে এক ধরণের মিল রয়েছে। এর কারণে এদের সর্বোচ্চ এবং সর্বনিম্ন জারণ সংখ্যা প্রায় একই হয় (যেমন, গ্রুপ ১৬ এর সালফার এবং সেলেনিয়াম উভয়ের সর্বোচ্চ জারণ সংখ্যা +৬, যেমন SO3 এবং SeO3 যৌগে; আবার উভয়ের সর্বনিম্ন জারণ সংখ্যা -২, সালফাইড ও সেলেনাইডের ক্ষেত্রে)। তবে সবসময় একই বৈশিষ্ট্য নাও পাওয়া যেতে পারে (যেমন, অক্সিজেনকে সালফার বা সেলেনিয়ামের মতো +৬ জারণ অবস্থায় পাওয়া যায় না)।
তড়িৎ ঋণাত্মকতা

মৌলের আরেকটি গুরুত্বপূর্ণ বৈশিষ্ট্য হলো এদের তড়িৎ ঋণাত্মকতা। পরমাণুগুলো ইলেকট্রন যুগল শেয়ার করে সমযোজী বন্ধন তৈরি করতে পারে, এবং এর মাধ্যমে ভ্যালেন্স কক্ষপথগুলো পরস্পর অধিক্রমণ করে। শেয়ার করা ইলেকট্রন যুগলকে কোন পরমাণু কতটা আকর্ষণ করবে তা নির্ভর করে তার তড়িৎ ঋণাত্মকতার উপর। তড়িৎ ঋণাত্মকতা হলো কোনো পরমাণুর ইলেকট্রন লাভ বা হারাবার প্রবণতা। যে পরমাণু বেশি তড়িৎ ঋণাত্মক সেটি শেয়ারকৃত ইলেকট্রন যুগলকে নিজের দিকে বেশি আকর্ষণ করবে। আর যে পরমাণু যত কম তড়িৎ ঋণাত্মক (বা বেশি তড়িৎ ধনাত্মক), সে ইলেক্ট্রনকে তত কম আকর্ষণ করবে। চরম ক্ষেত্রে, এটা ধরে নেওয়া যায় যে, ইলেকট্রনটি আরো তড়িৎ ধনাত্মক পরমাণু থেকে সম্পূর্ণরূপে তড়িৎ ঋণাত্মক পরমাণুতে স্থানান্তরিত হয়েছে, যদিও এটি একটি সরলীকৃত ব্যাখ্যা। বন্ধনটি তখন দুটি আয়নকে সংযুক্ত করে, একটি ধনাত্মক (ইলেকট্রন ত্যাগের মাধ্যমে) এবং একটি ঋণাত্মক (ইলেকট্রন গ্রহণ এর মাধ্যমে), এবং এটিকে আয়নিক বন্ধন বলা হয়।
তড়িৎ ঋণাত্মকতা নির্ভর করে নিউক্লিয়াস কতটা শক্তিশালীভাবে একটি ইলেকট্রন যুগলকে আকর্ষণ করতে পারে তার উপর। তাই তড়িৎ ঋণাত্মকতা অন্যান্য বৈশিষ্ট্যের মতোই একই ধরণের তারতম্য প্রদর্শন করে: নিচ থেকে উপরের দিকে গেলে তড়িৎ ঋণাত্মকতা হ্রাস পায় এবং বাম থেকে ডানে গেলে তা বৃদ্ধি পায়। ক্ষার ও ক্ষারীয় মৃত্তিকা ধাতুগুলি সবচেয়ে তড়িৎ ধনাত্মক মৌলগুলির মধ্যে, যখন চ্যালকোজেন, হ্যালোজেন এবং নিষ্ক্রিয় গ্যাসগুলি সবচেয়ে তড়িৎ ঋণাত্মক।
তড়িৎ ঋণাত্মকতা সাধারণত পাউলিং স্কেলে পরিমাপ করা হয়, যেখানে সবচেয়ে তড়িৎ ঋণাত্মক মৌল (ফ্লোরিন) কে 4.0 তড়িৎ ঋণাত্মকতা দেওয়া হয়, এবং সবচেয়ে কম তড়িৎ ঋণাত্মক মৌল (সিজিয়াম) কে দেওয়া হয় 0.79 তড়িৎ ঋণাত্মকতা। আসলে নিয়ন হল সবচেয়ে তড়িৎ ঋণাত্মক মৌল, কিন্তু পাউলিং স্কেল এর তড়িৎ ঋণাত্মকতা পরিমাপ করতে পারে না কারণ এটি বেশিরভাগ মৌলের সাথে সমযোজী বন্ধন তৈরি করে না।
একটি মৌলের তড়িৎ ঋণাত্মকতা এর যোজ্যতা অবস্থা এবং কয়টি পরমাণুর সাথে এটি যুক্ত তার উপর নির্ভর করে। এছাড়াও এটা নির্ভর করে এর ইতোমধ্যে কতগুলো ইলেকট্রন হারিয়েছে তার উপরও। একটি পরমাণু যত বেশি ইলেকট্রন হারায়, ততই বেশি তড়িৎ ঋণাত্মক হয়ে ওঠে। এটি কখনও কখনও একটি বড় পার্থক্য তৈরি করে: পাউলিং স্কেলে +2 যোজ্যতা অবস্থায় সীসার (লেড) তড়িৎ ঋণাত্মকতা 1.87, কিন্তু +4 যোজ্যতা অবস্থায় সীসার তড়িৎ ঋণাত্মকতা 2.33।
ধাতবতা (Metallicity)
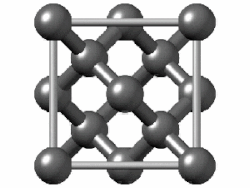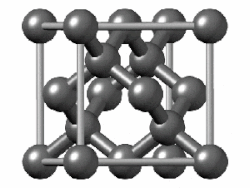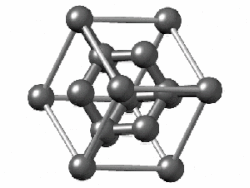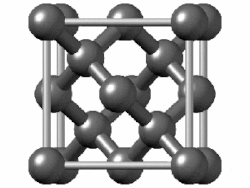
একক উপাদান বা মৌল দিয়ে গঠিত পদার্থকে সাধারণ পদার্থ বলা হয়। তুলনামূলকভাবে বেশি তড়িৎঋণাত্মক (electronegative) মৌলের পরমাণুগুলো নিজেদের মধ্যে ইলেকট্রন শেয়ার করে সমযোজী বন্ধন তৈরি করে। এরা হয় ছোট অণু (যেমন হাইড্রোজেন বা অক্সিজেন যাদের পরমাণু জোড়ায় জোড়ায় বন্ধন তৈরি করে) নয়তো অনির্দিষ্টভাবে বিস্তৃত কাঠামো (যেমন কার্বন বা সিলিকন) তৈরি করে। নিষ্ক্রিয় গ্যাসগুলো একক পরমাণু হিসেবেই অবস্থান করে কারণ তাদের ইতোমধ্যে শেষ কক্ষপথটি ইলেকট্রন দিয়ে পূর্ণ। অণু বা একক পরমাণু দিয়ে গঠিত পদার্থগুলো অণুগুলোর মধ্যেকার তুলনামূলক দুর্বল আকর্ষণ বল দ্বারা সংযুক্ত থাকে। যেমন লন্ডন ডিসপারশন বল (London Dispersion force) যেখানে অণুর মধ্যে ইলেকট্রন চলাচলের কারণে তাৎক্ষণিক তড়িৎ ভারসাম্যহীনতার সৃষ্টি হয়, যা আশেপাশের অণুতেও অনুরূপ ভারসাম্যহীনতা তৈরি করে এবং অনেকগুলো অণু জুড়ে ইলেকট্রনের সুসংগত চলাচল তৈরি করে।

অপরদিকে, তুলনামূলকভাবে বেশি তড়িৎধনাত্মক (electropositive) মৌলগুলো ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হয়, ফলে ইলেকট্রনের এক বিশাল সমুদ্র তৈরি হয়। এক্ষেত্রে, একটি পরমাণুর বাইরের অরবিটালগুলো আশেপাশের পরমাণুগুলোর সাথে অধিক্রমণ করে ইলেক্ট্রন ভাগাভাগি করে, যার ফলে বিশাল আকারের আণবিক অরবিটাল সৃষ্টি হয় যা সমস্ত পরমাণু জুড়ে বিস্তৃত থাকে। এই ঋণাত্মক চার্জযুক্ত "ইলেকট্রন সমুদ্র" সমস্ত আয়নকে আকর্ষণ করে ধাতব বন্ধনের মাধ্যমে একসাথে রাখে। এই ধরনের বন্ধন তৈরি করে যে মৌলগুলো রয়েছে সেগুলোকে প্রায়শই ধাতু বলা হয়; যেসব মৌল এই বন্ধন তৈরি করে না সেগুলোকে অধাতু বলা হয়। কিছু মৌল ভিন্ন কাঠামোবিশিষ্ট একাধিক সাধারণ পদার্থ তৈরি করতে পারে: এদেরকে অ্যালোট্রপ (allotropes) বলা হয়। উদাহরণস্বরূপ, হীরা এবং গ্রাফাইট হল কার্বনের দুটি অ্যালোট্রপ।
একটি মৌলের ধাতবতা তার ইলেকট্রনিক বৈশিষ্ট্য পর্যালোচনা করে অনুমান করা সম্ভব। যখন পারমাণবিক অরবিটালগুলো ধাতব বা সমযোজী বন্ধনের সময় পরস্পরের উপর অধিক্রমণ (overlap) করে, তখন সমান সংখ্যক যোজন (bonding) ও বিযোজন (antibonding) আণবিক অরবিটাল সৃষ্টি হয়। বিযোজন অরবিটালগুলোর শক্তি বেশি থাকে। বিযোজন অরবিটালের তুলনায় যোজন অরবিটালে যখন অধিক সংখ্যক ইলেকট্রন থাকে, তখন নীট যোজন (bonding) ধর্ম প্রকাশ পায়। যেসব মৌলের প্রতিটি পরমাণু থেকে বিচ্যুত ইলেকট্রনের সংখ্যা অধিক্রমণকারী অরবিটাল সংখ্যার দ্বিগুণের চেয়ে কম, সেগুলো সাধারণত ধাতব বন্ধনের মাধ্যমে ধাতুতে পরিণত হয়। মৌলিক সারণীর ১ম থেকে ১৩শ গ্রুপের মৌলগুলোর ক্ষেত্রে এমনটিই ঘটে। এছাড়া, এইসব মৌলের যোজ্যতা ইলেকট্রন সংখ্যা পরমাণুগুলোর সমতুল্য অবস্থান নিয়ে বিশাল সমযোজী কাঠামো গঠনের জন্য খুবই নগণ্য; তাই এরা প্রায় সবাই ধাতুতে পরিণত হয়। ব্যতিক্রম হলো হাইড্রোজেন ও বোরন। এদের আয়নীকরণ শক্তি অনেক বেশি। হাইড্রোজেন সমযোজী H2 অণু গঠন করে এবং বোরন আইকোসাহেড্রাল B12 গুচ্ছের উপর ভিত্তি করে একটি বিশাল সমযোজী কাঠামো গঠন করে। ধাতুর ক্ষেত্রে, যোজন এবং বিযোজন অরবিটালগুলোর শক্তি পরস্পর অধিক্রমণ করে। ফলে একটি পটি (band) তৈরি হয় যেখানে ইলেকট্রনগুলো অবাধে প্রবাহিত হতে পারে। এর ফলে তড়িৎ পরিবহন সম্ভব হয়।

গ্রুপ ১৪ এর মৌলগুলোতে আমরা ধাতব এবং সমযোজী উভয় ধরণের বন্ধন লক্ষ্য করি। হীরকের ক্ষেত্রে, কার্বন পরমাণুর মধ্যেকার সমযোজী বন্ধন অত্যন্ত শক্তিশালী। এর কারণ কার্বনের ছোট পরমাণবিক ব্যাসার্ধ, যার ফলে নিউক্লিয়াসের ইলেকট্রনগুলোর ওপর আকর্ষণ বেশি থাকে। এই কারণে সমযোজী বন্ধনে যে বন্ধন কক্ষপথের সৃষ্টি হয়, তার শক্তি বন্ধন-বিরোধী কক্ষপথের চেয়ে অনেক কম থাকে এবং এদের মধ্যে সমাপতন (overlap) থাকে না। ফলে তড়িৎ পরিবহন অসম্ভব হয়ে পড়ে - কার্বন অধাতু হিসেবে পরিচিতি পায়। তবে, বৃহত্তর পরমাণুর ক্ষেত্রে সমযোজী বন্ধন দুর্বল হয়ে যায় এবং বন্ধন ও বন্ধন-বিরোধী কক্ষপথের শক্তির পার্থক্য হ্রাস পায়। কক্ষপথগুলোর মধ্যেকার এই শক্তিগত ব্যবধানকে ব্যান্ড গ্যাপ বলা হয়। সিলিকন ও জার্মেনিয়ামের ব্যান্ড গ্যাপ কম থাকায়, সাধারণ পরিবেশে এগুলো অর্ধপরিবাহী হিসেবে কাজ করে। তাপ শক্তি পেলে ইলেকট্রন এই শক্তি ব্যবধান অতিক্রম করতে পারে। (বোরনও সাধারণ অবস্থায় অর্ধপরিবাহী।) টিনের ক্ষেত্রে ব্যান্ড গ্যাপ থাকে না, তাই টিন ও লেড ধাতুর মতো আচরণ করে। তাপমাত্রা বৃদ্ধি পেলে সকল অধাতুই কিছুটা অর্ধপরিবাহীর বৈশিষ্ট্য লাভ করে, এর মাত্রা নির্ভর করে ব্যান্ড গ্যাপের আকারের ওপর। এর মাধ্যমে ধাতু ও অধাতুকে পৃথক করা যায় – তাপমাত্রা বৃদ্ধিতে ধাতুর পরিবাহিতা কমে যায় (কারণ তাপীয় গতিশক্তি ইলেকট্রন প্রবাহকে বাধা দেয়), আর অধাতুর পরিবাহিতা বৃদ্ধি পায় (কেননা তখন আরও বেশি ইলেকট্রন ব্যান্ড গ্যাপ অতিক্রম করার সুযোগ পায়)।
গ্রুপ ১৫ থেকে ১৭ পর্যন্ত বিস্তৃত মৌলগুলিতে অনেক বেশি ইলেকট্রন থাকে। তাই এগুলো সুবৃহৎ সমযোজী অণু তৈরি করে না যেগুলো ত্রিমাত্রিকভাবে বিস্তৃত হতে পারে। হালকা মৌলের ক্ষেত্রে, ছোট দ্বি-পারমাণবিক অণুর মধ্যকার বন্ধন এতই শক্তিশালী যে, ঘনীভূত পদার্থ তৈরিতে বাঁধার সৃষ্টি করে। এই কারণে নাইট্রোজেন (N2), অক্সিজেন (O2), সাদা ফসফরাস ও হলুদ আর্সেনিক (P4 ও As4), সালফার ও লাল সেলেনিয়াম (S8 ও Se8), এবং স্থিতিশীল হ্যালোজেনসমূহ (F2, Cl2, Br2, ও I2) সহজেই কয়েকটি পরমাণু দিয়ে সমযোজী অণু গঠন করে। ভারী মৌলগুলো সাধারণত দীর্ঘ শৃঙ্খল (যেমন লাল ফসফরাস, ধূসর সেলেনিয়াম, টেলুরিয়াম) অথবা স্তরীভূত কাঠামো (যেমন গ্রাফাইট হিসেবে কার্বন, কালো ফসফরাস, ধূসর আর্সেনিক, অ্যান্টিমনি, বিসমাথ) তৈরি করে। এই কাঠামো এক বা দুই মাত্রার বদলে ত্রিমাত্রিকভাবে বিস্তৃত হয়। ফসফরাস, আর্সেনিক এবং সেলেনিয়াম – এই তিনটি মৌলের ক্ষেত্রেই উভয় ধরণের কাঠামো তথা বিন্যাস পাওয়া যায়। তবে দীর্ঘ শৃঙ্খলের বিন্যাসগুলি অধিকতর স্থিতিশীল। যেহেতু এই কাঠামোগুলি বন্ধন গঠনের জন্য সমস্ত কক্ষপথ ব্যবহার করে না, তাই ক্রমবর্ধমান শক্তির ভিত্তিতে এখানে বন্ধন, অ-বন্ধন, ও বন্ধন-বিরোধী ব্যান্ড তৈরি হয়। গ্রুপ ১৪ এর সাথে সামঞ্জস্য রেখে, ভারী মৌলগুলোর ক্ষেত্রে ব্যান্ড ফাঁক ছোট হয়ে যায় এবং শৃঙ্খল বা স্তরগুলির মধ্যে ইলেকট্রনের মুক্ত চলাচল সম্ভব হয়। উদাহরণস্বরূপ, কালো ফসফরাস, কালো আর্সেনিক, ধূসর সেলেনিয়াম, টেলুরিয়াম এবং আয়োডিন হলো অর্ধপরিবাহী। আবার ধূসর আর্সেনিক, অ্যান্টিমনি এবং বিসমাথ হলোধাতুকল্প (এরা প্রায়-ধাতব পরিবাহিতা প্রদর্শন করে, খুব সামান্য ব্যান্ডের ওভারল্যাপ সহ)। অবশেষে, পোলোনিয়াম এবং সম্ভবত অ্যাস্টাটিন হলো প্রকৃত ধাতু। অবশেষে, গ্রুপ ১৮ এর প্রাকৃতিক মৌলগুলি সবই পৃথক পরমাণু হিসেবে অবস্থান করে।
ধাতু এবং অধাতুর মধ্যে বিভাজন রেখাটি প্রায় তীর্যকভাবে উপরের বাম দিক থেকে নীচের ডানদিকে অবস্থিত। ধাতুসমূহ এই তীর্যক রেখার বামদিকে পরিদৃশ্যমান হয় (কারণ এদের অনেকগুলি মুক্ত অরবিটাল উপলব্ধ থাকে)। এটিই প্রত্যাশিত, কেননা ধাতব-চরিত্র বৈদ্যুতিক ধনাত্মকতা এবং ইলেকট্রন ত্যাগ করার প্রবণতার সাথে সম্পর্কিত, যা ডান থেকে বামে এবং উপর থেকে নীচের দিকে বৃদ্ধি পায়। সুতরাং, অধাতুর সংখ্যার তুলনায় ধাতুর সংখ্যা অনেক বেশি। বিভাজন রেখার কাছাকাছি অবস্থিত মৌলগুলিকে শ্রেণীবদ্ধ করা বেশ কঠিন হয়ে পড়ে। এগুলোর বৈশিষ্ট্যসমূহ ধাতু ও অধাতুর মধ্যবর্তী হতে থাকে; অনেক ক্ষেত্রে এদের উভয়ের কিছু নির্দিষ্ট বৈশিষ্ট্যও থাকতে পারে। এগুলোকে প্রায়শই "উপধাতু" বা "মেটালয়েড" বলা হয়। তবে, রসায়নবিদরা যে অর্থে "উপধাতু" শব্দটি ব্যবহার করেন, সেটি পদার্থবিজ্ঞানের কঠোর সংজ্ঞা থেকে আলাদা। উদাহরণস্বরূপ, বিসমাথকে পদার্থবিজ্ঞানের অর্থে একটি উপধাতু হিসেবে বিবেচনা করা হলেও, রসায়নবিদরা এটিকে একটি ধাতু হিসেবেই গ্রহণ করেন।
নিম্নলিখিত সারণিতে আদর্শ পরিস্থিতিতে সর্বাধিক স্থিতিশীল বরাদ্দ (allotrope) বিবেচনা করা হয়েছে। হলুদ রঙের উপাদানগুলি সাধারণ পদার্থ তৈরি করে যেগুলি ধাতব বন্ধন দ্বারা ভালভাবে চিহ্নিত হয়। হালকা নীল রঙের উপাদানগুলি বিশাল নেটওয়ার্কের সমযোজী কাঠামো তৈরি করে, যেখানে গাঢ় নীল রঙের উপাদানগুলি ছোট সমযোজীভাবে বন্ধিত অণু তৈরি করে যেগুলি দুর্বল ভ্যান ডার ওয়ালস বল দ্বারা একসাথে ধরে রাখা হয়। নিষ্ক্রিয় গ্যাসগুলো বেগুনি রঙে রঙিন: তাদের অণু হল একক পরমাণু এবং কোনও সমযোজী বন্ধন হয় না। ধূসর রঙের ঘরগুলি সেই উপাদানগুলির জন্য যেগুলি তাদের সর্বাধিক স্থিতিশীল অ্যালোট্রোপগুলিকে এইভাবে চিহ্নিত করার জন্য পর্যাপ্ত পরিমাণে প্রস্তুত করা হয়নি। তাত্ত্বিক বিবেচনা এবং বর্তমান পরীক্ষামূলক প্রমাণগুলি থেকে বোঝা যায় যে সমস্ত উপাদান ধাতব হবে যদি তারা ঘনীভূত পর্যায় গঠন করতে পারে, সম্ভবত অগনেসন ব্যতীত।
|
ধাতব নেটওয়ার্ক সমযোজী অণু সমযোজী একক পরমাণু অজানা মৌলিক পদার্থের ক্ষেত্রে পর্যায় সারণিতে পটভূমির রং (Background color) বন্ধন প্রকার নির্দেশ করে। যদি একাধিক রূপভেদ (allotrope) থাকে, তাহলে সবচেয়ে স্থিতিশীল রূপভেদ বিবেচনা করা হয়। |
- লোহা, একটি ধাতু
- সালফার, একটি অধাতু
- আর্সেনিক, একটি উপাদান যা প্রায়শই একটি অর্ধ-ধাতু বা মেটালয়েড নামে পরিচিত
সাধারণত, ধাতু চকচকে এবং ঘন হয়। ধাতব বন্ধনের শক্তির কারণে এদের সাধারণত গলনাঙ্ক এবং স্ফুটনাঙ্ক বেশি হয়। এছাড়া, ধাতব বন্ধন ভাঙার ঝুঁকি না নিয়ে পরমাণুগুলোর অবস্থান পরিবর্তন করা যায় বলে, ধাতুগুলোকে সাধারণত পিটিয়ে বা টেনে বিভিন্ন আকার দেওয়া যায় (নমনীয় ও নম্য)। ধাতুর ইলেকট্রনগুলো ত্রিমাত্রিকভাবে মুক্তভাবে চলাচল করতে পারে বলে এগুলো বিদ্যুৎ পরিবহন করে। অনুরূপভাবে, ধাতু তাপ পরিবহন করে, কারণ ইলেকট্রনগুলো অতিরিক্ত গতিশক্তি হিসেবে তাপকে স্থানান্তর করে; এরা আরও দ্রুত গতিতে চলাচল করে। এই বৈশিষ্ট্যগুলো গলিত অবস্থাতেও বজায় থাকে, কারণ গলনের সময় স্ফটিক কাঠামো নষ্ট হয়ে গেলেও পরমাণুগুলোর সংযোগ বিদ্যমান থাকে এবং ধাতব বন্ধন দুর্বল হলেও টিকে থাকে। ধাতুসমূহ অধাতুর সাথে বিক্রিয়াশীল হতে থাকে। এই সাধারণ বৈশিষ্ট্যগুলোর কিছু ব্যতিক্রম আছে: উদাহরণস্বরূপ, বেরিলিয়াম, ক্রোমিয়াম, ম্যাঙ্গানিজ, অ্যান্টিমনি, বিসমাথ এবং ইউরেনিয়াম ভঙ্গুর (এই তালিকা সব ধারণ করে না); ক্রোমিয়াম অত্যন্ত শক্ত; গ্যালিয়াম, রুবিডিয়াম, সিজিয়াম এবং পারদ কক্ষ তাপমাত্রায় বা তার কাছাকাছি অবস্থায় তরল থাকে; এবং সোনার মতো নিষ্ক্রিয় ধাতুগুলি রাসায়নিকভাবে নিষ্ক্রিয়।
অধাতব পদার্থগুলোর বৈচিত্র্যময় বৈশিষ্ট্য রয়েছে। যেসব অধাতু বিশাল সমযোজী স্ফটিক তৈরি করে তাদের গলনাঙ্ক এবং স্ফুটনাঙ্ক সাধারণত অনেক বেশি হয়। এর কারণ এই শক্তিশালী সমযোজী বন্ধন ভাঙতে উল্লেখযোগ্য পরিমাণ শক্তির প্রয়োজন হয়। অন্যদিকে, যেসব অধাতু বিচ্ছিন্ন অণু তৈরি করে সেগুলো মূলত বিচ্ছুরণ বল দ্বারা একত্রে আবদ্ধ থাকে। এই বলগুলি সহজেই কাটিয়ে ওঠা যায়। ফলে, এদের গলনাঙ্ক এবং স্ফুটনাঙ্ক তুলনামূলকভাবে কম হয় এবং কক্ষ তাপমাত্রায় এদের অনেকেই তরল বা গ্যাসীয় অবস্থায় থাকে। অধাতব পদার্থগুলো প্রায়শই নিষ্প্রভ দেখায়। নিষ্ক্রিয় গ্যাসগুলো বাদে, এরা ধাতুর সাথে বিক্রিয়াশীল হতে থাকে; নিষ্ক্রিয় গ্যাসগুলো অধিকাংশ পদার্থের সাথে নিষ্ক্রিয় থাকে। কঠিন অবস্থায় এরা ভঙ্গুর হয় কারণ এদের পরমাণুগুলো নিজেদের জায়গায় শক্তভাবে আবদ্ধ থাকে। এরা কম ঘনত্বের হয় এবং তড়িৎ পরিবহনও ভালোভাবে করে না কারণ এদের কোনো মুক্ত ইলেকট্রন থাকে না। সীমান্তবর্তী অঞ্চলে, ব্যান্ড ফাঁক ছোট থাকে এবং তাই সেই অঞ্চলের অনেক মৌলই যেমন সিলিকন, জার্মেনিয়াম এবং টেলুরিয়াম অর্ধপরিবাহী হয়। সেলেনিয়ামের একটি অর্ধপরিবাহী ধূসর বর্তন এবং একটি অন্তরক লাল বর্তন রয়েছে। আর্সেনিকের একটি ধাতব ধূসর বর্তন, একটি অর্ধপরিবাহী কালো বর্তন এবং একটি অন্তরক হলুদ বর্তন রয়েছে (যদিও পরিবেষ্টিত অবস্থায় শেষটি অস্থির থাকে)। এখানেও ব্যতিক্রম আছে; উদাহরণস্বরূপ, হীরার তাপ পরিবাহিতা যেকোনো ধাতুর চেয়ে সবচেয়ে বেশি।
ধাতব ও অধাতব পদার্থের সংযোগস্থলে থাকা কিছু মৌলিক পদার্থকে 'উপধাতু' হিসেবে গণ্য করা হয়। এই মৌলগুলো ধাতু ও অধাতুর ভৌত ও রাসায়নিক বৈশিষ্ট্যের মধ্যবর্তী বৈশিষ্ট্য প্রদর্শন করে। তবে উপধাতু হিসেবে কোন মৌলগুলোকে ঠিক স্থান দেওয়া উচিত সে ব্যাপারে বিজ্ঞানীদের মধ্যে সর্বসম্মত মত নেই। সিলিকন, জার্মেনিয়াম, আর্সেনিক, এবং টেলুরিয়াম মৌলগুলোকে প্রায়শই উপধাতু বলা হয়, এবং বোরন ও অ্যান্টিমনি'কেও অনেকসময় উপধাতু হিসেবে ধরা হয়। বেশিরভাগ তথ্যসূত্র অন্যান্য মৌলকেও এর অন্তর্ভূক্ত করে, তবে কোন মৌলগুলোকে যুক্ত করা বা বাদ দেওয়া উচিত সে ব্যাপারে ঐকমত্য নেই। যেমন, সাধারণত উপধাতু বা অধাতু হিসেবে গণ্য করা অন্যান্য মৌলগুলোর বিপরীতে, অ্যান্টিমনির একমাত্র স্থায়ী রূপ ধাতুর ন্যায় তড়িৎ পরিবাহী। উপরন্তু, এই মৌলটি তার ভৌত ও রাসায়নিক আচরণে বিসমাথ এবং অন্যান্য পি-ব্লক মৌল সমূহের অনুরূপ। এই ভিত্তিতে, অনেক লেখক যুক্তি দেন যে অ্যান্টিমনিকে উপধাতুর পরিবর্তে একটি ধাতু হিসেবে শ্রেণিবদ্ধ করা অধিকতর যৌক্তিক। অন্যদিকে, সবচেয়ে স্থিতিশীল রূপে সেলেনিয়ামের কিছুটা অর্ধপরিবাহীর বৈশিষ্ট্য আছে (যদিও এর অন্তরক রূপভেদও আছে)। এই ভিত্তিতে অনেকে যুক্তি দেখান যে একে উপধাতু হিসেবে বিবেচনা করা উচিত, যদিও একই অবস্থা ফসফরাসের ক্ষেত্রেও প্রযোজ্য, যেটিকে উপধাতুর তালিকায় অনেক কম দেখা যায়।
মৌলসমূহের আবর্তন ধর্মের আরও কিছু উদাহরণ
মৌলসমূহের পর্যায় সারণিতে একই গ্রুপে না থেকেও কিছু মৌলের মধ্যে পারস্পরিক সম্পর্ক লক্ষ্য করা যায়। যেমন, লিথিয়াম ও ম্যাগনেসিয়াম মৌল দুটি পরস্পরের কর্ণ বরাবর অবস্থিত, এদের মধ্যে বেশ কিছু মিল রয়েছে। এধরনের সম্পর্ককে কর্ণগত সম্পর্ক বলা হয়। আবার, প্রধান গ্রুপের মৌল ও ট্রানজিশন ধাতুগুলোর মধ্যে অথবা প্রাথমিক অ্যাক্টিনাইড ও প্রাথমিক ট্রানজিশন ধাতুগুলোর মধ্যে একই সংখ্যক যোজন ইলেকট্রন থাকলে কিছু মিল পাওয়া যায়। উদাহরণস্বরূপ, ইউরেনিয়াম কিছুটা ক্রোমিয়াম ও টাংস্টেনের মতো আচরণ করে, কারণ সবগুলোর যোজন ইলেকট্রন সংখ্যা ৬। একই যোজন ইলেকট্রন, কিন্তু ভিন্ন ধরণের যোজ্যতা কক্ষপথ বিশিষ্ট মৌলগুলোর মধ্যে যে সম্পর্ক তাকে গৌণ সম্পর্ক বলা যায়। এদের জন্য সাধারণত সর্বোচ্চ জারণ সংখ্যা একই হয়, কিন্তু সর্বনিম্ন জারণ সংখ্যা ভিন্ন হয়। যেমন, ক্লোরিন ও ম্যাঙ্গানিজ, উভয়ের সর্বোচ্চ জারণ সংখ্যা +৭, কিন্তু সর্বনিম্ন জারণ সংখ্যা যথাক্রমে -১ (HCl এ) এবং -৩ (K2[Mn(CO)4] এ)। আবার, কিছু মৌলের যোজন ইলেকট্রনের শূন্যস্থান একই, কিন্তু যোজন ইলেকট্রন সংখ্যা ভিন্ন হতে পারে। তাদের মধ্যকার সম্পর্ককে বলা হয় তৃতীয় পর্যায়ের বা সম-ইলেকট্রন গ্রাহক সম্পর্ক। এদের সর্বনিম্ন জারণ সংখ্যা সাধারণত একই কিন্তু সর্বোচ্চ জারণ সংখ্যা ভিন্ন হয়। যেমন, হাইড্রোজেনের সর্বনিম্ন জারণ সংখ্যা -১ (হাইড্রাইডে) যেটা ক্লোরিনের জন্যও একই (ক্লোরাইডে)। কিন্তু, হাইড্রোজেনের সর্বোচ্চ জারণ সংখ্যা +১, যেখানে ক্লোরিনের জন্য এটি +৭।
মৌলসমূহের গলনাংক, স্ফুটনাংক, গলনের সুপ্ততাপ, বাষ্পীভবনের সুপ্ততাপ, পরমাণুকরণ শক্তি ইত্যাদি বিভিন্ন ভৌত ধর্ম পর্যায় সূত্র অনুযায়ী পরিবর্তিত হয়। এ ধরণের আবর্তিত পরিবর্তন মৌলগুলোর যৌগের ক্ষেত্রেও লক্ষ্য করা যায়; যেমন হাইড্রাইড, অক্সাইড, সালফাইড, হ্যালাইড ইত্যাদি যৌগের তুলনা করলে তা স্পষ্ট হয়। রাসায়নিক ধর্মগুলো সংখ্যাগতভাবে প্রকাশ একটু জটিল, তারপরও এগুলো পর্যায়বৃত্তির একটা ধারা অনুসরণ করে। মৌল ও তাদের যৌগসমূহের অম্লীয় বা ক্ষারীয় ধর্ম, যৌগসমূহের স্থিতিশীলতা এমনকি মৌলগুলো আলাদাকরণ প্রক্রিয়া পর্যন্ত পর্যায়বৃত্ত ধর্মের প্রভাব স্পষ্টভাবে পরিলক্ষিত হয়। পর্যায়বৃত্তি আধুনিক রসায়নের অন্যতম ভিত্তি, অজানা মৌল বা যৌগের ধর্ম সম্পর্কে পূর্বাভাস দিতে এর গুরুত্ব অপরিসীম।
Remove ads
মৌলসমূহের শ্রেণিবিন্যাস
সারাংশ
প্রসঙ্গ

| ক্ষার ধাতু মৃৎক্ষার ধাতু ল্যান্থানাইড অ্যাক্টিনাইড অবস্থান্তর ধাতু (ট্রানজিশন/পরিবর্তনশীল) |
অন্যান্য ধাতু ধাতুকল্প অন্যান্য অধাতু হ্যালোজেন নিষ্ক্রিয় গ্যাস |
রাসায়নিক মৌলের অনুরূপ বৈশিষ্ট্যসম্পন্ন গ্রুপগুলোর বর্ণনায় বিভিন্ন পরিভাষা ব্যবহৃত হয়ে আসছে। 'ক্ষার ধাতু', 'মৃৎক্ষার ধাতু', 'ট্রাইয়েল', 'টেট্রেল', 'নিকটোজেন', 'চ্যালকোজেন', 'হ্যালোজেন', ও 'নোবেল গ্যাস' – এই রাসায়নিক গ্রুপগুলোকে আইইউপিএসি স্বীকৃতি দিয়েছে। অন্যান্য গ্রুপগুলোকেও সংখ্যা দিয়ে (যেমন গ্রুপ ৬ কে ক্রোমিয়াম গ্রুপ বলা হয়) অথবা প্রথম মৌলের নাম অনুসারে চিহ্নিত করা হয়। কাঠামোগতভাবে ১৩ থেকে ১৬ নম্বর গ্রুপের মৌলগুলোকে ধাতব পদার্থের বৈশিষ্ট্যের উপর ভিত্তি করে পি-ব্লকের মৌল থেকে আলাদা করা হয়। তবে রসায়নে ধাতু, অধাতু, বা উপধাতু (মেটালয়েড) – এদের কোনো নির্দিষ্ট সংজ্ঞা বা সর্বজন স্বীকৃত শ্রেণিবিন্যাস নেই। ট্রানজিশন মৌলগুলোর পরবর্তী ধাতুগুলোকে কী নামে অভিহিত করা যায়, তা নিয়েও ঐকমত্য নেই। 'পোস্ট-ট্রানজিশন মৌল' বা 'দুর্বল ধাতু' (poor metal) ইত্যাদি পরিভাষা এদের ক্ষেত্রে ব্যবহার করা হয়। কিছু গবেষক রাসায়নিক বৈশিষ্ট্যে বৈসাদৃশ্যের জন্য গ্রুপ ১২-এর মৌলসমূহকে ট্রানজিশন ধাতু থেকে বাদ দিয়ে থাকেন, তবে এটি সর্বজনীনভাবে প্রচলিত নয়। আইইউপিএসি-ও এ নিয়ে কোনো নির্দিষ্ট নীতিমালা প্রদান করেনি।
ল্যান্থানাইড বলে La-Lu পর্যন্ত মৌলগুলোকে বিবেচনা করা হয়। এদের রাসায়নিক বৈশিষ্ট্যে প্রচুর মিল রয়েছে। ঐতিহাসিকভাবে শুধু Ce থেকে Lu পর্যন্ত মৌলসমূহ ল্যান্থানাইড হিসেবে পরিচিত ছিলো। পরবর্তীতে ল্যান্থানামকেও এই গ্রুপভুক্ত করা শুরু হয়। ‘র্যার আর্থ মৌল’ বা ‘র্যার আর্থ ধাতু’ বলতে ল্যান্থানাইডদের পাশাপাশি স্ক্যান্ডিয়াম ও ইট্রিয়ামকেও বোঝানো হয়। একইভাবে, Ac থেকে Lr পর্যন্ত মৌলগুলোকে অ্যাক্টিনাইড বলা হয় (ঐতিহাসিকভাবে Th থেকে Lr পর্যন্ত)। যদিও অ্যাক্টিনাইডদের মধ্যে ল্যান্থানাইডদের তুলনায় বৈশিষ্ট্যের বৈচিত্র্য অনেক বেশী। আইইউপিএসি স্পষ্টতার জন্য 'ল্যান্থানয়েড' এবং 'অ্যাক্টিনয়েড' নামগুলো ব্যবহারের সুপারিশ করে কারণ '-আইড' প্রত্যয়টি সাধারণত ঋণাত্মক আয়ন বোঝাতে ব্যবহৃত হয়। তবে 'ল্যান্থানাইড' এবং 'অ্যাক্টিনাইড' নামগুলো বেশি প্রচলিত। লুটেশিয়াম ও লরেন্সিয়ামকে d-ব্লক মৌল হিসেবে স্বীকৃতি পাওয়ার পরে, কিছু গবেষক ল্যান্থানাইডদেরকে La থেকে Yb এবং অ্যাক্টিনাইডদেরকে Ac থেকে No পর্যন্ত হিসেবে সংজ্ঞায়িত করতে শুরু করেছেন, যা f-ব্লকের সাথে সঙ্গতিপূর্ণ। অ্যাক্টিনাইডের পরবর্তী অতি ভারী মৌলগুলো, যাদের অর্ধায়ু খুবই ক্ষণস্থায়ী, ট্রান্সঅ্যাক্টিনাইড বা সুপারহেভি এলিমেন্ট হিসেবে পরিচিত।
এছাড়া বিজ্ঞানের বিভিন্ন শাখায় মৌলসমূহকে শ্রেণীবদ্ধ করার আরো পদ্ধতি রয়েছে। যেমন, জ্যোতির্বিজ্ঞানে 'ধাতু' বলতে পারমাণবিক সংখ্যা ২-এর বেশী সম্পন্ন যেকোনো মৌলকে বোঝানো হয়। অর্থাৎ হাইড্রোজেন ও হিলিয়াম ব্যতীত সমস্ত মৌলই সেখানে ধাতু। পদার্থবিজ্ঞানে উপধাতুর সংজ্ঞা রসায়নের সংজ্ঞা থেকে আলাদা। ভৌত সংজ্ঞা অনুযায়ী বিসমাথ একটি উপধাতু কিন্তু রসায়নে একে সাধারণত ধাতু হিসেবেই বিবেচনা করা হয়। আবার 'ভারী ধাতু' (heavy metal) পরিভাষাটি ব্যাপকভাবে ব্যবহৃত হলেও এর কোনো সুনির্দিষ্ট সংজ্ঞা নেই। অনেক ক্ষেত্রে এর অর্থ এতটাই অস্পষ্ট যে সমালোচকদের মতে এটি 'অর্থহীন'।
লেখকভেদে এই পরিভাষাগুলোর প্রয়োগে ব্যাপক তারতম্য দেখা যায়। যেমন, আইইউপিএসি-এর মতে নোবেল গ্যাস বলতে সম্পূর্ণ গ্রুপটিকে বোঝায়, যার অন্তর্ভুক্ত হয় অতি তেজস্ক্রিয় সুপারহেভি মৌল, ‘ওগানেসন’। কিন্তু যারা সুপারহেভি মৌল নিয়ে গবেষণা করেন, তারা প্রায়ই এভাবে বলেন না। সেক্ষেত্রে 'নোবেল গ্যাস' বলতে মূলত কম তেজস্ক্রিয়, রাসায়নিকভাবে নিষ্ক্রিয় গ্রুপের উপাদানসমূহকে বোঝানো হয়। আণবিক অবস্থায় ওগানেসন খুব সম্ভবত অত্যন্ত তেজস্ক্রিয়। গাণিতিক মডেল থেকে পাওয়া যায় যে রিলেটিভিস্টিক এফেক্টের কারণে এটি তেমন নিষ্ক্রিয় নাও হতে পারে। এমনকি কক্ষতাপমাত্রায় এটি হয়তো গ্যাসও না। এজন্য এই পর্যায়ে ওগানেসনকে নোবেল গ্যাস হিসেবে স্বীকৃতি দেয়া নিয়ে বিতর্ক থেকেই যায়। আবার জাপানে বেরিলিয়াম ও ম্যাগনেসিয়ামকে প্রায়ই মৃৎক্ষার ধাতু হিসেবে পরিচয় দেয়া হয় না কারণ গ্রুপ ২ এর অন্যান্য ভারী মৌলের তুলনায় এদের রাসায়নিক আচরণে পার্থক্য আছে।
Remove ads
ইতিহাস
সারাংশ
প্রসঙ্গ

প্রারম্ভিক ইতিহাস
রসায়নের উপাদানগুলিকে শ্রেণীবদ্ধ করার প্রাথমিক প্রচেষ্টা শুরু হয়েছিল ১৮১৭ সালে যখন জার্মান পদার্থবিদ জোহান উলফগ্যাং ডোবেরেইনার এ ব্যাপারে কাজ করেন। ১৮২৯ সালে, তিনি আবিষ্কার করেন যে তিনি কিছু উপাদানকে তিনটির দলে বিভক্ত করতে পারেন, যেখানে এই দলের সদস্যদের মধ্যে পারস্পরিক সম্পর্কিত বৈশিষ্ট্য রয়েছে। তিনি এই দলগুলিকে ত্রয়ী বা 'ট্রায়াড' (Triads) নামকরণ করেন। ক্লোরিন, ব্রোমিন এবং আয়োডিন একটি ট্রায়াড গঠন করে। অনুরূপভাবে ক্যালসিয়াম, স্ট্রন্টিয়াম এবং বেরিয়াম আরেকটি; লিথিয়াম, সোডিয়াম এবং পটাসিয়াম আরেকটি এবং সালফার, সেলেনিয়াম এবং টেলুরিয়াম আরেকটি ট্রায়াড গঠন করে। আজকের দিনে, এই সমস্ত ট্রায়াড আমাদের আধুনিক পর্যায় সারণির বিভিন্ন গ্রুপের অন্তর্ভুক্ত: হ্যালোজেন, ক্ষারীয় মৃৎ ধাতু, ক্ষার ধাতু এবং চ্যালকোজেন গ্রুপ। বিভিন্ন রসায়নবিদ তাঁর কাজ অব্যাহত রাখেন এবং উপাদানগুলির ছোট ছোট গ্রুপের মধ্যে ক্রমবর্ধমান সম্পর্ক চিহ্নিত করতে সক্ষম হন। তবে, তারা এমন একটি একক স্কিম তৈরি করতে পারেনি যা সেই সমস্ত সম্পর্ককে অন্তর্ভুক্ত করবে।

জন নিউল্যান্ডস ১৮৬৩ সালের ফেব্রুয়ারিতে কেমিক্যাল নিউজে একটি চিঠি প্রকাশ করেন যেখানে তিনি রাসায়নিক উপাদানগুলির মধ্যে পর্যায়ক্রমিক ধর্মের উপর আলোচনা করেন। ১৮৬৪ সালে নিউল্যান্ডস কেমিক্যাল নিউজে একটি নিবন্ধ প্রকাশ করেন যেখানে দেখানো হয়েছে যে, যদি উপাদানগুলিকে তাদের পারমাণবিক ওজনের ক্রমে সাজানো হয়, তবে পরপর সংখ্যাযুক্ত উপাদানগুলি ঘন ঘন হয় একই গ্রুপের অন্তর্ভুক্ত অথবা বিভিন্ন গ্রুপে অনুরূপ অবস্থানে থাকে। তিনি আরো উল্লেখ করেন যে প্রদত্ত একটি উপাদান থেকে শুরু করে প্রতি অষ্টম উপাদানটি এই বিন্যাসে প্রথমটির এক ধরণের পুনরাবৃত্তি, ঠিক যেমন সঙ্গীতে একটি অষ্টকের অষ্টম স্বর (অক্টেভের সূত্র)। যাইহোক, নিউল্যান্ডসের সূত্রগুলি মূল গ্রুপ উপাদানগুলির ক্ষেত্রে ভালভাবে কাজ করেছিল কিন্তু অন্যগুলির সাথে গুরুতর সমস্যায় পড়েছিল।
জার্মান রসায়নবিদ লোথার মেয়ার পর্যায়ক্রমিক বিরতিতে পুনরাবৃত্ত অনুরূপ রাসায়নিক এবং ভৌত বৈশিষ্ট্য লক্ষ্য করেন। তাঁর মতে, যদি পারমাণবিক ওজনগুলি অর্ডিনেট (অর্থাৎ উল্লম্বভাবে) এবং পারমাণবিক আয়তনগুলিকে অ্যাবসিসা (অর্থাৎ অনুভূমিকভাবে) হিসেবে প্লট করা হয়, তবে প্রাপ্ত বক্ররেখাটিতে অনেকগুলি উত্থান এবং পতনের ক্রম দেখা যাবে। এই বিন্যাসে সবচেয়ে তড়িৎধনাত্মক উপাদানগুলি তাদের পারমাণবিক ওজনের ক্রমে বক্ররেখার শীর্ষে উপস্থিত হবে। ১৮৬৪ সালে, তাঁর একটি বই প্রকাশিত হয়; এটিতে ২৮টি উপাদান সম্বলিত পর্যায় সারণির একটি প্রাথমিক সংস্করণ ছিল। তিনি প্রথমবারের মতো উপাদানগুলিকে তাদের যোজনী অনুসারে ছয়টি পরিবারে শ্রেণীবদ্ধ করেছিলেন। উপাদানগুলির পারমাণবিক ওজনের ভুল পরিমাপের কারণে সেই সময় অবধি পারমাণবিক ওজন দ্বারা উপাদানগুলিকে সংগঠিত করার কাজগুলি ব্যর্থ হয়েছিল। ১৮৬৮ সালে, তিনি তার সারণিটি সংশোধন করেন, কিন্তু এই সংশোধনীটি তাঁর মৃত্যুর পরে খসড়া হিসাবে প্রকাশিত হয়েছিল।
মেন্ডেলিভ এবং পর্যায় সারণির উৎপত্তি

রুশ রসায়নবিদ দিমিত্রি মেন্ডেলিভ পর্যায় সারণির উন্নয়নে চূড়ান্ত সাফল্য অর্জন করেন। যদিও অন্যান্য রসায়নবিদরা (মেয়ারসহ) প্রায় একই সময়ে পর্যায় সারণির কিছু সংস্করণ তৈরি করেছিলেন, মেন্ডেলিভ তার সারণিকে উন্নয়ন ও এর যৌক্তিকতা প্রমাণের ক্ষেত্রে সবচেয়ে বেশি নিবেদিত ছিলেন। সে কারণেই তাঁর পদ্ধতিই বৈজ্ঞানিক সম্প্রদায়কে সবচেয়ে বেশি প্রভাবিত করেছিল। ১৮৬৯ সালের ১৭ ফেব্রুয়ারি (গ্রেগরিয়ান ক্যালেন্ডার অনুসারে ১ মার্চ ১৮৬৯), মেন্ডেলিভ মৌলসমূহকে তাদের পারমাণবিক ভর অনুসারে সাজাতে এবং তুলনা করতে শুরু করেন। তিনি প্রথমে কিছু মৌল দিয়ে শুরু করেছিলেন, এবং দিনের বেলায় তাঁর সারণিটি সম্প্রসারিত হতে থাকে যতক্ষণ না তা জানা মৌলগুলোর অধিকাংশকেই অন্তর্ভুক্ত করে। একটি সামঞ্জস্যপূর্ণ বিন্যাস খুঁজে পাওয়ার পর, তাঁর তৈরি সারণিটি ১৮৬৯ সালের মে মাসে রাশিয়ান কেমিক্যাল সোসাইটির জার্নালে প্রকাশিত হয়। যখন মনে হতো কিছু মৌল সারণিতে খাপ খাচ্ছে না, তখন তিনি সাহসিকতার সাথে ভবিষ্যদ্বাণী করেছিলেন যে হয় যোজনী বা পারমাণবিক ভর ভুলভাবে পরিমাপ করা হয়েছে, অথবা এখনও এমন কিছু মৌল আছে যেগুলো আবিষ্কৃত হয়নি। ১৮৭১ সালে, মেন্ডেলিভ একটি দীর্ঘ নিবন্ধ প্রকাশ করেন, যেখানে তাঁর সারণির একটি আপডেট সংস্করণসহ অজানা মৌল সম্পর্কে তার ভবিষ্যদ্বাণীগুলো স্পষ্টভাবে লেখা ছিল। মেন্ডেলিভ বোরন, অ্যালুমিনিয়াম এবং সিলিকন এর ভারী হোমোলগ হবে এমন তিনটি অজানা মৌলের বৈশিষ্ট্য বিস্তারিতভাবে ভবিষ্যদ্বাণী করেছিলেন এবং তাদের নাম দিয়েছিলেন একা-বোরন, একা-অ্যালুমিনিয়াম এবং একা-সিলিকন ("একা" একটি সংস্কৃত শব্দ যার অর্থ "এক")।
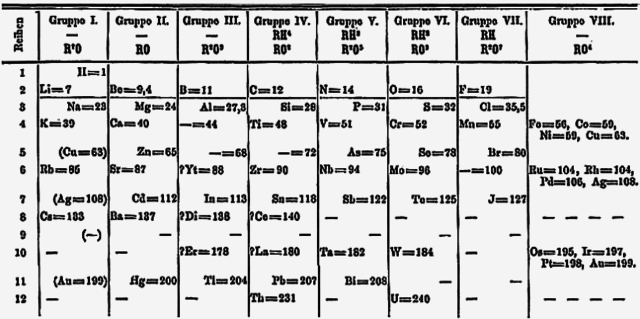
১৮৭৫ সালে, ফরাসি রসায়নবিদ পল-এমিল ল্যকক দ্য বোইসবউদ্রান, মেন্ডেলিভের ভবিষ্যদ্বাণীর কথা না জেনেই, স্ফ্যালেরাইট খনিজের একটি নমুনায় একটি নতুন মৌল আবিষ্কার করেন এবং এর নাম দেন গ্যালিয়াম। তিনি মৌলটিকে আলাদা করে এর বৈশিষ্ট্য নির্ধারণ করা শুরু করেন। ল্যকক দ্য বোইসবউদ্রানের প্রকাশনা পড়ে মেন্ডেলিভ একটি চিঠি পাঠান যেখানে তিনি দাবি করেন গ্যালিয়াম আসলে তাঁর ভবিষ্যদ্বাণী করা একা-অ্যালুমিনিয়াম। যদিও ল্যকক দ্য বোইসবউদ্রান প্রথমে সন্দিহান ছিলেন এবং ভেবেছিলেন মেন্ডেলিভ আবিষ্কারের কৃতিত্ব নেওয়ার চেষ্টা করছেন, পরবর্তীতে তিনি স্বীকার করে নেন যে মেন্ডেলিভ সঠিক ছিলেন। ১৮৭৯ সালে, সুইডিশ রসায়নবিদ লার্স ফ্রেড্রিক নিলসন একটি নতুন মৌল আবিষ্কার করেছিলেন, যার নাম তিনি রেখেছিলেন স্ক্যান্ডিয়াম: এটি আসলে একা-বোরন বলে প্রমাণিত হয়। একা-সিলিকন ১৮৮৬ সালে জার্মান রসায়নবিদ ক্লিমেন্স উইঙ্কলার আবিষ্কার করেন এবং এর নাম দেন জার্মেনিয়াম। গ্যালিয়াম, স্ক্যান্ডিয়াম এবং জার্মেনিয়ামের বৈশিষ্ট্য মেন্ডেলিভের ভবিষ্যদ্বাণীর সাথে মিলে যায়।
এখানেই শেষ নয়! উনিশ শতকের শেষের দিকে নিষ্ক্রিয় গ্যাসগুলি আবিষ্কার মেন্ডেলিভের পর্যায় সারণিতে চমৎকারভাবে খাপ খেয়ে যায়। এই মৌলগুলো অষ্টম মূল গ্রুপ হিসেবে যুক্ত হয়, যদিও মেন্ডেলিভ এদের ভবিষ্যদ্বাণী করেননি। তবে ল্যান্থানাইডদের সারণীতে খাপ খাওয়ানো নিয়ে মেন্ডেলিভ সমস্যায় পড়েন। এই মৌলগুলো অন্যান্য মৌলের মতো যোজনীতে পর্যায়ক্রমিক পরিবর্তন দেখায় না। অনেক অনুসন্ধানের পর, চেক রসায়নবিদ বোহুস্লাভ ব্রাউনার ১৯০২ সালে পরামর্শ দেন যে ল্যান্থানাইডদের পর্যায় সারণির একটি নির্দিষ্ট গ্রুপেই একসাথে রাখা যেতে পারে। তিনি জ্যোতির্বৈজ্ঞানিক সাদৃশ্যের ভিত্তিতে এটিকে "অ্যাস্টেরয়েড হাইপোথিসিস" নাম দেন: যেভাবে মঙ্গল ও বৃহস্পতির মধ্যে একটি গ্রহাণু বলয় রয়েছে, ঠিক তেমনি ইট্রিয়ামের নিচের স্থানটিতে একটি মৌলের পরিবর্তে সমস্ত ল্যান্থানাইড থাকতে পারে।
পারমাণবিক সংখ্যা

পরমাণুর অভ্যন্তরীণ গঠনের অনুসন্ধানের পর, ওলন্দাজ পদার্থবিদ অ্যান্টোনিয়াস ভ্যান ডেন ব্রুক ১৯১৩ সালে প্রস্তাব করেন যে পরমাণুর কেন্দ্রের আধান (nuclear charge) মৌলের পর্যায় সারণীতে অবস্থান নির্ধারণ করে। নিউজিল্যান্ডের পদার্থবিদ আর্নেস্ট রাদারফোর্ড এই আধানকে "পারমাণবিক সংখ্যা" হিসেবে অভিহিত করেন। ভ্যান ডেন ব্রুকের প্রকাশিত নিবন্ধে, তিনি প্রথম ইলেকট্রনিক পর্যায় সারণী স্থাপন করেন যেখানে মৌলগুলোকে তাদের ইলেকট্রনের সংখ্যা অনুসারে সাজানো হয়েছে। রাদারফোর্ড ১৯১৪ সালে তার গবেষণাপত্রে নিশ্চিত করেন যে বোর ভ্যান ডেন ব্রুকের মতামত গ্রহণ করেছিলেন।

একই বছর, ইংরেজ পদার্থবিদ হেনরি মোসলে এক্স-রে স্পেকট্রোস্কোপি ব্যবহার করে পরীক্ষামূলকভাবে ভ্যান ডেন ব্রুকের প্রস্তাবনা নিশ্চিত করেছেন। মোসলে অ্যালুমিনিয়াম থেকে স্বর্ণ পর্যন্ত প্রতিটি মৌলের নিউক্লিয়ার চার্জ নির্ধারণ করেন এবং দেখান যে মেন্ডেলিভের পর্যায় সারণী আসলে নিউক্লিয়ার আধানের ক্রম অনুসারে মৌলগুলিকে সাজিয়েছে। নিউক্লিয়ার আধান হলো প্রোটনের সংখ্যার সমান এবং প্রতিটি মৌলের পারমাণবিক সংখ্যা (Z) এর মান নির্ধারণ করে। পারমাণবিক সংখ্যা ব্যবহার করে মৌলগুলিকে একটি নির্দিষ্ট পূর্ণসংখ্যা-ভিত্তিক ক্রমে সাজানো যায়। মোসলে-র গবেষণা পারমাণবিক ভর এবং রাসায়নিক বৈশিষ্ট্যের মধ্যেকার পার্থক্যগুলিকে দ্রুত সমাধান করে দেয়; উদাহরণস্বরূপ টেলুরিয়াম এবং আয়োডিনের ক্ষেত্রে পারমাণবিক সংখ্যা বৃদ্ধি পায় কিন্তু পারমাণবিক ভর হ্রাস পায়। যদিও প্রথম বিশ্বযুদ্ধে মোসলে অল্প বয়সেই মারা গিয়েছিলেন, সুইডিশ পদার্থবিদ ম্যান সিগবান ইউরেনিয়াম পর্যন্ত কাজ চালিয়ে যান এবং নিশ্চিত করেন যে এটি তখনকার সর্বোচ্চ পারমাণবিক সংখ্যা (৯২) বিশিষ্ট মৌল। মোসলে এবং সিগবানের গবেষণার ভিত্তিতে, এটিও জানা যায় যে কোন পারমাণবিক সংখ্যাগুলো এখনও আবিষ্কৃত হয়নি (যেমন ৪৩, ৬১, ৭২, ৭৫, ৮৫, এবং ৮৭)। (জাপানি রসায়নবিদ মাসাতাকা ওগাওয়া ১৯০৮ সালে ৭৫ নম্বর মৌল আবিষ্কার করেছিলেন এবং এটিকে "নিপোনিয়াম" নাম দেন, কিন্তু ভুলক্রমে এটিকে ৭৫ এর পরিবর্তে ৪৩ হিসেবে চিহ্নিত করেছিলেন, তাই তার আবিষ্কার পরবর্তীতে যথাযথ স্বীকৃতি পায়নি। বর্তমানে স্বীকৃত ৭৫ নম্বর মৌলের আবিষ্কারটি হয় ১৯২৫ সালে যখন ওয়াল্টার নোডাক, ইডা ট্যাকে এবং অটো বার্গ এটিকে স্বাধীনভাবে আবিষ্কার করেন এবং নাম দেন রেনিয়াম।)
পারমাণবিক পদার্থবিদ্যার সূচনা আইসোটোপের অবস্থানকেও স্পষ্ট করে তোলে। তেজস্ক্রিয় মৌল থোরিয়াম ও ইউরেনিয়ামের ক্ষয় ধারায়, শীঘ্রই স্পষ্ট হয়ে ওঠে যে এখানে অনেক আপাত নতুন মৌল রয়েছে যাদের ভিন্ন পারমাণবিক ভর কিন্তু একই রাসায়নিক বৈশিষ্ট্য রয়েছে। ১৯১৩ সালে, ফ্রেডরিক সডি এই পরিস্থিতিকে ব্যাখ্যা করার জন্য "আইসোটোপ" শব্দটি প্রবর্তন করেন, এবং তিনি আইসোটোপগুলিকে মূলত একই মৌলের বিভিন্ন রূপ হিসেবে বিবেচনা করেছিলেন। এটি টেলুরিয়াম এবং আয়োডিনের পার্থক্যগুলিকে আরও স্পষ্ট করে তোলে: টেলুরিয়ামের প্রাকৃতিক আইসোটোপিক গঠন আয়োডিনের তুলনায় ভারী আইসোটোপসমৃদ্ধ, কিন্তু টেলুরিয়ামের পারমাণবিক সংখ্যা কম।
ইলেকট্রন শক্তিস্তর
ডেনিশ পদার্থবিজ্ঞানী নিলস বোর পরমাণুর ক্ষেত্রে ম্যাক্স প্ল্যাঙ্কের কোয়ান্টাইজেশন ধারণা প্রয়োগ করেন। তিনি এই সিদ্ধান্তে উপনীত হন যে ইলেকট্রনের শক্তিস্তরগুলি কোয়ান্টাইজড: স্থিতিশীল শক্তি অবস্থার শুধুমাত্র একটি পৃথক সেট অনুমোদিত। বোর এরপর ১৯১৩ সালে ইলেকট্রন কনফিগারেশনের মাধ্যমে পর্যায়বৃত্ততা বোঝার চেষ্টা করেন। তিনি অনুমান করেন যে, একটি মৌলের রাসায়নিক বৈশিষ্ট্যের জন্য ভিতরের ইলেকট্রনগুলোই দায়ী। ১৯১৩ সালে, তিনি একটি কোয়ান্টাম পরমাণুর উপর ভিত্তি করে প্রথম ইলেকট্রনিক পর্যায় সারণী তৈরি করেন।
বোর ১৯১৩ সালে তার ইলেকট্রন শেলগুলোকে "বলয়" (rings) হিসেবে আখ্যায়িত করেন। এই গ্রহগত মডেলের সময়ে শেলের (shell) ভেতর পারমাণবিক কক্ষপথের (atomic orbital) কোন ধারণাই ছিলনা। নিজের ১৯১৩ সালের বিখ্যাত গবেষণাপত্রের তৃতীয় পর্বে বোর উল্লেখ করেন যে একটি শেলে সর্বোচ্চ আটটি ইলেকট্রন থাকতে পারে। তিনি লিখেন, "আমরা আরও দেখতে পাই যে, যদি n<8 না হয়, তবে n সংখ্যক ইলেক্ট্রন বিশিষ্ট কোন বলয় একটি ne চার্জ বিশিষ্ট নিউক্লিয়াসের চারপাশে ঘুরতে পারবে না।" অপেক্ষাকৃত ছোট পরমাণুর জন্য ইলেকট্রন শেলগুলো নিম্নরূপে পূরণ হবে: "ইলেকট্রনের বলয়গুলো শুধু তখনই যুক্ত হবে যদি সেগুলোতে সমান সংখ্যক ইলেকট্রন থাকে; তাই অনুযায়ী ভেতরের বলয়গুলোতে ইলেকট্রনের সংখ্যা শুধুমাত্র ২, ৪, ৮ হবে।" তবে বড় পরমাণুর ক্ষেত্রে ভেতরের শেলে আটটি ইলেকট্রন থাকবে: "অন্যদিকে, মৌলসমূহের পর্যায় সারণী স্পষ্টভাবে পরামর্শ দেয় যে, ইতোমধ্যেই নিয়ন (N=10) এ আটটি ইলেকট্রন বিশিষ্ট একটি ভেতরের বলয় তৈরি হয়ে যাবে।" পরমাণুর জন্য তিনি যেই ইলেকট্রন কনফিগারেশন প্রস্তাব করেছেন (ডানদিকে দেখানো হয়েছে) তার বেশিরভাগই বর্তমানে পরিচিত কনফিগারেশনের সাথে মেলে না। পরবর্তীতে আর্নল্ড সামারফিল্ড এবং এডমন্ড স্টোনার আরও কোয়ান্টাম সংখ্যা আবিষ্কারের পর এই কনফিগারেশনগুলোর উন্নতি ঘটেছিল।
বোরের ইলেকট্রন বিন্যাস (হালকা উপাদানের জন্য)
১৯১৪ সালে ওয়ালথার কোসেল এবং ১৯১৬ সালে বোরের পারমাণবিক তত্ত্বের রাসায়নিক বিভবকে (chemical potentials) নিয়মতান্ত্রিকভাবে সম্প্রসারণ ও সংশোধন করেন। কোসেল ব্যাখ্যা করেন যে পর্যায় সারণীতে বাইরের শেলে ইলেকট্রন যুক্ত হওয়ার সাথে সাথে নতুন মৌল তৈরি হয়। কোসেল তার গবেষণাপত্রে লিখেছেন: "এটি এই উপসংহারে নিয়ে যায় যে পরবর্তীতে যুক্ত হওয়া ইলেকট্রনগুলো কেন্দ্রমুখী বলয় বা শেলে স্থাপন করা উচিত। এদের প্রতিটিতে... একটি নির্দিष्ट সংখ্যক ইলেকট্রন থাকবে, যা আমাদের ক্ষেত্রে আটটি। একটি বলয় বা শেল সম্পূর্ণ হওয়ার পরে পরবর্তী মৌলের জন্য একটি নতুন শেল শুরু করতে হবে: সহজে অ্যাক্সেসযোগ্য এবং সবচেয়ে বাইরের প্রান্তে থাকা ইলেকট্রনগুলোর সংখ্যা আবার মৌল থেকে মৌলে বৃদ্ধি পায় এবং তাই প্রতিটি নতুন শেল তৈরিতে রাসায়নিক পর্যাবৃত্ততা পুনরাবৃত্ত হয়।"
১৯১৯ সালে, আরভিং ল্যাংমুয়ার তাঁর একটি গবেষণাপত্রে 'কোষ' (cells) এর ব্যাখ্যা করেন। আমরা এখন সেই 'কোষ' গুলিকে অরবিটাল হিসেবে জানি। একটি অরবিটালে সর্বোচ্চ দুইটি ইলেকট্রন থাকতে পারে। এই অরবিটালগুলি কতগুলি 'আস্তরণে' বা শেলে সুসজ্জিত থাকে। আমরা এখন এগুলোকে ইলেকট্রন শেল হিসেবে জানি। ল্যাংমুয়ারের মতে, সর্বপ্রথম শেলে সর্বাধিক দুইটি ইলেকট্রন থাকতে পারে। ১৯২১ সালে রসায়নবিদ চার্লস রুগলে বারি বলেন যে, একটি শেলে আট বা আঠারোটি ইলেকট্রন থাকলে তা একটি স্থিতিশীল পর্যায়ে থাকে। বারি আরও বলেন, ট্রানজিশন মৌলের (যেগুলোকে ট্রানজিশন ধাতু হিসেবেও জানা যায়) ইলেকট্রন বিন্যাস ওই মৌলের বাহিরের শেলে উপস্থিত ইলেকট্রনের সংখ্যার ওপর নির্ভরশীল । তিনি এই মৌলগুলোর নাম দেন ট্রানজিশন মৌল। জর্জেস আর্বাইন নামের একজন বিজ্ঞানী দাবি করেন যে তিনি ৭২তম মৌলটি আবিষ্কার করেছেন। তিনি এর নাম রাখেন সেলটিয়াম। কিন্তু, বারি এবং নিলস বোরের ধারণা ছিলো যে ৭২তম মৌলটি একটি বিরল মৃত্তিকা ধাতু (rare earth element) হতে পারে না, বরং জিরকোনিয়ামের সমগোত্রীয় মৌল হওয়ার সম্ভাবনাই বেশি। এরপর ডার্ক কস্টার ও জর্জ ভন হেভেসি এই ৭২তম মৌলটিকে জিরকোনিয়াম আকরিকে খুঁজতে থাকেন ও আবিষ্কার করেন। বোরের জন্মস্থান কোপেনহেগেন শহরের ল্যাটিন নাম 'হাফনিয়া' অনুসারে তারা এই নতুন মৌলের নাম রাখেন হাফনিয়াম। পরে জানা যায় আর্বাইনের সেলটিয়াম আসলে বিশুদ্ধ লুটেটিয়ামের (৭১তম মৌল) একটি রূপ ছিল। এভাবে হাফনিয়াম ও রেনিয়াম শেষ স্থিতিশীল মৌল হিসেবে আবিষ্কৃত হয়।
বোরের অনুপ্রেরণায় ১৯২৩ সালে উলফগ্যাং পাউলি ইলেকট্রন বিন্যাসের ওপর কাজ শুরু করেন। পাউলি বোরের মডেলকে আরও এগিয়ে নিয়ে যান চারটি কোয়ান্টাম সংখ্যা ব্যবহার করে। পাউলির বহিঃবর্তন নীতি অনুসারে, দুইটি ইলেকট্রনের চারটি কোয়ান্টাম সংখ্যা কখনোই একই হতে পারে না। এর ফলে পর্যায় সারণীর প্রতিটি পর্যায়ের দৈর্ঘ্যের ব্যাখ্যা সহজ হয়। কোন শেলে সর্বাধিক কতগুলো ইলেকট্রন থাকতে পারে পর্যায়ের দৈর্ঘ্য তারই নির্দেশক (২, ৮, ১৮, ৩২)। ১৯২৫ সালে ফ্রিডরিখ হান্ড আধুনিক ইলেকট্রন বিন্যাস পদ্ধতির খুব কাছাকাছি একটি সূত্রে উপনীত হন। রাসায়নিকভাবে সক্রিয় বা যোজ্য ইলেকট্রনের উপর ভিত্তি করে পর্যায় সারণীর নতুন নিয়ম তৈরি হয়। ১৯২৬ সালে আরউইন ম্যাডেলুং প্রথম Aufbau নীতির পর্যবেক্ষণমূলক ব্যাখ্যা দেন। ১৯৩০ সালে ভ্লাদিমির কারাপেটফ প্রথম এটি প্রকাশ করেন।

কোয়ান্টাম তত্ত্ব স্পষ্টভাবে প্রমাণ করেছে যে ট্রানজিশন ধাতু (transition metals) এবং ল্যান্থানাইডস (lanthanides) মৌলিক গ্রুপগুলোর মধ্যে 'ব্রিজ' হিসাবে কাজ করে এবং তাদের নিজস্ব পৃথক গ্রুপ হিসেবে অবস্থান করে। যদিও এর আগেই, কিছু রসায়নবিদ পর্যায় সারণীতে এসব মৌলকে এভাবেই স্থান দিতে প্রস্তাব করেছিলেন। ইংরেজ রসায়নবিদ হেনরি ব্যাসেট ১৮৯২ সালে, ডেনিশ রসায়নবিদ জুলিয়াস থমসেন ১৮৯৫ সালে এবং সুইস রসায়নবিদ আলফ্রেড ওয়ার্নার ১৯০৫ সালে এই ধরনের প্রস্তাবনা দেন। বোর তার ১৯২২ সালের নোবেল বক্তৃতায় থমসেনের প্রস্তাবিত সারণীর ফর্ম ব্যবহার করেছিলেন। আলফ্রেড ওয়ার্নারের প্রস্তাবিত ফর্মটি বর্তমান সময়ে ব্যবহৃত ৩২-কলামের পর্যায় সারণীর সাথে অনেকটাই মিলে যায়। গুরুত্বপূর্ণভাবে, এই তত্ত্বগুলো ব্রাউনারের "অ্যাস্টেরয়েডাল হাইপোথিসিস" কে প্রতিস্থাপিত করেছিল।
ল্যান্থানাইডসমূহের সঠিক অবস্থান, এবং এর ফলে গ্রুপ ৩ এর উপাদানগুলো নিয়ে দশকের পর দশক ধরে বিতর্ক থেকে যায় কারণ তাদের ইলেকট্রন বিন্যাস প্রাথমিকভাবে ভুলভাবে নির্ধারিত হয়েছিল। রাসায়নিক কারণের উপর ভিত্তি করে ব্যাসেট, ওয়ার্নার এবং বুরি স্ক্যান্ডিয়াম এবং ইট্রিয়ামকে ল্যান্থানামের সাথে জোড়া না দিয়ে লুটেটিয়ামের সাথে গ্রুপবদ্ধ করেছিলেন (লুটেশিয়াম তখনও আবিষ্কৃত হয়নি বলে ইট্রিয়ামের নিচে একটি ফাঁকা স্থান রাখা হয়েছিল)। ১৯২৭ সালে হুন্ড ধারণা করেছিলেন যে সমস্ত ল্যান্থানাইড পরমাণুরই [Xe]4f0−145d16s2 ইলেক্ট্রন বিন্যাস রয়েছে, কারণ তারা প্রধানত ত্রিযোজী। এটি এখন জানা গেছে যে রসায়ন এবং ইলেকট্রন কনফিগারেশনের মধ্যে সম্পর্ক এর চেয়ে অনেক জটিল। প্রাথমিক স্পেকট্রোস্কোপিক তথ্য এই কনফিগারেশনের ধারণা জোরালো করেছিল, ফলে পর্যায় সারণির গঠন এমন হয়েছিল যেখানে গ্রুপ ৩ এ ছিল স্ক্যান্ডিয়াম, ইট্রিয়াম, ল্যান্থানাম এবং অ্যাক্টিনিয়াম। চৌদ্দটি f-উপাদান ল্যান্থানাম এবং হ্যাফনিয়ামের মধ্যে d ব্লককে বিভক্ত করে দিয়েছিল। কিন্তু পরে জানা যায় যে পনেরোটি ল্যান্থানাইডের মধ্যে মাত্র চারটির জন্য এটি সত্য (ল্যান্থানাম, সেরিয়াম, গ্যাডোলিনিয়াম এবং লুটেটিয়াম)। অন্যান্য ল্যান্থানাইড পরমাণুর একটিও d-ইলেকট্রন নেই। বিশেষভাবে ইটারবিয়াম 4f শেলটি সম্পূর্ণ করে, এবং সেই কারণে সোভিয়েত পদার্থবিদ লেভ ল্যান্ডাউ এবং ইয়েভজেনি লিফশিটজ ১৯৪৮ সালে লক্ষ্য করেছিলেন যে লুটেটিয়াম সঠিকভাবে একটি f-ব্লক উপাদান হিসাবে নয় বরং একটি d-ব্লক উপাদান হিসাবে বিবেচিত হবে; ১৯৬৩ সালে জন কনডো প্রথম পরামর্শ দিয়েছিলেন যে বাল্ক ল্যান্থানাম হলো একটি f-ধাতু, এর নিম্ন তাপমাত্রার অতিপরিবাহিতার ভিত্তিতে । পরমাণুর নিম্ন-স্তরের উত্তেজিত অবস্থা যা রাসায়নিক পরিবেশে ভূমিকা রাখতে পারে - সেগুলোর দিকে তাকিয়ে এই ব্যাপারটি উপলব্ধি করা যায়, ফলে উপাদানগুলোকে ব্লক দ্বারা শ্রেণীবদ্ধ করা এবং পর্যায় সারণিতে অবস্থান দেওয়া সহজতর হয়। অনেক লেখক পরবর্তীতে পদার্থবিজ্ঞান, রসায়ন এবং ইলেকট্রনিক বিষয়ের উপর ভিত্তি করে এই সংশোধনটি পুনরায় আবিষ্কার করেছিলেন এবং এটি সমস্ত প্রাসঙ্গিক উপাদানের ক্ষেত্রে প্রয়োগ করেছিলেন। ফলস্বরূপ গ্রুপ ৩ তে স্ক্যান্ডিয়াম, ইট্রিয়াম, লুটেটিয়াম এবং লরেনসিয়াম রয়েছে, এবং ল্যান্থানাম থেকে ইটারবিয়াম এবং অ্যাক্টিনিয়াম থেকে নোবেলিয়ামকে f-ব্লক সারি হিসাবে রাখা হয়েছে। এই সংশোধিত সংস্করণটি ম্যাডেলুং নীতির সাথে সামঞ্জস্যপূর্ণ এবং ব্যাসেট, ওয়ার্নার এবং বুরির প্রাথমিক রাসায়নিক স্থানকে সঠিক বলে প্রমাণ করে।
১৯৮৮ সালে, IUPAC গ্রুপ ৩ এর এই উপাদান-বিন্যাস সমর্থন করে একটি প্রতিবেদন প্রকাশ করে, একটি সিদ্ধান্ত যা ২০২১ সালে পুনরায় নিশ্চিত করা হয়েছে। গ্রুপ ৩ এর বিন্যাস নিয়ে পাঠ্যপুস্তকে এখনও বৈচিত্র্য পাওয়া যেতে পারে, এবং এই বিন্যাসটির বিরুদ্ধে কিছু যুক্তি আজও প্রকাশিত হচ্ছে। কিন্তু যে রসায়নবিদ এবং পদার্থবিজ্ঞানীরা বিষয়টি বিবেচনা করেছেন তারা সাধারণত গ্রুপ ৩ এ স্ক্যান্ডিয়াম, ইট্রিয়াম, লুটেটিয়াম এবং লরেনসিয়াম থাকার ব্যাপারে একমত হন। তারা প্রতি-যুক্তিকে অসামঞ্জস্যপূর্ণ বলে মনে করে সেগুলোকে চ্যালেঞ্জ জানান।
কৃত্রিম মৌল

১৯৩৬ সালের মধ্যে, হাইড্রোজেন থেকে ইউরেনিয়াম পর্যন্ত মৌলসমূহের মধ্যে শূন্যস্থান ছিল মাত্র চারটি। ৪৩, ৬১, ৮৫, এবং ৮৭ নম্বর মৌলগুলো তখনো আবিষ্কৃত হয়নি। ৪৩ নম্বর মৌলটি সর্বপ্রথম কৃত্রিমভাবে তৈরি করা হয়। প্রকৃতিতে না পাওয়া গিয়ে এই মৌলটি পারমাণবিক বিক্রিয়ার মাধ্যমে সৃষ্টি করা হয়েছিল। এটি আবিষ্কার করেছিলেন ইতালীয় রসায়নবিদ এমিলিও সেগ্রে এবং কার্লো পেরিয়ার ১৯৩৭ সালে। তারা তাদের আবিষ্কারের নাম দেন টেকনেটিয়াম, যা 'কৃত্রিম' অর্থবোধক একটি গ্রীক শব্দ থেকে এসেছে। একইভাবে, ৬১তম (প্রমিথিয়াম) এবং ৮৫তম (অ্যাস্টাটাইন) মৌল কৃত্রিমভাবে আবিষ্কার হয়, যথাক্রমে ১৯৪৫ এবং ১৯৪০ সালে। ৮৭তম মৌল (ফ্র্যান্সিয়াম) প্রকৃতিতে আবিষ্কৃত সর্বশেষ মৌল, আবিষ্কার করেন ফরাসি রসায়নবিদ মার্গুরিট পেরে ১৯৩৯ সালে।
ইউরেনিয়ামের পরবর্তী মৌলগুলিও কৃত্রিমভাবে আবিষ্কৃত হয়েছিল। শুরুটা করেছিলেন এডউইন ম্যাকমিলান এবং ফিলিপ অ্যাবেলসন ১৯৪০ সালে নেপচুনিয়াম আবিষ্কারের মাধ্যমে (ইউরেনিয়ামকে নিউট্রন দিয়ে আঘাত করে)। গ্লেন টি. সিবার্গ এবং লরেন্স বার্কলি ন্যাশনাল ল্যাবরেটরি (LBNL)-এর গবেষক দল এই আবিষ্কারের ধারা অব্যাহত রাখেন। তারা ১৯৪১ সালে প্লুটোনিয়াম আবিষ্কারের মাধ্যমে ট্রান্সইউরেনিয়াম মৌলগুলি আবিষ্কার শুরু করেন। আবিষ্কৃত হয় যে, তৎকালীন ধারণার বিপরীতে, অ্যাক্টিনিয়ামের পরবর্তী মৌলগুলো ট্রানজিশন মৌল নয়, বরং ল্যান্থানাইডের সদস্য। বাসেট (১৮৯২), ওয়ার্নার (১৯০৫), এবং ফরাসি প্রকৌশলী চার্লস জেনেট (১৯২৮) পূর্বে এই ধারণা দিয়েছিলেন, কিন্তু তখন তা সার্বজনীনভাবে স্বীকৃতি পায়নি। সিবার্গ তাই তাদের অ্যাক্টিনাইড বলে অভিহিত করেছিলেন। ১৯৫৫ সাল পর্যন্ত ১০১ পর্যন্ত নম্বরের মৌলগুলি (মেন্ডেলিভের সম্মানে যার নাম দেওয়া হয়েছিল মেন্ডেলিভিয়াম) নিউট্রন বা আলফা-কণার তেজস্ক্রিয়তা দ্বারা তৈরি করা হয়েছিল, বা ৯৯ (আইনস্টাইনিয়াম) এবং ১০০ (ফার্মিয়াম) মৌলের ক্ষেত্রে পারমাণবিক বিস্ফোরণের মাধ্যমে সৃষ্টি করতে হয়েছিল।
১৯৬০ এবং ১৯৭০-এর দশকে ১০২ থেকে ১০৬ পর্যন্ত মৌলগুলি নিয়ে একটি উল্লেখযোগ্য বিতর্কের সৃষ্টি হয়। কারণ LBNL টিম (এবার নেতৃত্বে ছিলেন অ্যালবার্ট ঘিওরসো) এবং সোভিয়েত বিজ্ঞানীদের যৌথ পারমাণবিক গবেষণা ইনস্টিটিউট (JINR)-এর একটি দলের মধ্যে প্রতিযোগিতা শুরু হয় (যার নেতৃত্বে ছিলেন জর্জি ফ্লায়েরভ)। প্রতিটি দল আবিষ্কারের দাবি করেছিল, এবং কিছু ক্ষেত্রে প্রত্যেকে মৌলটির জন্য নিজস্ব নাম প্রস্তাব করেছিল। এর ফলে দশকব্যাপী একটি মৌলের নামকরণ নিয়ে বিতর্কের সৃষ্টি হয়েছিল। এই উপাদানগুলি লাইট আয়ন দিয়ে অ্যাক্টিনাইডগুলিকে আঘাত করে তৈরি করা হয়েছিল। IUPAC প্রথমে একটি নিরপেক্ষ অবস্থান গ্রহণ করেছিল, এটা দেখতে অপেক্ষা করতে পছন্দ করে যে কোনো ঐকমত্য আসে কিনা। কিন্তু যেহেতু তখন শীতল যুদ্ধও তুঙ্গে ছিল, তাই এটা স্পষ্ট হয়ে গেল যে ঐকমত্য আসবে না। এভাবে, IUPAC এবং ইন্টারন্যাশনাল ইউনিয়ন অফ পিওর অ্যান্ড অ্যাপ্লায়েড ফিজিক্স (IUPAP) একটি ট্রান্সফারমিয়াম ওয়ার্কিং গ্রুপ (TWG, ফার্মিয়াম হলো ১০০ নম্বর মৌল) ১৯৮৫ সালে আবিষ্কারের মানদণ্ড নির্ধারণের জন্য প্রতিষ্ঠিত হয়। এই মানদন্ড ১৯৯১ সালে প্রকাশিত হয়েছিল। কিছুটা বিতর্কের পর ১৯৯৭ সালে সর্বশেষে মৌলগুলো তাঁদের চূড়ান্ত নাম পায়, যার মধ্যে ছিল সিবার্গের সম্মানে নামকরণ করা সিবোর্গিয়াম (১০৬)।

TWG-এর নির্দিষ্ট মাপকাঠি LBNL এবং JINR-এর মতো গবেষণা প্রতিষ্ঠানের নতুন মৌল আবিষ্কারের দাবির মধ্যস্থতা করতে ব্যবহার করা হয়েছিল। এছাড়াও জার্মানি (GSI) এবং জাপানের (Riken) প্রতিষ্ঠানের দাবিগুলোর ক্ষেত্রেও এগুলো ব্যবহৃত হয়। বর্তমানে, আবিষ্কারের দাবি যাচাইয়ের কাজটি IUPAC/IUPAP যৌথ কর্মীদল দ্বারা পরিচালিত। অগ্রাধিকার দেওয়ার পরে, মৌলগুলিকে আনুষ্ঠানিকভাবে পর্যায় সারণিতে যুক্ত করা হয়েছিল, এবং আবিষ্কর্তাদের নাম প্রস্তাব করার জন্য আমন্ত্রণ জানানো হয়েছিল। ২০১৬ সালের মধ্যে, ১১৮ পর্যন্ত সমস্ত মৌলের জন্য এই প্রক্রিয়া সম্পন্ন হয়, যার ফলে পর্যায় সারণির প্রথম সাতটি সারি সম্পূর্ণ হয়। ১০৬-এর বেশি মৌলের আবিষ্কার সম্ভব হয়েছিল JINR-এ ইউরি ওগানেসিয়ান দ্বারা তৈরি কৌশলের কারণে। শীতল ফিউশন (ভারী আয়ন দিয়ে সীসা এবং বিসমাথের উপর বোমাবর্ষণ) ১৯৮১-২০০৪ সালে GSI-তে ১০৭ থেকে ১১২ পর্যন্ত মৌলের আবিষ্কারকে সম্ভব করে তোলে। এছাড়াও Riken-এ মৌল ১১৩ এর আবিষ্কার সম্ভব হয়। তিনি (আমেরিকান বিজ্ঞানীদের সাথে সহযোগিতায়) JINR দলকে ১৯৯৮-২০১০ সালে ১১৪ থেকে ১১৮ পর্যন্ত মৌল আবিষ্কারে নেতৃত্ব দেন। এতে ব্যবহৃত হয় গরম ফিউশন (ক্যালসিয়াম আয়ন দ্বারা অ্যাক্টিনাইডের উপর বোমাবর্ষণ)। সবচেয়ে ভারী পরিচিত মৌল, ওগানেসন (১১৮), ওগানেসিয়ানের সম্মানে নামকরণ করা হয়েছে। মৌল ১১৪-কে তার পূর্বসূরী এবং পরামর্শদাতা ফ্লিওরভের সম্মানে ফ্লেরোভিয়াম নামে নামকরণ করা হয়।
পর্যায় সারণির ১৫০তম বার্ষিকী উপলক্ষে, জাতিসংঘ ২০১৯ সালকে আন্তর্জাতিক পর্যায় সারণি বর্ষ হিসেবে ঘোষণা করেছে, যা "বিজ্ঞানের অন্যতম গুরুত্বপূর্ণ অর্জন" উদযাপন করে। TWG-এর তৈরি আবিষ্কারের মাপকাঠি ১৯৯১ সালে যেসব পরীক্ষামূলক এবং তাত্ত্বিক অগ্রগতির কথা কল্পনাও করা যায়নি, সেগুলোর প্রেক্ষিতে ২০২০ সালে আপডেট করা হয়েছে। আজ, পর্যায় সারণি রসায়নের অন্যতম স্বীকৃত প্রতীক। নতুন মৌলের স্বীকৃতি এবং নামকরণ, গ্রুপ নম্বর এবং সমষ্টিগত নামগুলি সুপারিশ করা, পারমাণবিক ভর আপডেট করা, এইসব কাজের সাথে আজ IUPAC জড়িত।
Remove ads
সপ্তম পর্যায়ের পরবর্তী সম্প্রসারণ
সারাংশ
প্রসঙ্গ

সর্বশেষ যেসব মৌলের নামকরণ হয়েছে– নিহোনিয়াম (113), মস্কোভিয়াম (115), টেনেসিন (117), and ওগানেসন (118)– সেগুলো পর্যায় সারণীর সপ্তম সারিটি পূর্ণ করেছে। এরপরের মৌলগুলো অষ্টম সারি থেকে শুরু হবে। এই মৌলগুলোকে হয়তো তাদের পারমাণবিক সংখ্যা দিয়ে (যেমন, "মৌল 119"), অথবা 1978 সালে প্রবর্তিত IUPAC নিয়মানুসারে তৈরি নাম দিয়ে (যেমন, মৌল 119-এর নাম ununennium, যা ল্যাটিন unus "one", গ্রিক ennea "nine", এবং ধাতব মৌলের ঐতিহ্যবাহী -ium প্রত্যয় থেকে এসেছে) উল্লেখ করা হবে। এ পর্যন্ত এধরনের মৌল সংশ্লেষণের সকল প্রচেষ্টা ব্যর্থ হয়েছে। Riken গবেষণা প্রতিষ্ঠানে ২০১৮ সাল থেকে মৌল 119 তৈরির প্রচেষ্টা চলমান রয়েছে। মার্কিন যুক্তরাষ্ট্রের LBNL এবং রাশিয়ার JINR প্রতিষ্ঠানদ্বয় অষ্টম পর্যায়ের প্রথম কয়েকটি মৌল সংশ্লেষণের নিজস্ব প্রচেষ্টা চালানোর পরিকল্পনা করেছে।
অষ্টম পর্যায় যদি পূর্ববর্তী পর্যায়গুলোর ধারার অনুসরণ করে, তাহলে এতে পঞ্চাশটি মৌল থাকবে, যেগুলো ক্রমান্বয়ে 8s, 5g, 6f, 7d, এবং শেষে 8p উপকক্ষগুলো পূর্ণ করবে। কিন্তু এক্ষেত্রে আপেক্ষিকতার প্রভাবগুলো ম্যাডেলাং নীতিকে তাৎপর্যপূর্ণভাবে প্রভাবিত করবে। অষ্টম পর্যায়ের মৌলসমূহের ইলেকট্রন বিন্যাস এবং পর্যায় সারণীতে তাদের কীভাবে দেখানো হবে সে ব্যাপারে বিভিন্ন মডেল প্রস্তাব করা হয়েছে। এইসব মডেল একমত যে, পূর্ববর্তী পর্যায়গুলোর মতোই অষ্টম পর্যায় দুটি 8s মৌল (119 এবং 120) দিয়ে শুরু হবে। যাইহোক, তারপরে 5g, 6f, 7d, এবং 8p উপকক্ষগুলোর মধ্যে ব্যাপক শক্তিগত অধিক্রমণের ফলে সেগুলো একসাথে পূর্ণ হতে শুরু করবে। ফলে 5g, 6f সারিগুলোকে সুনির্দিষ্টভাবে আলাদা করা বেশ জটিল হয়ে যাবে। তাই 121 থেকে 156 পর্যন্ত মৌলগুলি পর্যায় সারণীর পূর্ববর্তী অংশে থাকা কোনও মৌলের রাসায়নিক সাদৃশ্য প্রকাশ করে না, যদিও তাদের ইলেক্ট্রন বিন্যাস প্রতিফলিত করার জন্য কখনো কখনো 5g, 6f এবং অন্যান্য সারিতে স্থাপন করা হয়। এরিক শেরি প্রশ্ন তুলেছেন – এইসব ব্যতিক্রম উপেক্ষিত হবে নাকি বিস্তৃত পর্যায় সারণী তৈরির সময় এখানে ম্যাডেলাং নীতির ব্যর্থতাকেও হিসেবে নেওয়া হবে। এই অঞ্চলে উপকক্ষের গঠনও হয়তো আনুষ্ঠানিকভাবে নির্ধারিত হবে। ধারণা করা হচ্ছে, কোনো সুনির্দিষ্ট উপকক্ষের গঠন না থাকায় ওগানেসন পরমাণুর ইলেক্ট্রন বিন্যাস বেশ অভিন্ন হবে।
১৫৭ থেকে ১৭২ পর্যন্ত মৌলের রাসায়নিক বৈশিষ্ট্য সম্ভবত পর্যায় সারণির শুরুর দিকের সারিগুলির সাথে মিল দেখাবে। এই পরিবর্তনের কারণ হলো ভারী p-শেলগুলো স্পিন-অরবিট মিথস্ক্রিয়ার দ্বারা বিভক্ত হয়ে যায়। একই ধরণের পরিবর্তন সব ধরনের শেলের জন্য ঘটলেও p-শেলগুলোর ক্ষেত্রে এটি সবচেয়ে বড় পার্থক্য তৈরি করে। ১৫৭ নম্বর মৌলের ক্ষেত্রে সম্ভবত পূর্ণ 8s এবং 8p1/2 শক্তিস্তরগুলো মূল/কোরের সাথে যুক্ত হয়ে গেছে। এরপরের কক্ষপথগুলোর শক্তি কাছাকাছি - যেমন 7d ও 9s একই রকম শক্তির, তারপর আছে 9p1/2 এবং 8p3/2, এরপর একটি বড় শক্তির ফাঁক। সুতরাং, 9s এবং 9p1/2 কক্ষপথগুলি মূলত 8s এবং 8p1/2 শক্তিস্তরের স্থান নেয়। তাই, মৌল ১৫৭-১৭২ সম্ভবত রাসায়নিকভাবে ৩ থেকে ১৮ গ্রুপের মৌলের অনুরূপ হবে। উদাহরণস্বরূপ, মৌল ১৬৪ সাধারণ নিয়মে ১৪ নম্বর গ্রুপে সীসার (lead) দুই ঘর নিচে থাকার কথা থাকলেও, হিসেব অনুযায়ী এটি ১০ নম্বর গ্রুপে প্যালাডিয়ামের খুব কাছাকাছি বৈশিষ্ট্য দেখাবে। এইভাবে, পরবর্তী নিষ্ক্রিয় গ্যাসের দেখা পেতে ১১৮ এর পরে ৫০ এর পরিবর্তে ৫৪ টি মৌলের প্রয়োজন হবে। মৌল ১৫৭ থেকে ১৭২ এর রাসায়নিক বৈশিষ্ট্য নিয়ে মডেলগুলোর মধ্যে একমত থাকলেও, পর্যায় সারণিতে রাসায়নিক সাদৃশ্যের ভিত্তিতে মৌল সাজানো উচিত, নাকি ইলেকট্রন বিন্যাসের উপর ভিত্তি করে সাজানো উচিত (যা আগের পর্যায়গুলো থেকে বেশ আলাদা) - তা নিয়ে মতবিরোধ রয়েছে। তাই পর্যায় সারণির অষ্টম সারির আসল বিন্যাস নিয়ে আলোচনা অব্যাহত রয়েছে।
মৌল ১৭২-এর পরে, 1s ইলেকট্রনের শক্তিস্তর কাল্পনিক হয়ে যায়, যা গণনাগুলোকে জটিল করে তোলে। এই অবস্থাটির একটি বাস্তব ব্যাখ্যা রয়েছে, এবং এর মানে এই না যে পর্যায় সারণি সেখানেই থেমে যাবে। তবে মৌলের হিসাব করার জন্য এই ধরণের অবস্থা সঠিকভাবে বহু-ইলেকট্রন গণনায় অন্তর্ভুক্ত করার উপায় এখনও একটি উন্মুক্ত সমস্যা। এটির সমাধান পর্যায় সারণির কাঠামো আরও বড় মৌলের জন্য নির্ণয় করতে প্রয়োজন হবে।
পরমাণুর নিউক্লিয়াসের প্রোটনের মধ্যকার বিকর্ষণ বল এবং প্রোটন ও নিউট্রনকে একসাথে আবদ্ধ রাখা শক্তিশালী নিউক্লিয় বলের ভারসাম্য - এই দুটি বিষয় নিউক্লিয়ার স্থিতিশীলতাকে প্রভাবিত করে। ইলেকট্রনের মতোই প্রোটন এবং নিউট্রনও নির্দিষ্ট শক্তিস্তরে বা শেলে অবস্থান করে। একটি পরিপূর্ণ শেল নিউক্লিয়াসের স্থিতিশীলতা উল্লেখযোগ্যভাবে বাড়াতে পারে। এমন একটি পরিপূর্ণ শেলের কারণেই সম্ভবত ১১৪-১২৬ টি প্রোটন এবং ১৮৪ টি নিউট্রন-সমৃদ্ধ সুপারহেভি নিউক্লাইডগুলোর অস্তিত্ব আছে। এই সুপারহেভি নিউক্লাইডগুলো হয়তো 'দীর্ঘায়ু দ্বীপ' বা 'island of stability' এর কাছাকাছি অবস্থান করে। এই 'আইল্যান্ড অফ স্টেবিলিটি' তে তুলনামূলক বেশি দীর্ঘজীবী সুপারহেভি নিউক্লাইডের অস্তিত্ব থাকার কথা। এই দীর্ঘজীবী নিউক্লাইডগুলোর আয়ুষ্কাল মাইক্রোসেকেন্ড থেকে কয়েক মিলিয়ন বছর পর্যন্ত হতে পারে বলে ধারণা করা হচ্ছে। তবে এখানে একটি গুরুত্বপূর্ণ বিষয় হলো – বিজ্ঞানীরা মূলত পরমাণুর কেন্দ্র বা নিউক্লিয়াস সম্পর্কিত তথ্যের অনুমানের উপর এসব তত্ত্ব দাঁড় করিয়েছেন। তাই এই অনুমানের যথার্থতা যাচাই করার প্রয়োজন আছে।
পরিপূর্ণ শেল অতিক্রম করার সাথে সাথে স্থিতিশীলতার প্রভাব কমে যেতে পারে। ফলে, ১৮৪টির বেশি নিউট্রনযুক্ত সুপারহেভি নিউক্লাইডের আয়ুষ্কাল অনেক কম হবে। এগুলো সম্ভবত ১০^-১৫ সেকেন্ডের মধ্যেই স্বতঃস্ফূর্তভাবে বিভাজিত (spontaneous fission) হয়ে যাবে। যদি তাই হয়, তবে এগুলোকে মৌল হিসেবে বিবেচনা করা যৌক্তিক হবে না। IUPAC (ইন্টারন্যাশনাল ইউনিয়ন অফ পিওর অ্যান্ড অ্যাপ্লায়েড কেমিস্ট্রি) একটি পরমাণুকে মৌল হিসেবে বিবেচনা করার জন্য এর নিউক্লিয়াসের আয়ুষ্কাল কমপক্ষে ১০^-১৪ সেকেন্ড ধরে রাখার শর্ত দিয়েছে। এই সময়ের মধ্যে নিউক্লিয়াসকে একটি ইলেকট্রন ক্লাউড বা মেঘ দ্বারা বেষ্টিত হতে হয়। তবে নিউক্লীয় আয়ুষ্কাল সম্পর্কিত তাত্ত্বিক অনুমানগুলো অনেকটাই মডেলের উপর নির্ভরশীল, যার ফলে অনুমিত আয়ুষ্কালের মধ্যে ব্যাপক পার্থক্য দেখা যায়। প্রোটনগুলোর পারস্পরিক বিকর্ষণের ফলে নিউক্লিয়াসের গঠন বুদবুদ, বলয় এবং টরাসের মতো অদ্ভুত আকার ধারণ করতে পারে বলে ধারণা করা হচ্ছে, যা আরও জটিলতা তৈরি করে। অপরদিকে অগনেসনের ইলেকট্রন শেলের মতো নিউক্লিয়ার শেলগুলোতে একটি অনিশ্চয়তা তৈরি হচ্ছে, যার ফলে পরবর্তী শেলগুলো আদৌ অস্তিত্বশীল কিনা তা নিয়েও প্রশ্ন দেখা দিচ্ছে। এছাড়া, যদি পরবর্তী শেলগুলোর অস্তিত্ব থাকেও, সেগুলোর কারণে ভারী মৌলগুলোর আয়ুষ্কাল বাড়বে কিনা তা-ও নিশ্চিত নয়। তাই, ধারণা করা হচ্ছে ১২০ নম্বরের মৌলের পরেই পর্যায় সারণি শেষ হয়ে যেতে পারে। কারণ, ১২০ এর পর মৌলগুলো তাদের অস্থিতিশীলতার কারণে পর্যবেক্ষণ করা যাবে না। খুব অল্প সময়ের মধ্যেই এগুলোর পতন ঘটবে, যার ফলে এগুলোর রসায়ন পর্যালোচনা অসম্ভব হবে। নতুন মৌল আবিষ্কারের যুগও সমাপ্তির দিকে এগিয়ে যেতে পারে। যদি ১২৬ এর বেশি প্রোটন-বিশিষ্ট কোনো পরিপূর্ণ শেলের অস্তিত্ব থাকে, তবে সম্ভবত সেটি ১৬৪ এর কাছাকাছি হবে। ফলে অস্থিতিশীল মৌলগুলো এই শেলের দুই পাশে অবস্থান করবে যেখানে পর্যায়বদ্ধতার বৈশিষ্ট্য আর কাজ করবে না।
তবে 'কোয়ার্ক ম্যাটার'-ও উচ্চ পারমাণবিক ভর-এ স্থিতিশীল হতে পারে। কোয়ার্কে মৌলের নিউক্লিয়াসে প্রোটন এবং নিউট্রন থাকার পরিবর্তে মুক্তভাবে প্রবহমান 'আপ' ও 'ডাউন' কোয়ার্ক থাকতে পারে। তাহলে 'island of stability' বা দীর্ঘায়ু দ্বীপের পরিবর্তে একটি 'continent of stability' বা 'দীর্ঘায়ু মহাদেশ' তৈরি হতে পারে। তাছাড়া আরো নানা কারণ প্রভাব ফেলতে পারে।
অষ্টম সারির মৌলের অস্তিত্ব থাকলেও সেগুলো তৈরি করা খুবই কঠিন হবে এবং পারমাণবিক সংখ্যা বাড়ার সাথে সাথে এটা আরো জটিল হয়ে যাবে। বর্তমানে আমাদের যে প্রযুক্তি আছে, তা দিয়ে ১১৯ এবং ১২০ নম্বরের মৌল পর্যন্ত তৈরি করা সম্ভব হতে পারে। এরপরের মৌলগুলো উৎপাদনে সম্ভবত সম্পূর্ণ নতুন প্রযুক্তির প্রয়োজন হবে – যদি উৎপাদনটা আদৌ সম্ভব হয়! এসব মৌলের রাসায়নিক বৈশিষ্ট্যগুলো পরীক্ষামূলকভাবে ব্যাখ্যা করাও একটি বিশাল চ্যালেঞ্জ হবে।
Remove ads
বিকল্প পর্যায় সারণী
সারাংশ
প্রসঙ্গ

পর্যায় সূত্র অনেকভাবে প্রকাশ করা যেতে পারে, এবং প্রচলিত পর্যায় সারণী এর একটি মাত্র রূপ। ১৮৬৯ সালে মেন্ডেলিফের পর্যায় সারণীর আবির্ভাবের ১০০ বছরের মধ্যে, এডওয়ার্ড জি মাজুরস আনুমানিক ৭০০টি ভিন্ন ধরণের প্রকাশিত পর্যায় সারণী সংগ্রহ করেছিলেন। অনেকগুলি রূপই আয়তাকার কাঠামো বজায় রাখে, যার মধ্যে রয়েছে চার্লস জেনেটের বাম-ধাপের পর্যায় সারণী (নীচের ছবিতে), এবং মেন্ডেলিফের মূল ৮-স্তম্ভ বিন্যাসের আধুনিকীকরণ যা রাশিয়ায় এখনও প্রচলিত। অন্যান্য কিছু পর্যায় সারণীর আকার অনেক বেশি আকর্ষণীয়, যেমন সর্পিল (ডানদিকের ছবিতে অটো থিওডর বেনফির সারণী), বৃত্তাকার বা ত্রিভুজাকার।
মৌলিক উপাদানগুলোর রাসায়নিক বা ভৌত বৈশিষ্ট্যগুলিকে আরও পরিষ্কারভাবে উপস্থাপনের লক্ষ্যে প্রায়শই বিকল্প পর্যায় সারণী তৈরি করা হয়। বিকল্প সারণিগুলিতে রসায়ন বা পদার্থবিজ্ঞানের প্রাধান্য দেওয়া হয়। প্রচলিত রূপটি, যা সর্বাধিক জনপ্রিয়, তা মোটামুটিভাবে মাঝামাঝি অবস্থানে রয়েছে।
পর্যায় সারণীর বিভিন্ন রূপ থেকে কিছু প্রশ্নের উদ্ভব হয়েছে - সর্বোত্তম বা চূড়ান্ত পর্যায় সারণী আছে কিনা, এবং থাকলে তা কেমন হতে পারে। এইসব প্রশ্নের জন্য বর্তমানে কোনো সর্বসম্মত উত্তর নেই। পর্যায় সারণীর সর্বোত্তম বা মৌলিক রূপ হওয়ার জন্য জ্যানেটের বাম-ধাপের সারণী সম্পর্কে ক্রমবর্ধমান আলোচনা হচ্ছে। এরিচ সেরি এটির পক্ষে লিখেছেন, কারণ এটি হিলিয়ামকে একটি s-ব্লক উপাদান হিসেবে উপস্থাপন করে। এই সারণী সকল বিভাগের দৈর্ঘ্যের পুনরাবৃত্তি করে আরও নিয়মতান্ত্রিক হয়, এবং প্রতিটি বিভাগকে 'n + ℓ' এর একটি মানের সাথে সম্পর্কিত করে ম্যাডেলং-এর নিয়ম সঠিকভাবে অনুসরণ করে।
যদিও তিনি মনে করেন ক্ষারীয় মৃত্তিকা ধাতুগুলির উপরে হিলিয়ামের অবস্থানকে রাসায়নিক দৃষ্টিকোণ থেকে একটি অসুবিধা হিসাবে দেখা যেতে পারে, তবুও প্রথম-সারির ব্যতিক্রমের দিকটি উল্লেখ করে তিনি এর পাল্টা যুক্তি দেন। তিনি দেখান যে পর্যায় সারণী "মৌলিকভাবে কোয়ান্টাম বলবিজ্ঞানের ওপর নির্ভরশীল" এবং মৌলগুলোর বিমূর্ত ধর্মাবলী (আণবিক ধর্মের পরিবর্তে) বিবেচনা করে।
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |||
| 1s | H | He | ||||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra | ||
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn | ||
| f-block | d-block | p-block | s-block | |||||||||||||||||||||||||||||||
Remove ads
আরও দেখুন
তথ্যসূত্র
গ্রন্থপঞ্জি
আরও পড়ুন
বহিঃসংযোগ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





