トップQs
タイムライン
チャット
視点
染色体
遺伝情報の発現と伝達を担う生体物質 ウィキペディアから
Remove ads
染色体(せんしょくたい、英: Chromosome、独: Chromosom)は、遺伝物質(ゲノム)を担う細胞内構造体であり、主としてデオキシリボ核酸(DNA)およびヒストンを中心とする各種タンパク質から構成される。DNAは、生命活動の維持や形質の遺伝的継承に関与する遺伝情報を保持している。

真核生物においては、染色体は細胞核内に格納されている。細胞周期の中期に至ると、核膜が一時的に消失し、染色体は高密度に凝縮する。この結果、個々の染色体を光学顕微鏡で識別可能な状態となる。一方、間期においては染色体は凝縮を解き、分散した状態となり、全体としてクロマチン(chromatin)と総称される構造を形成する。核内に含まれる染色体の本数は生物種により固有であり、たとえばヒトの場合、通常は2倍体であり、核型には46本の染色体(2n = 46,XXまたは46,XY)が含まれる。
真核細胞(植物、菌類、動物、ヒトも含む真核生物の細胞)には、核内染色体DNAに加え、ミトコンドリアや色素体などの細胞小器官にも独自のDNAが存在する。これらのDNAは多くの場合環状構造をとり、それぞれミトコンドリアDNA(mtDNA)や葉緑体DNA(cpDNA)と呼ばれる。
一方で、原核生物(例:細菌)には、明確な細胞核や典型的な染色体構造は存在しない。原核生物のDNAも通常は環状であり、この構造体は文脈によっては細菌染色体とも呼ばれることもある。
Remove ads
語源
染色体「Chromosom」という語は、古代ギリシャ語の χρῶμα(chrōma、「色」)および σῶμα(sōma、「体」)に由来する[1][2]。この名称は、細胞核内の構造が染色によって強く染まる性質に基づき、19世紀にドイツの解剖学者によって命名されたものである[3]。
顕微鏡による観察


下段: 上段画像と同じ焦点面に対応し、コンピュータ解析によって染色体テリトリーを識別・分類し、疑似色で視覚化したもの[5]。
「染色体(独: Chromosom)」という語は、「色素体(独: Farbkörper)」を意味し、塩基性色素で容易に染色されるクロマチン構造の性質を反映している。通常、染色体は光学顕微鏡で観察可能だが、これは特殊な検出方法を用いない限り、細胞核の分裂時に限られる。
分裂期に入ると、ヒトをはじめ多くの真核生物の染色体は棒状に凝縮し、有糸分裂や減数分裂の前期にその形態を取る。中期には、これらの凝縮した染色体が細胞の赤道面に整列する。この段階で、各染色体は、複製された2つの同一の染色分体(chromatid)から構成され、互いに平行して配置されている。各染色分体は、1本の連続したDNA二重らせんを内包する。後期には、染色体を構成していた2つの染色分体が分離され、それぞれが娘核に分配される。終期には核膜が再形成され、核分裂が完了する。
核分裂の終了後、染色体は再び脱凝縮(decondensation)し、クロマチン状態へ戻る。この状態において、DNAの転写や複製のような遺伝情報の読み取りが可能になる。
従来の染色法では、脱凝縮したクロマチンは連続的な構造として観察されるため、各染色体の区別は困難である。しかし、蛍光 in situ ハイブリダイゼーション法(fluorescence in situ hybridization、FISH)などの分子生物学的手法を用いることで、間期における各染色体を別個に識別することが可能となった[6]。間期細胞の核内では、それぞれの染色体が「染色体テリトリー(chromosome territory)」と呼ばれる空間的に区画された領域を占めている[7]。
Remove ads
研究の歴史
要約
視点
染色体の命名と初期の概念
「染色体(Chromosomen)」という用語は、1888年にドイツの解剖学者ハインリッヒ・ヴィルヘルム・ヴァルダイエルによって提唱された[8]。これに先立ち、1880年代前半にはヴァルター・フレミングが、細胞核内に存在する染色されやすい物質に対し「クロマチン(Chromatin)」という語を導入している[9]。1906年には、オスカー・ヘルトヴィヒが、「核分裂の過程でクロマチンが区画に分割される」ことを説明するため、「Kernsegmente(仮訳:核分節構造)」という語を使用した。同時期には、「Kernschleife(仮訳:核ループ構造)」という語も染色体(Chromosom)と並行して使われており、カール・ハイダーも1906年に採用している。
顕微鏡による細胞核と染色体の可視化
染色体の発見と研究の歴史は、細胞核に関する知見の蓄積と不可分である。1842年、スイスの植物学者カール・ヴィルヘルム・フォン・ネーゲリは、植物細胞の核内に観察された染色性の棒状構造を「transitorische Zytoblasten(仮訳:過渡的な細胞芽球)」と記述した[10]。現在の知見に基づけば、これは染色体に相当する可能性が高いと考えられている。その後、複数の研究者によって核構造に関する図版や記述が発表された。たとえば、マティアス・シュライデン(1846年)、ルドルフ・フィルヒョウ(1857年)、オットー・ビュッチュリ(1873年)らの報告には、染色体または有糸分裂の過程と解釈可能な記述が含まれている。

1873年、アントン・シュナイダーは扁形動物の細胞核を観察し、核分裂の様相を次のように報告した。『酢酸を加えることで、細かく渦巻く糸状の塊が現れ、それは次第に太い糸に変化する。最初は不規則であったその構造は、やがて赤道面上にロゼット状に配列する』。この観察は、「indirekte Kernteilung(仮訳:間接分裂。現在の有糸分裂)」の過程を初めて詳細に記述したもののひとつであるが、当時はその意義や機構は理解されていなかった。
1882年、ヴァルター・フレミングは、核分裂の初期段階において「Kernfäden(仮訳:核の繊維状構造)」が連続した糸から分離して形成されると報告した。さらに彼は、現在の中期に相当する段階で、染色体が縦方向に分割される様子や、後期に相当する時点で両方の染色分体が新しい細胞核へ移動する過程を観察した。また、フレミングは、場合によっては細胞核が新たに形成される可能性も示唆している。1884年には、L. Guignard、Emil Heuser、エドゥアール・ファン・ベネデンらが、染色体の半数(現在でいう染色分体)が娘細胞核に正確に分配される様子を記述している。
染色体の個体性保存説
間期において染色体が可視化されないことから、核分裂のたびに染色体は分解・再編成されるのか、あるいは核内に独立した構造として存続するのかが19世紀末まで不明であった。この問題に対して、カール・ラブルは1885年、「染色体の個体性保存説」を提唱した。彼は、有糸分裂を経た後も染色体が間期の核内に存在し続けると主張し、同一組織内に属する細胞では染色体数が一定であることを初めて明示した。ラブルはまた、間期の核内において各染色体が固有の領域を形成しているとする考え(染色体テリトリー説)を初めて提案した。ただし当初は、組織によって染色体数が異なる可能性もあるとの立場を取っていた。
この説に対しては異論もあり、代表的な反対者はオスカー・ヘルトヴィヒであった(1890年、1917年)。一方、染色体研究を進めていたテオドール・ボヴェリ (de:ドイツ語版) は、1890年代よりラブルの説を支持し、1904年および1909年の研究によってこれを実験的に裏付けている[11]。
生殖質説と染色体の遺伝機能
1880年代には、アウグスト・ヴァイスマンが「生殖質説を提唱し、遺伝物質は主として染色体に存在するとの仮説を立てた。彼は、遺伝は生殖細胞系列によってのみ伝播され、獲得形質は遺伝しないと主張した。この説は後に広く受け入れられるが、当時は激しい議論を呼んだ。たとえば1888年版『Meyers Konversations-Lexikon』(マイヤー百科事典-レキシコン)の「Erblichkeit(遺伝)」の項目では、同説に対する厳しい批判が記されている[12]。
遺伝学の誕生と染色体説の確立
1900年、グレゴール・メンデルによる遺伝の法則が再発見されると、遺伝現象に関する研究が一気に進展した。1910年には、トーマス・ハント・モーガンがショウジョウバエ(Drosophila melanogaster)を用いた実験により、染色体が遺伝子の担い手であることを示した。これにより「遺伝の染色体説」が確立され、染色体と遺伝の関係が科学的に裏付けられた。
さらに1944年、オズワルド・アベリーは、形質転換実験により、遺伝情報の本体が染色体内のタンパク質ではなくDNAであることを初めて明示した。
以降、ジェームズ・ワトソンとフランシス・クリックによるDNA構造の解明(1953年)に至るまでの詳細は、別項「染色体説#年表」および「クロマチン (de:ドイツ語版) 」に詳述されている。
ゲノム研究と人工染色体
2000年、国際的な研究コンソーシアムによってヒトゲノムの大部分が解読され、2003年までにその99 %以上の配列が明らかとなった。さらに、2005年から2006年にかけては、24本のヒト染色体のうち最後まで残っていた1番染色体の解読がほぼ完了し(解読率99.99 %)、イギリスやアメリカの160人以上の研究者がこの成果に貢献した[13]。
2014年には、パン酵母(Saccharomyces cerevisiae)を用いた実験により、初めて合成染色体の設計と構築が成功した[14][15]。これにより、染色体の理解は分子生物学と合成生物学の両面で新たな段階へ進展した[16]。
Remove ads
染色体の構成と構造
要約
視点
染色体の基本構造と機能的領域
基本構造

1 2つの染色分体のうちの1つ
2 セントロメア (2つの染色分体が連結する領域。有糸分裂の際、微小管が結合する)。
3 短腕 (p腕)
4 長腕 (q腕)

染色体は、基本的に1本の連続した二本鎖DNAから構成される( § 巨大染色体などの例外を除く)。このDNAは、2本の一本鎖が相補的な塩基対によって結合した二重らせん構造をとる。通常、この構造体は1つの「DNA分子」として取り扱われる(参照:デオキシリボ核酸)。
このDNA分子は、ヒストン(英: histone)などのタンパク質と結合し、クロマチン(英: chromatin)と呼ばれる複合体を形成する[17]。DNAがタンパク質とともにパッケージングされることで、1本の二本鎖DNAから1つの染色分体が形成される。この状態にある染色体は、1つの染色分体からなる。
単一の染色分体からなる染色体は、細胞分裂直後の細胞や、分裂能を失った細胞(例:大多数の体細胞。ただし多糸染色体を持つ昆虫などは例外)、あるいはG0期にある休止状態の細胞で観察される。
染色体の複製と姉妹染色分体の形成
細胞周期のS期に移行すると、染色体を構成するDNAは複製され、同一の二本鎖DNAが2本生成される[17]。これらはそれぞれタンパク質と結合して個別にパッケージングされ、2つの染色分体が形成される。この2本は姉妹染色分体と呼ばれる[17]。
姉妹染色分体は、セントロメア(英: centromere)と呼ばれる領域で連結されており[17]、この部分は他の領域よりも幅が狭く、顕微鏡下で明瞭に識別できる。細胞分裂の中期には、姉妹染色分体が狭い間隙を介して並列に配置された構造体として観察される(参照:右図および「 § ヒト女性のリンパ球細胞由来の中期染色体」の図)。
細胞分裂が中期から後期へ進行すると、姉妹染色分体はセントロメア部で分離され、それぞれが娘染色体として2つの娘核へと分配される(参照: § 通常の核分裂(有糸分裂)における染色体)[18]。分裂終了後、各娘核内の染色体は再び1本の染色分体からなる状態に戻る。
このように、染色分体は常に1本の二本鎖DNAを含み、染色体は細胞周期の段階に応じて、1つまたは2つの染色分体から構成される。ただし、例外として、1,000本以上の二本鎖DNAを含む多糸染色体などの特殊な構造も存在する。
染色体の形態的特徴と分類
1つの染色分体は、セントロメアを境にして「2つの腕」に分けられる。セントロメアの位置に基づき、染色体は次のように分類される[19]。
- メタセントリック型: セントロメアが染色体の中央に位置し、短腕(p腕)と長腕(q腕)の長さがほぼ等しい。
- サブメタセントリック型: セントロメアが中央よりも末端寄りに偏位し、p腕とq腕の長さに明確な差がある。
- アクロセントリック型: セントロメアが末端近くに位置し、短腕が非常に短い。ヒトにおいては、13、14、15、21、22番染色体およびY染色体がこの型に分類される。
染色体の短い腕はp腕(p-Arm、仏: petit、「小さな」)、長い腕はq腕(q-Arm、仏: queue、「尾」)と呼ばれる[20]。染色体を模式図として図示する際には、p腕を上、q腕を下に配置するのが一般的である。
染色体の末端構造と特異領域
染色体の両端はテロメア(英: telomere)と呼ばれる[21]。ヒトの場合、テロメアは「TTAGGG」という短いDNA配列が多数繰り返される[22]。この反復配列は染色体が複製されるたびに短縮され、このため、テロメアは細胞老化や分裂寿命の制限に関与していると考えられている[23]。
染色体の基本構造には、テロメアおよびセントロメアに加えて、DNA複製の起点であるレプリコンが含まれる。レプリコン領域には、自己複製配列(autonomously replicating sequence)など、DNA複製に関連する機能的配列が含まれている。
さらに、ヒトのアクロセントリック染色体の短腕には、リボソームRNA(rRNA)遺伝子が高密度で存在する。これらは同一配列が同方向に繰り返されるタンデムリピート構造を形成している。中期染色体においては、これら短腕の末端に二次狭窄を挟んで小さな球状の構造体が付随することがあり、これをサテライト染色体(satellite chromosome、略称:SAT染色体)と呼ぶ。なお、ここで言うサテライト染色体は、サテライトDNAとは異なる概念である。
細胞周期の間期において、これらrRNA遺伝子を含む領域の周辺には核小体が形成される。このため、この領域は核小体形成域(nucleolus organizer region、NOR)とも呼ばれる。
有糸分裂における染色体の動態
→詳細は「有糸分裂」を参照

・前期 (Prophase):姉妹染色分体が凝縮し、単一の棒状構造として認識される。
・前中期 (Prometaphase):有糸分裂の進行に伴い、染色分体が徐々に分離を始める。
・中期 (Metaphase): 染色体は、セントロメアで連結された染色分体から構成されており、ほぼ完全に識別可能となる。
・後期 (Anaphase): 姉妹染色分体が分離し、それぞれが細胞の両極へ移動する。
有糸分裂(mitosis)は、真核生物における核分裂の過程であり、遺伝情報を正確に2つの娘細胞へ分配するために不可欠である。次に、有糸分裂の各段階における染色体の挙動を示す。
- 前期(Prophase)
- 有糸分裂の開始段階にあたる前期では、核内の染色体が凝縮を開始し、顕微鏡下で観察できるようになる[17]。このとき、遺伝子の転写活性は著しく低下し、染色体は高密度な輸送形態へと変化する。同時に、核膜の部分的な崩壊が進行し、微小管の再構築が進行する[25]。これらの変化はしばしば、前中期(Prometaphase)として別個の段階に分類されることもある[25]。
- 中期(Metaphase)
- 凝縮した染色体は細胞の中央(赤道面)に整列し、中期板と呼ばれる構造を形成する。中期における各染色体は、セントロメアで連結された2つの姉妹染色分体から構成されている。細胞の両極には中心小体が位置し、そこから伸長した微小管が紡錘体を形成する。これらの微小管の一部は動原体を介して染色体に結合される[26][27]。
- 後期(Anaphase)
- 後期においては、紡錘体の作用により、各染色体の姉妹染色分体がセントロメア部で分離され、それぞれ反対方向の細胞極へと移動する[28][29]。染色体の移動は、動原体に結合した微小管が脱重合により短縮し、その張力によって進行する[30]。この段階で、移動した染色分体はそれぞれ独立した染色体として機能する[29]。
- 終期(Telophase)
- 染色体が両極に到達すると、その周囲には新たな核膜が再形成され、染色体は再びクロマチン構造へと脱凝縮する。これにより、2つの独立した娘核が形成される。終期が完了する時点では、各染色体は1本の染色分体を含む状態に戻っている[28]。
核分裂の完了後、多くの場合、細胞質分裂が続いて起こり、1個の母細胞から2個の娘細胞が生じる[28]。ただし、細胞質分裂は有糸分裂に含まれない独立した過程として扱われる。
Gバンド、Rバンド、その他のバンドパターン
| G分染法により染色されたヒト1番染色体 (分裂中期)。p腕 (画像上部) の末端に明瞭な明色領域が観察され、これは遺伝子が豊富なRバンドに対応する。同一染色体の別手法による核型との比較により、バンド構造の対応関係が確認できる。次図の1番染色体と比較されたい。本標本では、姉妹染色分体間に明瞭な隙間は認められない。 |
20世紀半ばには、分裂中期にある細胞から染色体を広げ、スライドガラス上に展開する技術が開発された。この方法により、個々の染色体を光学顕微鏡下で観察・識別できるようになった(参照: § ヒト女性のリンパ球細胞由来の中期染色体)。分裂中期における染色体は、典型的なX字型の構造を示す。従来のギムザ染色などの古典的染色法では、染色体全体が一様に染色されるため、大きさの近い染色体を識別することは困難であった。
1970年頃、染色体をトリプシンで処理した後にギムザ染色を行うことで、特定の領域が染色されずに残ることが発見された。この手法はG分染法と呼ばれ、染色された領域はGバンド(Giemsaに由来)、染色されない領域はRバンド(Reverseに由来)と呼ばれる。これらのバンドは互いに相補的であり、ヒトを含む多くの動物種において染色体の識別を可能にした。ただし、トリプシン処理によって一部の領域が染色されなくなる分子機構は、現在も完全には解明されていない。

Gバンドは、A-T塩基対に富み、遺伝子密度が相対的に低い。これらは、染色体複製の後期に複製される傾向があり、ヒトではL1エレメント(長鎖散在反復配列)が多く含まれる。一方、RバンドはG-C塩基対および遺伝子に富み、複製はより早期に開始される。Alu配列が多く分布するのもこの領域である(右図を参照)。
このほか、セントロメア領域に対応するCバンドや、テロメア近傍に存在し遺伝子密度が特に高いTバンドも知られている。TバンドはRバンドの一種とされ、名称はテロメア(telomere)に由来する。
染色体の凝縮度によって、観察されるバンドの本数は変化する。たとえば、分裂中期のヒト染色体では約400本のバンドが認められるが、凝縮がより穏やかな前期では最大850本に達する。
染色体領域の命名法
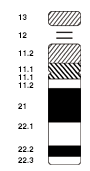
→「遺伝子座 § 命名法」も参照
ヒトを含む一部の種では、染色体の各領域を体系的に指定するために標準化された命名法が用いられている。ヒトの命名法では、各バンド名は次の要素から構成される[31]。
- 染色体番号(例:3)
- 腕の識別子(p:短腕、q:長腕)
- セントロメアからの位置に基づく番号
細分化されたバンドには、さらに小数点以下の番号が付加される。たとえば「3q26.31」は、「3番染色体の長腕の領域26に含まれるサブバンド31」を示す。「3q」は、3番染色体の長腕全体を指す。
補助的な記号として次が用いられる。
- c: セントロメア領域 (例:3c)
- tel: テロメア領域 (例:3ptel や 3qtel)
- ter: テロメア近傍領域 (例: 3pter)
染色体バンドの模式図はイディオグラムと呼ばれる[32]。イディオグラムでは、Gバンドが暗色、Rバンドが明色で表現されることが一般的であり、反復配列領域は網掛けで示される場合もある。1つの細胞から得られた全染色体を分類・整列したものはカリオグラム(核型図)と呼ばれ、これにより個体が持つ染色体数や構成を視覚的に把握できる。たとえば、ヒトの核型は、女性が46,XX、男性が46,XYである(参照: § 染色体による性決定とその影響)。
遺伝子のサイズと密度

ヒトゲノムの総塩基対数は約3.2ギガ塩基対(Gbp、10億塩基対)であり、これまでに23,700個の遺伝子が同定されている[32]。ヒトは、母親および父親からそれぞれ1組ずつゲノムを受け継ぎ、各細胞核内には計2セットのゲノムコピー(2n)が含まれている。
DNAは二重らせん構造を持ち、1回転(10塩基対)の長さは 3.4ナノメートル(nm、10億分の1m)である。この値に基づいて計算すると、1細胞内に存在するDNAの総延長は、2メートルを超えると推定される。これらのDNAは、2n = 46本の染色体に分配されており、1本あたり平均約140 Mbp(メガ塩基対、100万塩基対)に相当する。
1本の染色体には、平均して約1,000個以上の遺伝子が含まれていると推定されるが、細胞分裂中に観察される染色体の長さは数マイクロメートル(μm、100万分の1m)に過ぎず、DNAは約10,000倍に圧縮(凝縮)されている。間期の核内でも、染色体は同様に高密度な構造を維持しており、その領域(染色体テリトリー)は幅方向に脱凝縮した娘染色分体により形成される。中期における娘染色分体の直径は約 0.6 μmで、これが染色体テリトリーのサイズとほぼ一致するが、その形状は不規則である(参照: § 分子構造とパッケージング階層)。
ヒトの染色体の中で最大のものは1番染色体(249 Mbp)であり、最小は21番染色体(47 Mbp)である。染色体ごとの遺伝子密度には顕著な差がある。たとえば、19番染色体(59 Mbp)には約1,500個のコード領域を含む遺伝子が存在するのに対し、18番染色体(80 Mbp)では約640個にとどまる(参照:遺伝子が豊富な領域と乏しい領域を示す核型図)。Y染色体は、特に遺伝子数が少なく、全長57 Mbpのうち、確認されているコード遺伝子はわずか72個である(これらの値は2015年12月時点の情報に基づく[32])。
種間による染色体構成の違い
ハツカネズミ(Mus musculus )では、ゲノム長は3.5 Gbpで、22,600個の遺伝子が、20個の染色体(2n = 40)に分布する[34]。染色体ごとの大きさの差はヒトよりも小さく、最小は19番染色体(61 Mbp)、最大は1番染色体(195 Mbp)である。哺乳類の中には、染色体数に大きな差異を示す種も存在する。たとえば、インドホエジカ(Muntjak muntjacus)は、雌が2n = 6、雄が2n = 7と、非常に少数の染色体しか持たない。一方、クロサイ(Diceros bicornis )では、2n = 84と染色体数が多い。ただし、これらの種における正確な塩基対数は、まだ十分に解明されていない。
カナヘビや鳥類の染色体は、極端な大きさの差を特徴とする(右上図を参照)。これらの動物では、大染色体(macrochromosome)と、1 Mbp未満の微小染色体(microchromosome)が混在する。たとえば、ニワトリ(Gallus gallus)の1番染色体は188 Mbpに達する一方で、最小の染色体は1 Mbp未満である[35]。大染色体と微小染色体の明確な境界はなく、その分類には揺れがある。ニワトリの場合、一般には1番から8番、または10番染色体までが大染色体に分類されることが多い。本稿における染色体の大きさに関する数値は、Ensembl データベースに基づいている[35]。
大染色体と微小染色体の語は、1921年に Theophilus S. Painter がトカゲの精子形成過程を研究している中で導入した[36]。微小染色体は、ナメクジウオ(Branchiostoma、旧称Amphioxus)やフトアゴヒゲトカゲ(Pogona vitticeps)などの脊索動物においても報告されているが、ヒトや獣亜綱(有袋類および有胎盤類)では確認されていない[37]。
分子構造とパッケージング階層
ヌクレオソームとクロマチン構造
 1 DNA二重らせん 2 10 nmファイバー (ヌクレオソームを含むDNA) 3 DNA複製前の間期におけるクロマチン鎖の模式図 (セントロメアを含む) 4 前期における凝縮したクロマチン (DNAが複製され、2つの染色分体から構成される) 5 中期染色体 図3-5は、細胞周期のさまざまな段階における染色分体の数を示す、あくまで模式図である。「クロマチン糸」の配置は、実際の構造を反映したものではない。 |
 |
DNAは、核分裂時のみならず間期においても高密度に巻き取られ、すなわち「凝縮」された状態にある[38]。ただし、このようなDNAのパッケージング機構については、依然として多くの点が未解明である。
この過程には、アルギニンやリシンを豊富に含む塩基性構造タンパク質であるヒストンが中心的な役割を担っている[38]。DNA、ヒストン、その他のタンパク質は、いずれも染色体の質量のおおよそ3分の1を構成しており、これらの複合体はクロマチンと総称される[39]。特に間期における細胞核構造を記述する際に「クロマチン」という用語が用いられるのは、蛍光 in situ ハイブリダイゼーション法などの特殊な手法を用いない限り、染色体の個別識別が困難であるためである。
パッケージング階層の最下位に位置するのがヌクレオソームである[40]。これは、8個のヒストン分子からなるコアにDNAが巻き付いた構造であり[41](右図の(2)を参照)、その直径は約11 nmである[42]。この構造体を形成するDNA鎖は、「10 nmファイバー(10 nm-Fiber)」とも呼ばれ、ビーズに巻き付いた糸(ネックレス)に例えられる。1つのヌクレオソームには146塩基対のDNAが巻き付き、ヌクレオソーム同士の間をつなぐ領域はリンカーDNAと呼ばれる[43]。
高次構造モデル
電子顕微鏡によって、10 nmファイバーに加え、その次の階層にあたる30 nmファイバーの存在も確認されている[38]。ただし、30 nmファイバーの内部構造、すなわち10 nmファイバーがどのように折り畳まれて形成されているのかについては未解明である[42]。さらに上位のパッケージング階層についても、いくつかの仮説が存在する。たとえば、ヒストンを除去した染色体に基づいたエビデンスによると、DNAが「染色体骨格」と呼ばれる中心部の構造から広がり、ループ状に構成されているとされる[42]。一方、クロモネマ仮説(Chromonema Model)では、30 nmファイバーがさらに折り畳まれて太くなり、断面直径が120 nm以上に達する構造を形成すると仮定している[44]。
間期クロマチンが、どのようにして前期染色体の形態へと移行するのかについては明らかでない。ただし、前期から中期にかけてのさらなる凝縮は、DNAがらせん状に巻き取られることで進行するとした見解が広く受け入れられている。
クロマチンの凝縮状態は、細胞核内で一様ではない。特定の領域では、DNA染色剤によって強く染色されることから、特に凝縮が顕著であると考えられている。このような領域はヘテロクロマチン(heterochromatin)と呼ばれる[45]。相対的に染色度の低い、緩やかに凝縮された領域はユークロマチン(euchromatin)と呼ばれる[45]。ヘテロクロマチンでは、遺伝子発現が抑制されたり、完全に停止していることが多く[46]、エピジェネティクスとの関連が注目されている[47]。
巨大染色体
巨大染色体には、多糸染色体(polytene chromosome)とランプブラシ染色体(lampbrush chromosome)の2種類が知られている。
多糸染色体
→詳細は「多糸染色体」を参照
多糸染色体は、主に昆虫において観察され、その構造的特徴から研究が進んでいる。とりわけ、ショウジョウバエ(Drosophila melanogaster)やユスリカ(Chironomus)において詳細な解析がなされてきた。この染色体は、核分裂を伴わない複数回のDNA複製、いわゆる多倍数化(polyploidy)によって形成される[48]。通常の倍数体とは異なり、父系および母系に由来する相同染色体において、同一のDNA配列が繰り返し複製され、それらが束ねたケーブルのように平行に整列する。この結果、特定の遺伝子配列のすべてのコピーが隣接して配置されるという特徴を持つ[48]。
ランプブラシ染色体
→詳細は「ランプブラシ染色体」および「ランプブラシ染色体」を参照
ランプブラシ染色体は、両生類の卵母細胞において観察される巨大染色体である。既知の染色体としては最大であり、100μmのオーダーなので光学顕微鏡においても観測が容易である[49]。その形状が顕微鏡下でボトルブラシまたはランプブラシに類似していることから、この名が付けられている。
 |
ユスリカ (Chironomus) 幼虫の唾液腺細胞。核内に多糸染色体が観察される。(ヴァルター・フレミング、1882年) |  |
サンショウウオ (Triton) の卵母細胞核。ボトルブラシ状の染色糸 (現在でいうランプブラシ染色体) を示す。(オスカー・ヘルトヴィヒ、1906年) |
Remove ads
染色体による性決定とその影響
一部の生物では、胚発生時の温度などの環境要因によって性が決定されるが、多くの動物種では、遺伝的に受け継がれる性染色体の構成によって性別が定まる。この仕組みは遺伝的性決定と呼ばれ、分類群によってその様式は多様である。同様の性染色体構成は、進化的に独立した複数の系統で収斂的に進化したと考えられている[50]。
哺乳類の大部分では、雌が2本のX染色体を持ち、雄はX染色体とY染色体を1本ずつ保有する[51]。雄のように異なる性染色体を1本ずつ有する性では、多くの遺伝子が一方の染色体にしか存在しない状態にあり、この構成はヘミ接合型(hemizygous)と呼ばれる。鳥類でも同様のヘミ接合型の性染色体構成が観察されるが、性染色体の種類は異なり、雄はZ染色体を2本(ZZ型)、雌はZ染色体とW染色体を1本ずつ(ZW型)持つ[52]。膜翅目(ハチやアリなど)の多くでは、雌が2倍体、雄が1倍体 (de:ドイツ語版) という、倍数性に基づく特異な性決定様式が認められる。
ヘミ接合性の性においては、遺伝子が一方の染色体にしか存在しないため、その領域に欠失や変異が生じた場合、他方の染色体による補償が不可能となる。このため、ヒトにおけるX連鎖性遺伝性疾患 (en:英語版) は、主に男性に発症する傾向がある。代表的な疾患には、血友病、デュシェンヌ型筋ジストロフィー、赤緑色覚異常などがあげられる。
染色体によって性が決定される生物では、一般に一方の性が同じ性染色体を2本、 他方の性が1本のみを保有する。このままでは、性ごとに性染色体上の遺伝子量に差異が生じ、遺伝子産物の発現量にも不均衡が生じる可能性がある。これを防ぐため、多くの動物は遺伝子量補償(dosage compensation)と呼ばれる遺伝子発現の調節機構を進化させてきた[53]。哺乳類においては、X染色体の一方を転写的に不活性化するX染色体不活性化が代表例であり[53]、不活性化されたX染色体は性染色質(バー小体)として観察される(参照:性染色体)。
Remove ads
染色体数
要約
視点
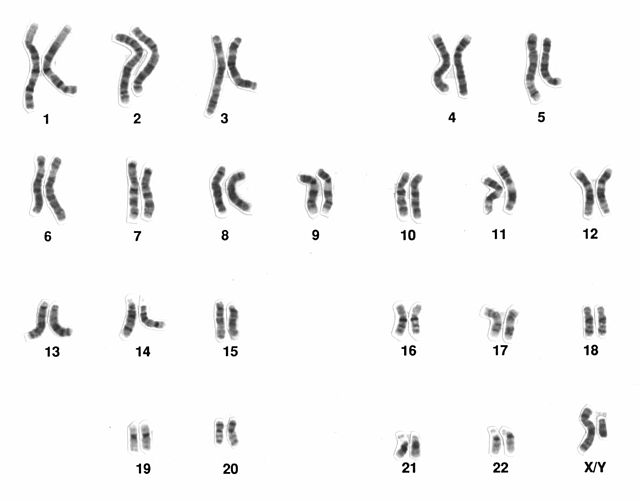
核型:個体における染色体の構成
ある個体が持つすべての染色体の構成は「核型(かくがた、英: karyotype)」と呼ばれる[68]。多くの生物(哺乳類を含む)では、性染色体の一部を除き、同じ遺伝子を持つ相同染色体が対を成して存在しており[68]、このような構成を「2倍体(2n)」という。有性生殖を行う生物では、各親から1本ずつ染色体を受け継ぐことで、この2倍体構成が形成される。
同一種、かつ同じ性の個体間では、通常、核型は共通している。ただし、一部の生物では「B染色体」と呼ばれる余剰染色体が存在し、その本数は個体や細胞によって異なる。B染色体は、主要な染色体セットには含まれない非必須の染色体である。
通常の染色体(A染色体)であっても、性によって形態や数が異なる場合があり、このような場合は性別ごとに異なる核型が存在することになる(参照: § 染色体による性決定とその影響)。たとえば、ヒトでは、男女とも染色体数は46本で共通だが、女性はX染色体を2本(46,XX)、男性はX染色体とY染色体を1本ずつ(46,XY)持つ。Y染色体はX染色体よりも小型で構造も異なる。
核型の解析には、細胞内の染色体を分類・配列した「カリオグラム」が用いられる(参照: § カリオグラム)。
次世代への染色体の伝達
配偶子が融合しても染色体数が増加しないよう、配偶子の形成に先だって染色体数を半減する必要がある。この減数は、減数分裂(減数分裂I、第一分裂とも)によって実現される。
減数分裂では、相同染色体どうしが対合し、「交差(乗換え)」を介して遺伝子の組換えが生じる[69]。さらに、組換え後の染色体のどれが最終的に配偶子に入るかは偶然によって決定されるため、個体間で遺伝的多様性が生じる[70]。
2倍体(2n)の動物では、減数分裂を経て1倍体(n)生殖細胞が形成され、それぞれが成熟した配偶子(卵子または精子)となる。受精によってこれらの配偶子が融合し、接合子(受精卵)が形成されると、両親由来の1倍体染色体セット(n)が合わさり、新たな個体の2倍体染色体セット(2n)が構築される[71]。
一部の動物では、減数分裂において染色体の不均衡な分配が生じる「雑種形成」などの現象が報告されている。
植物や単細胞生物の中には、1倍体期と2倍体期が生活環において交互に現れる種があり(参照:世代交代 (en:英語版) )、中には2倍体期が非常に短く、1倍体期が生活史の大部分を占めるものも存在する。
多倍数性染色体セット
すべての高等生物や高等植物が2倍体(2n)であるとする見解が示されることがあるが、これは正確ではない。実際には、2倍体を基本とする種が多い一方で、異なる倍数性を持つ生物も多数存在する。
植物の世代交代では1倍体(n)個体が形成される。また、多くの昆虫種(半倍数性)や一部のダニでも、1倍体の雄が確認されている。さらに、1倍体の雌のみで構成される種も存在する。たとえば、熱帯作物に被害を与えるダニ Brevipalpus phoenicis は、単為生殖により繁殖する1倍体の雌個体群からなる。このような雌は、本来は雄として発生するはずだったが、ボルバキア属(Wolbachia)などの細菌によって雌化したとされる[72]。同様の現象は他の節足動物でも観察されている。
一部の種では、染色体セットが2本以上重複して存在し、3倍体(3n)、4倍体(4n)、6倍体(6n)などの多倍数体(polyploidy)が形成される。植物では、1倍体ゲノムあたりの染色体数を「基本染色体数(基本数、x)」と呼び[73]、染色体数がその整数倍である場合を正倍数性(euploidy)という。たとえば、基本数が x = 1 の植物が2倍体であれば染色体数は 2x 本、基本数 x = 7 の植物が4倍体であれば染色体数は 4x = 28本となる[74]。
4倍体は2倍体に次いで頻度が高く、多くの被子植物や昆虫、両生類に観察される。通常、DNA複製と染色分体の形成後に細胞分裂が阻害されることで生じる。多くの穀類など有用植物は、2倍体の野生種が多倍体化を経て進化したとされる。
異なる種間の交雑により、両親由来の全染色体を保持した異質倍数体(英: Allopolyploidy)が形成される場合がある。現代のパンコムギ(小麦)は、6倍体の異質倍数体である。
2倍体と4倍体の交雑により、3倍体が形成されることもある。3倍体は染色体の対合が不完全であるため、減数分裂が正常に進まず、通常は不妊となる。しかし、例外的に繁殖可能な3倍体も報告されている。たとえば、両生類の一部では、2倍体、3倍体、4倍体が同一種または近縁種内に共存する。たとえば、トノサマガエル属では、減数分裂に先立って一方の染色体セットが意図的に除去される(参照:ドイツ語版のヨーロッパトノサマガエル § 遺伝的特徴)。パキスタンでは、同様の機構を持つ3倍体のヨーロッパヒキガエルの個体群が確認されている[75]。
理論上、4倍体から2倍体への移行も可能である。4倍体生物では各染色体対が2対ずつ存在するため、一部の遺伝子喪失が他の対によって補われることがある。また、重複した遺伝子コピーが異なる機能を担うように進化する可能性もある。一対のみに染色体変異(参照: § 染色体変異)が生じる可能性もある。こうした分化の蓄積によって、かつては同一だった染色体対が異なる性質を獲得し、最終的には2倍体として振る舞うようになると考えられる。
脊椎動物の初期進化に関しては、「2R仮説」が提唱されており、2回のゲノム重複により、現在の2倍体脊椎動物は8倍体(8n)に由来する可能性がある[76]。たとえば、Hox遺伝子クラスターが脊椎動物では4組存在する一方、他の動物では通常1組のみであることが、この仮説を支持する一例である。
個体内での倍数性の多様性
多細胞生物では、個体の体細胞がその種全体の倍数性とは異なる倍数性を持つことがある。最もよく知られる例は、一部の昆虫に観察される多糸染色体である(参照: § 多糸染色体)。ラットの肝臓では、主に2倍体細胞が観察されるが、まれに1倍体、3倍体、4倍体の細胞も報告されている[77]。4倍体細胞は、染色体複製後に核分裂を伴わない「核内倍加(英: endoreduplication)」や「核内分裂(英: endomitosis)」によって生じるとされる。一方で、2倍体生物の体細胞で観察される1倍体や3倍体の存在は報告例が限られており、実験誤差やアーティファクト(人工的な生成物)である可能性も否定できない。また、それらの形成機構も明らかにはなっていない。
倍数性の上昇は、一般に細胞核のサイズ増加を伴い、遺伝物質の量も増加する。これにより、大型の体細胞でも代謝的な需用を効率的に満たすことが可能になる。
カリオグラム
→詳細は「カリオグラム」および「de:Karyogramm」を参照


カリオグラム(核型図)とは、細胞分裂中期に観察される染色体を分類・配列し、視覚的に表した図である。観察には、細胞培養時に微小管形成阻害剤(例:コルヒチン、ノコダゾール)を添加して中期分裂を誘導する。これにより、細胞は紡錘体形成が妨げられ、中期で停止する。収集した細胞は低張処理によって膨潤させた後、固定し、スライドガラス上に滴下する。これにより、染色体がスプレッド状に広がった標本が得られる(参照: § ヒト女性のリンパ球細胞由来の中期染色体の図)。その後、染色体を染色し、顕微鏡下で撮影して大きさ順に並べることでカリオグラムが作成され、個体の核型を決定できる (右図)。
カリオグラムは、基礎生物学のみならず、臨床遺伝学においても染色体異常の診断に広く用いられている。
Remove ads
染色体変異
→詳細は「染色体変異」および「染色体異常」を参照

染色体に永続的な変化が生じるのは、DNA二重らせんが2箇所以上で切断され、それが誤って修復された場合である。通常、DNAの二重鎖切断は正確に修復されるが、異なる部位で同時に損傷が生じ、非対応の断片同士が結合すると、染色体変異が引き起こされる。
切断部位が同一染色体上にある場合、欠失(一部領域の喪失)[78]、逆位(領域の逆転)[79]、重複(同一領域の重複)[80]が発生する。これらは構造異常の一種である。一方、切断が異なる染色体間で生じた場合には、転座と呼ばれる染色体断片の相互移動が起こることがある[81]。
これらの構造的変異は、進化的過程における遺伝物質の再編成に寄与するとともに、臨床医学の分野でも重要な意義を持つ。たとえば、フィラデルフィア染色体に代表される特定の転座は、白血病などの腫瘍形成と関連する。また、放射線などによるDNA損傷後の修復異常も、染色体変異の原因となる。(参照: § ヒトの染色体)
これらの構造異常とは異なり、染色体の本数そのものに変化が生じる数的異常(染色体異数性)も存在する。染色体が1本過剰または欠如する場合、それぞれトリソミーおよびモノソミーと呼ばれる[82]。これらは構造異常とは異なる分野で扱われる(参照:染色体異常)。
Remove ads
染色体の進化
要約
視点
染色体の進化とは、進化の過程において生じる染色体構造の変化を指す。染色体の構造は、生物の外見的特徴や遺伝子の塩基配列と同様に、異なる種間の系統関係を明らかにするための重要な情報源となる。
たとえば、ヒトの染色体は46本であるが、チンパンジー、ゴリラ、オランウータンなどの大型類人猿では48本である。比較ゲノミクス研究により、これらの種間では少数の染色体再編成しか起こったことが明らかとなっている。代表的な例が、ヒトに特有な2番染色体がある。この染色体に相当する遺伝情報は、他の大型類人猿では2本の独立した染色体として存在している(右下の図、ヒトとオランウータンの染色体比較を参照)。また、ゴリラでは、ヒトの5番染色体と17番染色体に相当する領域間で特異的な転座が認められており、これも種特異的な再編成の一例である[56]。これらの知見に基づき、大型類人猿の共通祖先が有していたと推定される核型、すなわち現在のチンパンジーおよびオランウータンに見られる48個の染色体構成が復元されている。

このような染色体再編成が種分化に寄与するためには、変化が生殖細胞系で生じ、かつ集団内に安定して固定される必要がある。均衡型の染色体再編成(染色体の全セグメントが欠失や重複を伴わず、全数も保持されている変化)は、保因者に明確な表現形異常をもたらさないことが多い。しかし、減数分裂時に相同染色体間での不適切な対合を引き起こすことで、染色体の一部が過剰または欠失した配偶子が形成されやすくなり、不妊や発生異常の原因となる可能性がある。このような変異は通常、次世代で淘汰されやすいが、両親が同一の染色体変異を有する場合には、変異が集団内に安定して固定される可能性がある。
たとえば、変異を有する個体が表現形に現れる形質(顕性形質)を示しながら多くの子孫を残し、その子孫同士の交配により、同一の染色体変異を両親から受け継いだ個体が出じる場合、その変異は集団内に安定的に伝播しうる。こうした染色体変異の固定化は、元の集団との間に生殖隔離をもたらし、新たな生殖的障壁を形成することで、種分化の一因となる可能性がある。
染色体構造の類似性は、必ずしも系統関係と一致するとは限らない。たとえば、ヒトを含む大型類人猿の染色体構成は、比較的系統的に遠いとされるマカク属(Macaca fuscata、ニホンザル)と高い類似性を示す。一方、ヒトに系統的により近縁とされる小型類人猿(Hylobatidae、テナガザル科)の染色体構成は、大型類人猿およびマカク属のいずれとも大きく異なっている。テナガザルでは、進化の過程で多数の染色体再編成が生じており、ヒトと全長にわたり相同関係にある染色体は、わずか5本に過ぎない[56]。
このことから、一部の系統(たとえばテナガザル)では、染色体の進化的変化の速度が他の系統(マカク属や大型類人猿)よりもはるかに速いことが示唆される。この違いは、変異の発生頻度の差によるものではなく、生じた染色体変化が集団内でより高頻度で固定化されやすいことに起因すると考えられている。その要因の一つとして、テナガザルの生活様式や社会行動が挙げられる。たとえば、テナガザルは小規模な集団で生活しており、大規模集団を形成する種に比べて、染色体変異が集団内で拡散・定着しやすい可能性がある。実際、同一種内においても個体間で核型の多型(染色体構造の違い)が観察されることがあり、テナガザルにおいては現在も染色体進化が活発に進行していることを示唆している。また、比較的多くの核型多型が維持されていることは、異なる染色体構成を持つ個体間での交配が、従来考えられていたほど大きな選択的不利を伴わない可能性も示している[56]。
Remove ads
ヒトの染色体
要約
視点

ヒトの体細胞は合計46本(23対)の染色体を持つ。このうち2本(1対)は性染色体であり、通常、女性はXX型、男性はXY型を持つ(参照: § 染色体による性決定とその影響)。残る44本(22対)は常染色体と呼ばれ、形態的特徴と染色体長に基づいて1番から22番までの番号が付与されている。
ヒトは他の哺乳類と同様に2倍体生物であり、各染色体は父系由来と母系由来の2本1組からなる。したがって、各体細胞には1番から22番までの常染色体がそれぞれ2本ずつ、そして性染色体も2本(XXまたはXY)が存在する。
性染色体の性質
X染色体は約155 Mb(メガ塩基対)、Y染色体は約59 Mbと[83]、その塩基対数には著しい差異がある。一方で、両染色体にはいくつか共通の構造的特徴も備わっている。なかでも偽常染色体領域(pseudoautosomal region、PAR)と呼ばれる領域はX染色体およびY染色体の両端に位置し、相同性の高い配列を有している[84]。このPAR領域には、男女に共通して2コピーずつ存在する遺伝子群が含まれており、これらの遺伝子はX染色体不活性化の影響を受けない。また、減数分裂時には、X染色体とY染色体との間でPAR領域における組換えが可能である[84]。
一方、Y染色体のPAR領域以外の領域(male‑specific region of the Y chromosome、MSY)では、原則としてX染色体との組換えは生じない。ただし、MSYに属する遺伝子のうち約半数はX染色体上に相同遺伝子を持ち、これらは主に基礎代謝に関与するとされる。
そのほか、Y染色体固有の遺伝子群の中には、X染色体上に相同遺伝子を持たず、主に精巣組織でのみ発現するものがある。これらは男性の性分化および精子形成の制御に関与している[84]。また、Y染色体の長腕においてセントロメア近傍に欠失が生じた場合、低身長などの特徴的な外観を示すことがある。
臨床的に重要なゲノム変異および染色体変異
染色体異常とは、染色体の構造異常や不安定性、切断、あるいは数的異常(ゲノム変異)を指し、これらは重篤な臨床症状を伴う各種症候群の原因となり得る。
こうした臨床像を便宜的に「構造異常」あるいは「数的異常」のいずれかに分類することがあるが、必ずしも明確に分けられるわけではない。たとえば、ダウン症候群の多くは、21番染色体が完全トリソミー(遊離トリソミー)として1本多く存在することで生じるが、約3 %の症例では、転座型により21番染色体の特定領域のみ3コピー存在する形態を示す。このように、構造異常と数的異常が重複する例も存在する。
代表的な染色体異常症候群を以下に示す。各症候群については個別の記事で詳細に扱われている。
常染色体トリソミー
遊離トリソミーのうち出生例が確認されているのは21番、18番、13番染色体の3種類に限られる。このことは、他の常染色体での遊離トリソミーが胚または胎児発育段階で致死性となる可能性を示唆する[85]。
- ダウン症候群(21トリソミー)
- エドワーズ症候群(18トリソミー)
- 18番染色体の遺伝情報が、一部の体細胞に3コピー存在する状態。
- 発生頻度:新生児2,500人に1人。
- 主症状:先天性心疾患、腎臓奇形など複数臓器の形成異常、重度の知的障害(特に言語障害)。
- 予後:成人期に達する例は極めてまれ。
- パトウ症候群(13トリソミー)
- 13番染色体の遺伝情報が、一部の体細胞に3コピー存在する状態。
- 発生頻度:新生児6,000人に1人。
- 主症状:先天性心疾患、口唇口蓋裂、多指症、重度知的障害など。
- 予後:成人期に達する例は極めてまれ。
- 8トリソミー
- 一部の体細胞において、8番染色体の遺伝情報が3コピー存在する状態。
- 主症状:四肢の深い皮膚溝、脊椎奇形、神経管奇形(特に開放性二分脊椎)、高身長症傾向など。
性染色体数の異常
- ターナー症候群 (45,X)
- 性染色体の一方が欠失した状態。
- 発生頻度:新生児3,000人に1人。
- 主症状:第二次性徴の発達不全、低身長、額の生え際後退、眼・骨格の発達異常、漏斗胸など。ほとんどが不妊となる。 知的障害は通常ないが、空間認識能力や数学能力は平均を下回る傾向がある。
- トリプルX症候群 (47,XXX)
- X染色体が1本過剰な状態。臨床症状が軽度であることが多く、診断に至らない例も多い。知的機能面では同胞よりやや低い傾向が報告されており、妊孕性がやや低下する可能性がある。新生児期における染色体異常の頻度もわずかに上昇する。
- 48,XXXX および 49,XXXXX
- X染色体数が増加するにつれて、知的機能および生殖能力の低下が顕著となる傾向がある。
- クラインフェルター症候群(通常は 47,XXY、まれに 48,XXXY または 49,XXXXY)
- 発生頻度:男児新生児1,000人に1人。
- 主な特徴:不妊、高身長、手足が長い傾向、偽女性化乳房、体毛が少ない。知能指数は、同胞と比して平均で約10ポイント低い傾向がある。
- XYY症候群(47,XYY)
- 多くの場合、外見上の異常は目立たず、偶然の検査で発見される。平均寿命や生殖能にはほぼ影響がないとされる。身長は同胞より平均で約10 cm高く、知的機能はわずかに低下傾向を示す。まれに潜在精巣(停留精巣)などの症状が報告される。
- XXYY症候群
- 48,XXYY男性ではXYY症候群と共通の特徴を持つものの、不妊傾向が強く、知的機能の低下が目立つ。さらに、48,XYYY や 49,XYYYY のような極めてまれな型では、臓器奇形も伴う場合がある。
マーカー染色体
→詳細は「マーカー染色体」および「マーカー染色体」を参照
マーカー染色体とは、形態や構造から通常の染色体とは明瞭に識別できない、小型または異常な染色体断片を指す。これらは、正常な染色体由来の遺伝物質から構成されるが、G分染法(参照:遺伝子が豊富な領域と乏しい領域を示す核型図)などの核型解析法では同定が困難な場合がある。同定には高解像度蛍光 in situ ハイブリダイゼーション法が有効である。
常染色体の欠失
常染色体モノソミー(1本の染色体全体の欠失)は知られておらず、生命維持に適さないと考えられている。ただし、常染色体の一部欠失(部分欠失)が報告されており、そのうち臨床的によく知られた例を以下にあげる。
- 1p36欠失症候群
- 1番染色体の短腕末端領域の欠失により発症し、比較的最近明らかとなった最も頻度の高い部分欠失とされる[86]。
- 発生頻度: 新生児5,000-10,000人に1人。
- 主症状: 重度知的障害を呈する例が多く、症状ごとに表現形のばらつきが認められる。
- 猫鳴き症候群(Cri-du-chat症候群)
- 5番染色体の短腕末端の部分欠失によって発症する。1963年に初めて報告された。
- ウォルフ・ヒルシュホーン症候群
- 4番染色体の短腕末端の部分欠失により発症する。
- 発生頻度: 新生児50,000人に1人
- 主症状: 重度の認知障害 (de:ドイツ語版) 、成長遅延が典型的な表現形であり、生後18ヶ月以内に死亡する症例が過半を占める。
- ド・グルーシー症候群
- 18番染色体の異なる腕における欠失により発生する2つの亜型が知られている。
その他、ウィリアムズ症候群(ウィリアムズ・ボイレン症候群、7q11.23欠失)、およびスミス・マゲニス症候群(17p11.2欠失)なども比較的報告例の多い部分欠失症候群である。
特筆すべき例として、15q11.2-q12領域の欠失があげられる。この領域はゲノムインプリンティングによるエピジェネティック調節を受けており、親性によって発現する遺伝子が異なる。通常、父系および母系双方から遺伝子が1コピーずつ存在するが、どちらか一方のコピーが欠失すると、母親由来の欠失ではアンジェルマン症候群、父親由来の欠失ではプラダー・ウィリー症候群という異なる臨床像が現れる。
なお、ICD-10 (en:英語版) におけるコードO35.1は、胎児に染色体異常(またはその疑い)がある場合の妊婦管理に用いられる診断コードである。
Remove ads
原核生物およびウイルスの「染色体」
原核生物(細菌および古細菌)は細胞核を欠き、真核生物に見られるような「典型的な染色体構造」は存在しない。これらの生物では、1本または複数の主に環状のDNA分子が遺伝情報を担っており、これらは細菌染色体とも呼ばれる[87]。うち古細菌においては、真核生物の細胞核に見られるクロマチン構造と相同なDNAの高次構造が存在することが知られている[88]。なお、真核生物の細胞小器官であるミトコンドリアや葉緑体に含まれるDNAも、一般に環状であり、その構造は細菌染色体に類似している。これは、それらの小器官が細菌に由来するという細胞内共生説と整合的である[89]。このようなDNAは細胞核の外に存在することから「核外染色体」と呼ばれ、ミトコンドリアDNA(Mitochondrial DNA、別名:コンドリオーム、独: Chondriom)および葉緑体DNA(Chloroplast DNA、別名:プラストーム、独: Plastom)として知られている。
ウイルスにおいても、ゲノムが1本または複数の核酸分子(DNAまたはRNA)から構成される場合、それらの核酸分子が「染色体」と表現されることがある。たとえば、インフルエンザA型ウイルスのゲノムは8本のRNAセグメントからなり、それぞれが染色体に相当する役割を果たしている。
Remove ads
染色体研究の歴史
- 1842年 カール・ネーゲリ による染色体の発見
- 1865年 グレゴール・ヨハン・メンデルがメンデルの法則を発表
- 1869年 フリードリッヒ・ミーシェルによるヌクレイン(現在のDNA)を発見
- 1882年 ヴァルター・フレミング による有糸分裂の記載[90]
- 1888年 ハインリッヒ・ヴィルヘルム・ヴァルダイエルによる「染色体」の命名
- 1900年 ユーゴー・ド・フリース、エーリヒ・フォン・チェルマク、カール・エーリヒ・コレンスによるメンデルの法則の再発見
- 1900年代、ウォルター・サットンとテオドール・ボヴェリによる染色体説の提唱[91][92]
- 1920年代、トーマス・ハント・モーガンらによる染色体説の実証[93]
- 1944年 オズワルド・アベリーらによる肺炎双球菌の形質転換実験(アベリー-マクロード-マッカーティの実験)[94]
- 1952年 アルフレッド・ハーシーらによるブレンダー実験(ハーシー-チェイスの実験)[95]
- 1953年 ジェームズ・ワトソン、フランシス・クリックによるDNA二重らせんモデルの提唱[96]
- 1956年 アーサー・コーンバーグによるDNAポリメラーゼの発見
- 1974年 オリンズ、ロジャー・コーンバーグらによるヌクレオソームの発見[97][98]
- 1978年 エリザベス・ブラックバーンらによるテロメア配列の同定[99]
- 1980年 ジョン・カーボン らによる機能的セントロメア配列の同定[100]
- 1996年 チャールズ・デビッド・アリスらによるヒストンアセチル化酵素の同定[101]。スチュアート・シュライバーらによるヒストン脱アセチル化酵素の同定[102]
- 1997年 ティモシー・J・リッチモンドらによるヌクレオソームの高解像度結晶構造解析[103]
- 2000年 ヒトゲノムドラフト配列の発表
Remove ads
脚注
参考文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
