热门问题
时间线
聊天
视角
抗腫瘤藥
来自维基百科,自由的百科全书
Remove ads
抗腫瘤藥(英語:Anticancer Drugs,Antitumor Drugs,Antineoplastic Agents)也稱為抗癌藥、抗惡性腫瘤藥,是指治療惡性腫瘤的藥物。[1]此類藥物通過多種途徑殺滅或抑制癌細胞來達到治療惡性腫瘤的目的。根據藥理作用的不同可以將抗腫瘤藥分為細胞毒性藥物和非細胞毒性藥物,前者以DNA毒性藥物為主,後者以分子靶向抗腫瘤藥物為主。[2]常用的抗腫瘤藥有:順鉑、多柔比星、紫杉醇、伊馬替尼等。
傳統的細胞毒性藥物由於對癌細胞缺乏足夠的選擇性,在殺傷癌細胞的同時,對正常的組織細胞也產生不同程度的損傷作用。而隨著腫瘤分子生物學和轉化醫學的發展,抗腫瘤藥已從傳統的細胞毒性藥物向非細胞毒性藥物發展。非細胞毒性藥物具有高選擇性和高治療指數的特點,臨床優勢明顯。[3]
Remove ads
用途
抗腫瘤藥主要用於醫療方面,用來治療癌症。[4]由於一些抗腫瘤藥兼有抗病毒活性,所以它們也被用於治療一些病毒性傳染病。[5]某些甾體激素藥物(內分泌治療藥),雖然無抗腫瘤活性但可以調節體內激素平衡,對某些功能性腺癌有抑制作用,因此常用於抗腫瘤藥物的聯合治療。[3]同時抗腫瘤藥也被運用於科學研究。人們通過對一些抗腫瘤藥藥理作用的研究,來進一步了解癌症的分子生物學特徵。[3]
歷史

第一個抗腫瘤藥氮芥是由L.S.古德曼和A.Z.吉爾曼於20世紀40年代對芥子氣(學名二氯二乙硫醚)的化學結構進行修飾而得到的,隨後鹽酸氮芥(Chlorethamine Hydrochloride)作為最早使用於臨床的抗腫瘤藥,於1949年被批准上市,用於治療淋巴瘤和何杰金氏病。[1]而第一個含芳香基的氮芥類藥物苯丁酸氮芥於1957年被批准上市,用於治療慢性淋巴細胞白血病。[6]
早期的抗腫瘤新藥大多是隨機篩選,通過動物移植性腫瘤尋找的。腫瘤細胞中磷醯胺酶活性高於正常細胞,同時磷醯基作為吸電子基團能降低氮芥中氮原子上電子云的密度,基於這一思路,H.阿諾德於1957年合成了環磷醯胺,並在臨床上取得成功。[7]同年,查爾斯·海德爾伯格等人根據電子等排原理合成了5-氟尿嘧啶,同樣在臨床上取得成功。[8]這兩種藥物也是首先根據理論而合成的有效抗腫瘤藥物。[4]
20世紀初,保羅·埃爾利希提出了「魔彈」的構想,即期望某些特異性化合物能作為靶向分子將藥物帶至病灶部位,進而減少對正常組織或細胞的損傷,這是靶向製劑的最初構想。1948年,D.普萊斯曼與G.凱特利提出用抗體作為細胞生長抑制劑和放射性核素的載體,這是抗腫瘤藥靶向製劑及單株抗體類抗腫瘤藥的雛形。[9]1951年,W.H.貝爾沃爾特用碘-131標記的抗體治療甲狀腺腫瘤。[10]1958年,喬治·馬特等將抗體連接到甲氨蝶呤上用以治療白血病。1972年,T.高斯等將苯丁酸氮芥連接到抗體上治療黑色素瘤。[11]以上這些試驗充分驗證了以抗體為抗腫瘤藥或載體的可行性,但這些試驗所使用的抗體均為多株抗體,專一性不理想,故效果有限。1975年,喬治斯·克勒與色薩·米爾斯坦發明了單株抗體技術。由於單株抗體的高度專一性,抗腫瘤藥的靶向製劑開始以單株抗體為載體不斷發展,同時也出現了許多單株抗體類抗腫瘤藥。[12]
金屬鉑配合物的抗腫瘤生物活性研究起於20世紀60年代,當時美國生理學家巴內特·盧森堡等人在研究電磁場作用下微生物的生長情況時,發現在氯化銨介質中的鉑電極周圍大腸桿菌停止分裂繁殖。經研究確認順-二氯·二氨合鉑(Ⅱ)和順-四氯·二氨合鉑(Ⅳ)對細胞繁殖有抑制作用。隨後,盧森堡及其合作者用患有肉瘤-180和白血病L1210的小鼠做實驗,發現順鉑具有抗癌活性,最終使順鉑於1971年進入臨床實驗。[13][14][15]1978年FDA批准順鉑為睪丸癌和卵巢癌的治療藥。第二代金屬鉑配合物藥物卡鉑於20世紀80年代上市,而第一個手性金屬鉑配合物藥物奧沙利鉑於1996年上市。[1]

1962年,M.E.沃爾和M.C.瓦尼開始進行紅豆杉樹皮抗腫瘤活性成分的研究。沃爾負責短葉紅豆杉(Taxus Breviolia)樹皮中抗腫瘤活性成分的提取,他於1967年從樹皮中分離得到了紫杉醇,收率僅0.014%。而瓦尼則使用沃爾提取的紫杉醇製備單晶,通過單晶X射線衍射技術於1971年確定了紫杉醇的化學結構。[16]1979年,生物學家S.B.霍維茨發現紫杉醇的靶點是微管蛋白。[17]1984年,美國國家癌症研究所進行了紫杉醇的一期臨床實驗,實驗結果表明紫杉醇對於乳腺癌和卵巢癌具有非常好的療效。[5]1989年,佛羅里達州立大學的羅伯特·霍爾頓教授從漿果紫杉的樹葉中提取得到紫杉醇的前體10-去乙醯基巴卡亭Ⅲ(10-deacetylbaccatin Ⅲ,10-DBA),含量約0.1%,並以此進行半合成紫杉醇,解決了天然紫杉醇產量不足的問題。[18][19][20][16]
20世紀90年代末,汽巴-嘉基(1996年與山德士合併成諾華公司[21])通過靶向篩選的方式開發了最早的分子靶向抗腫瘤藥物伊馬替尼。[16]1998年6月,伊馬替尼進入Ⅰ期臨床實驗,31例參與的患者在用藥數周后白血球計數即恢復正常,僅僅32個月後諾華公司就在全球範圍遞交了新藥申請,美國FDA於2001年3月27日通過了給予其優先審批的資格。2001年5月10日伊馬替尼在尚未完成Ⅲ期臨床實驗的情況下就被FDA批准提前上市,其審批進程比同類藥物快了一倍。伊馬替尼的研發成功開創了靶向性抗腫瘤藥研發的新模式。[22]
Remove ads
分類
臨床應用的抗腫瘤藥種類較多且發展迅速,其分類迄今尚不完全統一,一般根據其藥理作用和靶點進行以下分類。[1][23][24]
| 細胞毒性藥物 | 直接作用於DNA的藥物 | |
| 干擾DNA合成的藥物(抗代謝物) | ||
| 作用於結構蛋白的藥物 | ||
| 非細胞毒性藥物 | 分子靶向藥物 | |
| 其他抗腫瘤藥物 |
|
Remove ads
Remove ads
作用機理

腫瘤細胞群包括增殖細胞群、靜止細胞群(G0期)和無增殖能力細胞群。腫瘤增殖細胞群與全部腫瘤細胞群之比稱生長比率(Growth Fraction,GF)。腫瘤細胞從一次分裂結束到下一次分裂結束的時間稱為細胞周期,此間歷經4個時相DNA合成前期(G0期)、DNA合成期(S期)、DNA合成後期(G2期)和有絲分裂期(M期)。[4]
細胞毒性藥物通過影響細胞周期的生化事件對不同周期的腫瘤細胞產生細胞毒性作用並延緩細胞周期的時相過渡。[25]依據藥物對各周期或時相腫瘤細胞的敏感性不同,大致將細胞毒性藥物分為兩大類:
- 細胞周期非特異性藥物(Cell Cycle Nonspecific Agents,CCNSA):能殺滅處於增殖周期各時相的細胞甚至包括G0期細胞的藥物,如直接破壞DNA結構以及影響其複製或轉錄功能的藥物(烷化劑、抗腫瘤抗生素及鉑類配合物等)。此類藥物對惡性腫瘤細胞的作用往往較強,能迅速殺死腫瘤細胞,其殺傷作用呈劑量依賴性,在機體能耐受的藥物毒性限度內,作用隨劑量的增加而成倍增強。[23]
- 細胞周期(時相)特異性藥物(Cell Cycle Specific Agents,CCSA):僅對增殖周期的某些時相敏感而對G0期細胞不敏感的藥物,如作用於S期細胞的抗代謝藥物和作用於M期細胞的長春鹼類藥物。此類藥物對腫瘤細胞的作用往往較弱,其殺傷作用呈時間依賴性,需要一定時間才能發揮作用,達到一定劑量後即使劑量再增加其作用不再增強。[23]

Remove ads
非細胞毒性藥物主要以腫瘤分子病理過程的關鍵調控分子等為靶點。[3]如改變激素平衡失調狀態的某些激素或其拮抗藥;以細胞信號轉導分子為靶點的蛋白酪氨酸激酶抑制劑、法尼基轉移酶抑制劑、MAPK信號轉導通路抑制劑和細胞周期調控劑;針對某些與增殖相關細胞信號轉導受體的單株抗體;破壞或抑制新生血管生成,有效地阻止腫瘤的生長和轉移的新生血管生成抑制劑;減少癌細胞脫落、黏附和基底膜降解的抗轉移藥;以端粒酶為靶點的抑制劑促進惡性腫瘤細胞向成熟分化的分化誘導劑等。[23]
毒理學
目前臨床使用的細胞毒性藥物對腫瘤細胞和正常細胞尚缺乏理想的選擇作用,即藥物在殺傷惡性腫瘤細胞的同時,對某些正常的組織也有一定程度的損害,毒性反應成為化療時使用劑量受到限制的關鍵因素,同時亦影響患者的生命質量。[27]非細胞毒性藥物中的一些分子靶向藥物(如腫瘤信號通路抑制劑)可以特異性的作用於腫瘤細胞的某些特定分子位點,而這些位點在正常細胞通常不表達或者很少表達。因此,非細胞毒性藥物通常安全性高,耐受性好,毒性反應較輕。[28]

- 骨髓抑制:是腫瘤化療的最大障礙之一,除激素類、博來黴素和L-門冬醯胺酶外,大多數細胞毒性藥物均有不同程度的骨髓抑制。骨髓造血細胞經化療後外周血細胞數減少的機率決定於細胞的壽命,壽命越短的外周血細胞越容易減少,通常先出現白血球減少,然後出現血小板降低,一般不會引起嚴重貧血。除了常用各種集落刺激因子如GM-CSF、G-CSF、M-CSF、EPO等來處理血細胞下降,護理中必須採取措施預防各種感染和防治出血等。[28]
- 消化道反應:是細胞毒性藥物的最常見毒性反應。化療引起的噁心、嘔吐根據發生時間分為急性和遲發性兩種類型。前者常發生在化療後24小時內;後者發生在化療24小時後。高度或中度致吐者可應用地塞米松和5-HT3受體拮抗劑(如昂丹司瓊),輕度致吐者可應用甲氧氯普胺或氯丙嗪。另外化療也可損害增殖活躍的消化道黏膜組織,容易引起口腔炎、口腔潰瘍、舌炎、食道炎等,應注意口腔清潔衛生,防止感染。[28]
- 脫髮:正常人頭皮約有10萬根頭髮,除其中10%~15%的生發細胞處於靜止期外,其他大部分處於活躍生長,因此多數細胞毒性藥物都能引起不同程度的脫髮。在化療時給患者戴上冰帽,使頭皮冷卻,局部血管痙攣,或止血帶結紮於髮際,減少藥物到達毛囊而減輕脫髮,停止化療後頭髮仍可再生。[29]
Remove ads

- 心臟毒性:以多柔比星最常見,可引起心肌退行性病變和心肌間質水腫。心臟毒性的發生可能與多柔比星誘導自由基生成有關。[28]
- 呼吸系統毒性:主要表現為間質性肺炎和肺纖維化,主要藥物有博來黴素、卡莫斯汀、絲裂黴素C、甲氨蝶呤、吉非替尼等。長期大劑量使用博來黴素可引起間質性肺炎及肺纖維化,可能與肺內皮細胞缺少使博來黴素不活化的酶有關。[30]
- 肝臟毒性:部分細胞毒性藥物如L-門冬醯胺酶、放線菌素D、環磷醯胺等可引起肝臟損害。[30]
- 泌尿系統毒性:大劑量環磷醯胺可引起出血性膀胱炎,可能與大量代謝物丙烯醛經泌尿道排泄有關,同時應用巰乙磺酸鈉可預防其發生。順鉑由腎小管分泌,可損害近曲小管和遠曲小管。保持充足的尿量有助減輕泌尿系統毒性。[29]
- 神經毒性:長春新鹼最容易引起外周神經病變。順鉑、甲氨蝶呤和5-氟尿嘧啶偶爾也可引起一些神經毒性。[29]
- 過敏反應:凡屬於多肽類化合物或蛋白質類的抗腫瘤藥如L-門冬醯胺酶、博來黴素,靜脈注射後容易引起過敏反應。紫杉醇的過敏反應可能與賦形劑聚氧乙基蓖麻油有關。[29]
- 組織壞死和深靜脈血栓:刺激性強的藥物如絲裂黴素C、多柔比星等可引起注射部位的血栓性靜脈炎,注射液漏於血管外可致局部組織壞死,應避免注射不當。[27]
非細胞毒性藥物毒性反應較輕,但仍然有一些副作用。[30]
單株抗體類藥物分為鼠源性單株抗體、嵌合單株抗體、人源化單株抗體和完全人源化單株抗體。其中,鼠源性單株抗體(各類以「莫單抗」(momab)為通用名尾綴的單株抗體類藥物)特異性好,代謝快,但由於其不含人源化成分,會誘導人體產生人抗鼠抗體,因而副作用較大。[31]由於其較大的副作用,自2003年起再沒有新的鼠源單株抗體藥物進入臨床研究。[22]嵌合單株抗體(各類以「昔單抗」(ximab)為通用名尾綴的單株抗體類藥物)則是由鼠源性單株抗體的V區與人抗體的C區拼接而成,其人源成分占60%-70%,因而副作用有所降低,同時保留了其與抗原結合的特異性。[31]人源化單株抗體(各類以「組(珠)單抗/單抗」(zumab)為通用名尾綴的單株抗體類藥物)則是將人抗體的CDR代之以鼠源性單株抗體的CDR,其人源成分約占90%,進一步減小了副作用,但與抗原的結合能力有所下降。[31]完全人源化單株抗體(各類以「木(人)單抗/單抗」(mumab/umab)為通用名尾綴的單株抗體類藥物)是利用基因敲除技術將小鼠抗體基因敲除,代之以人抗體基因,後用抗原免疫小鼠,再經雜交瘤技術製備得來。由於其人源成分占100%,因而基本無副作用,同時治療效果也不受影響。[31]
由於小分子激酶抑制劑具有高度的特異性,因而副作用很小,以胃腸道反應最為多見。[28]其中,以表皮生長因子受體(EGFR)和血管內皮生長因子受體(VEGFR)為靶點的小分子激酶抑制劑(如吉非替尼等)由於藥理作用會影響患者的循環系統,因而會有高血壓和高血糖的副作用。[1]
耐藥性
腫瘤細胞對抗腫瘤藥物產生耐藥性是化療失敗的重要原因。[2]有些腫瘤細胞對某些抗腫瘤藥具有天然耐藥性(Natural Resistance),即腫瘤細胞對藥物原來就不敏感的現象,如處於非增殖的G0期腫瘤細胞一般對多數抗腫瘤藥不敏感。亦有的腫瘤細胞對於原來敏感的藥物,治療一段時間後才產生不敏感現象,稱之為獲得性耐藥性(Acquired Resistance)。[32]其中表現最突出、最常見的耐藥性是多藥耐藥性(Multiple Drug Resistance,MDR)或稱多向耐藥性(Pleiotropic Drug Resistance),即腫瘤細胞在接觸一種抗腫瘤藥後,產生了對多種結構不同、作用機制各異的其他抗腫瘤藥的耐藥性。[27]
耐藥性產生的原因十分複雜,不同藥物其耐藥機制不同,同一種藥物存在著多種耐藥機制。耐藥性的遺傳學基礎現已證明,腫瘤細胞在增殖過程中有較固定的突變率,每次突變均可導致耐藥性瘤株的出現。因此,分裂次數愈多(亦即腫瘤愈大),耐藥瘤株出現的機會愈大。腫瘤幹細胞學說認為腫瘤幹細胞的存在是導致腫瘤化療失敗的主要原因,耐藥性是腫瘤幹細胞的特性之一。[4]現代研究表明,腫瘤細胞更容易對分子靶向性藥物產生耐藥性。[27]
藥劑學
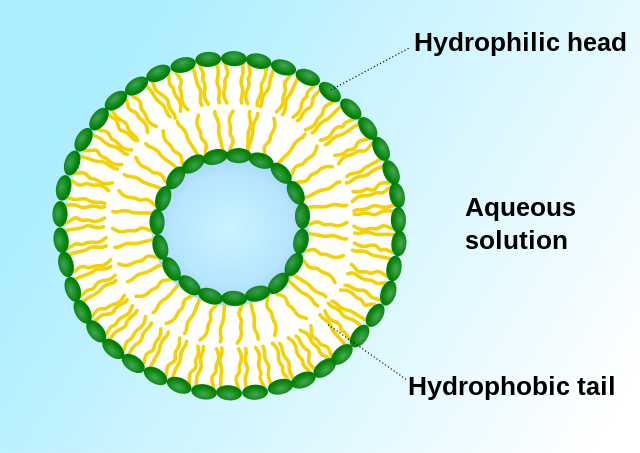
由於細胞毒性藥物缺乏選擇性,因而對機體有較大的副作用。[2]除了開發新型非細胞毒性藥物以減少副作用,改變細胞毒性藥物的劑型也是重要的手段之一。1906年,保羅·埃爾利希提出了靶向製劑(Targeting Drug System)的概念。靶向製劑為第四代藥物劑型,被認為是抗腫瘤藥的適宜劑型。[34]這類劑型不但增強了非細胞毒性藥物的特異性,還使細胞毒性藥物有了選擇性。 早期靶向製劑以被動靶向製劑為主。[12]1961年,英國血液病專家A.D.班漢姆發明了脂質體。[35][36][37]1971年,脂質體首次被用作藥物載體,這也是世界上最早的被動靶向製劑劑型。[38][39] 脂質體能使藥物選擇性地殺傷癌細胞或抑制癌細胞繁殖,增加藥物對淋巴的選擇性。由於腫瘤細胞中含有比正常細胞較高濃度的磷酸酶及醯酶,因此將抗癌藥物包製成脂質體,不僅由於酶使藥物容易釋出,還使抗腫瘤藥在靶區具有滯留性。[40][41]主動靶向製劑則包含了修飾的藥物載體(如布洛芬鋅微乳)、前體藥物(如環磷醯胺)和藥物大分子複合物。由於主動靶向製劑具有更高的選擇性,能將藥物定向地運送到靶區集中發揮藥效,因而主動靶向製劑有更好的治療效果。[12]
隨著分子生物學的發展,對物理化學靶向製劑的研究也在不斷深入。物理化學靶向製劑包含了磁性靶向製劑、栓塞靶向製劑、熱敏靶向製劑、pH敏感靶向製劑等多種劑型。磁性靶向製劑是指將藥物與鐵磁性物質共同包裹於高分子聚合物載體中。當藥物用於體內後,利用體外磁場的效應引導藥物在體內定向移動和定位集中,主要用作抗癌藥物載體。栓塞靶向製劑利用栓塞阻斷對靶區的血供應和營養,使靶區的癌細胞缺血壞死。含有抗腫瘤藥的栓塞製劑具有栓塞和靶向性化療的雙重作用。pH敏感製劑則利用腫瘤間質液的pH值比周圍正常組織顯著低的特點來達到靶向治療的作用。[12]
製備途徑
大多數抗腫瘤藥通過全合成或半合成的方式進行工業製備,也有少數藥物(如一些多肽類化合物或蛋白質類抗腫瘤藥)是通過生物製藥或天然成分提取的手段進行大規模生產。[1]
未來發展

隨著在分子水平對腫瘤發病機制和細胞分化增殖和凋亡調控機制認識的深入,抗腫瘤藥已從傳統的細胞毒性作用向針對分子靶點的多環節作用的方向發展。[16]已經上市的新型分子靶向抗腫瘤藥物可分為小分子化學藥物和生物技術藥物。前者主要由各種小分子激酶抑制劑組成,另外還包括蛋白酶體抑制劑和作用部分表觀遺傳學藥物。後者以單株抗體類藥物為代表,正逐漸成為抗腫瘤治療的中堅力量。這些藥物實際上超越了傳統的直接細胞毒性藥物。[6]當前分子靶向抗腫瘤藥物的研發是新藥開發領域的一個熱點課題。[15]
現今抗腫瘤藥作用靶點的開發手段包括:從有效單體化合物著手發現靶點;以正常組織和病理組織基因表達差異發現靶點;通過定量分析和比較研究在正常和疾病狀態下蛋白質的表達譜的改變發現靶點;以蛋白質相互作用為基礎發現靶點;應用RNA干擾技術特異地抑制細胞中不同基因的表達,通過細胞的表型變化發現靶點等。[16]而新型抗腫瘤藥的研發則是在靶點的三維結構基礎上,利用計算機輔助藥物設計的手段,從而快速篩選得到先導化合物,進而得到目標藥物的過程。新型靶向性抗腫瘤藥的研發靶點主要分為基因組與蛋白質組兩種。[16]目前靶向性抗腫瘤藥針對的驅動基因主要有兩大類,一類是位於細胞膜上的受體分子(如HER2/neu等),另一類是位於細胞內重要信號通路的分子(如EGFR等)。由於基因發生插入、缺失、重排或擴增等突變導致驅動基因的活化,賦予了癌細胞的適應性,從而導致癌症的發生和發展。[22]而靶向性抗腫瘤藥針對的蛋白質靶點則主要有疾病特異性蛋白(如多肽Op18、熱激蛋白70等)、生物標記分子(如細胞角蛋白CK19等)、酶分子(如組蛋白去乙醯化酶(HDAC)等)等。[22]
腳註
參考文獻
參見
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads