Trifluormethylace
chemická reakce From Wikipedia, the free encyclopedia
Remove ads
Trifluormethylace je v organické chemii obecně jakákoliv reakce, při níž dochází k připojení trifluormethylové skupiny na organickou sloučeninu.[1][2][3][4]
Trifluormethylované sloučeniny mají určitý význam při výrobě léčiv a agrochemikálií; příklady takových léčiv jsou fluoxetin, leflunomid, nulitamid, dutasterid, fipronil, fluazinam, fluridon a triflurazin, u agrochemikálií například trifluralin.
Remove ads
Historie
První výzkum trifluormethylových skupin, obzvláště jejich biologické aktivity, byl proveden roku 1927.[5] Další podobný výzkum proběhl v roce 1958.[6] Trifluormethgylační reakci popsal roku 1892 Frédéric Swarts,[7] zde šlo o reakci založenou na fluoridu antimonitém. Při tomto postupu reaguje benzotrichlorid s SbF3 za vzniku C6H5CF2Cl a C6H5CF3. Ve 30. letech 20. století byl SbF3 nahrazen fluorovodíkem. Při McLoughlinově-Throwerově reakci, vyvinuté v roce 1968, se používají jodfluoralkany, jodované aromatické sloučeniny a měď.[8] Roku 1969 byla popsána další metoda, při níž docházelo k trifluormethylaci.[9][10]
 |
| McLoughlinova-Throwerova reakce (1968) |
Remove ads
Činidla
Trifluormethyltrimethylsilan
Přípravu trifluormethyltrimethylsilanu popsal Ingo Ruppert roku 1984.[11] V roce 1989 byla zmíněna aktivace TMSCF3 fluoridem za úřelem provedení nukleofilní trifluormethylace karbonylových sloučenin.[12] V témže roce byla popsána také obdobná reakce sloužící k přípravě trifluormethylovaných fenolů a anilinů[13] a od té doby je TMSCF3 běžně používaným nukleofilním trifluormethylačním činidlem.[14][15]
Jako příklad lze uvést trifluormethylaci cyklohexanonu v tetrahydrofuranu pomocí tetrabutylamoniumfluoridu.[16]
 |
| Trifluormethylace za použití
trifluormethyltrimethylsilanu[16] |
Substráty mohou být arylhalogenidy.[17][18] (Trifluormethyl)trimethoxyboritan draselný použitý při těchto reakcích se získává z B(OMe)3, CF3SiMe3 a fluoridu draselného.[19]
Byla také popsána reakce s využitím funkcionalizace arylů aktivací vazeb C-H.[20][21]
Trifluoroctan sodný
Trifluoroctan sodný byl jako reaktant při trifluormethylacích poprvé použit v roce 1981; substráty byly arylhalogenid s jodidem měďným.[22][23]
Trifluormethan
Fluoroform (CF3H) byl použit jako činidlo k trifluormethylaci aldehydů za přítomnosti silné zásady.[24]
 |
| Trifluoromethylace za použití fluoroformu[24] |
Trifluorjodmethan
Trifluorjodmethan se používá jako reaktant při aromatických párovacích reakcích a rovněž při reakcích enonů (například chalkonu) s diethylzinkem za přítomnosti Wilkinsonova katalyzátoru:[25]
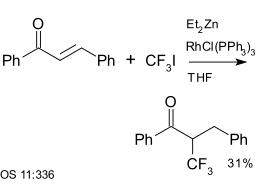 |
| Trifluormethylace za použití diethylzinku a Wilkinsonova katalyzátoru[25] |
Trifluormethylsulfon a trifluormethylsulfoxid
K trifluormethylaci elektrofilů lze použít trifluormethylsulfon (C6H5SO2CF3) nebo trifluormethylsulfoxid (C6H5SOCF3).[26]
Trifluormethansulfonylchlorid
Trifluormethansulfonylchlorid (CF3SO2Cl, také nazývaný triflylchlorid) je možné velmi účinně použít na trifluormethylaci aromatických a heteroaromatických molekul, včetně některých léčiv. Při této reakci se používá fotoredoxní katalyzátor a zdroj světla; vše probíhá při pokojové teplotě.[27]
Trifluormethansulfinát sodný
Trifluormethansulfinát sodný (CF3SO2Na) byl jako trifluormethylační činidlo poprvé použit v roce 1991.[28] Při tomto procesu je nutné použití terc-butylhydroperoxidu a většinou i kovu; reakce probíhá radikálovým mechanismem. Uvedený reaktant je možné použít i na heterocyklické substráty.[29]
 |
| Trifluormethylace pomocí trifluormethansulfinátu sodného[29] |
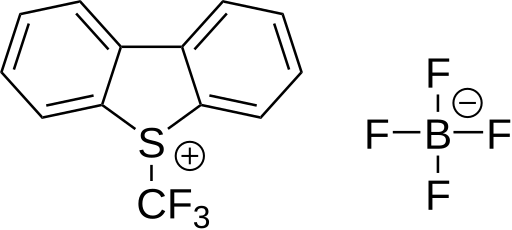
Umemotova činidla
Umemotova činidla jsou (trifluormethyl)dibenzoheterocyklické soli.[30][31]
Organokovové sloučeniny
Byla připravena řada kovových komplexů obsahujících skupinu CF3-, přičemž některé z nich se hodí k trifluormethylaci. Patří k nim například (trifluormethyl)lithium (CF3Li), jež lze připravit iontoměniči; ovšem i za nízkých teplot je nestabilní, rozkládá se na fluorid lithný a difluorkarben. Vhodnější vlastnosti vykazují trifluormethylměďnatá činidla ; ty se připravují přímo na místě reakcí trifluormethyljodidu (CF3I) s práškovou mědí v polárních rozpouštědlech.[32] Hg(CF3)2, prepared by decarboxylation of the trifluoroacetate, has proven useful for the trifluoromethylation of other metals.[33]
Remove ads
Typy trifluormethylačních reakcí
Aromatické párovací reakce
U párovacích reakcí aromatických sloučenin s trifluormethyl-kovovými komplexy se jako katalyzátor obvykle používá měď, palladium a nikl jsou méně časté.[1] Při McLoughlinově-Throwerově reakci (vyvinuté roku 1962) reaguje jodbenzen s trifluorjodmethanem (CF3I) a práškovou mědí v dimethylformamidu při 150 °C a tvoří se trifluormethylbenzen; meziproduktem je přitom perfluormethyl-kovový komplex.
V reakci, popsané roku 1982, katalyzované octanem palladnatým se používá práškový zinek, meziproduktem by měl být CF3ZnI, aktivním katalyzátorem je kovové palladium.[34][35]
První párovací reakce katalyzovaná mědí byla popsána v roce 2009, použity byly aryljodidy, trifluormethylsilan, jodid měďný a 1,10-fenantrolin.[36] Jako donor CF3 lze použít též (trifluormethyl)trimethoxyboritan draselný,[37] arylborité kyseliny,[38][39] soli trifluormethylsulfonových kyselin[40] nebo fenntrolin-trifluormethylměďný komplex.[41]
Roku 2010 byla popsána reakce arylhalogenidů, (trifluormethyl)triethylsilanu a dimeru allylpalladiumchloridu katalyzovaná palladiem.[42]
 |
 |
| Aromatická trifluormethylace popsaná roku 1982[34] | Aromatická trifluormethylace popsaná roku 2009[36] |
Radikálová trifluormethylace
Při radikálové trifluormethylaci je aktivní látkou trifluormethylový radikál;[43] jako činidla se nejčastěji používaly bromtrifluormethan a haloformy,[44][45] ovšem s ohledem na Montrealský protokol byly vyvinuty alternativy jako například trifluorjodmethan;[46][47] používá se také směs trifluorjodmethanu a triethylboranu[48][49] nebo trifluormethansulfinát sodný a bis(trifluoracetyl)peroxid.
 |
| Trifluormethylace za použití CF3I a triethylboranu
Zásadou je 2,6-lutidin[48] |
V radikálu CF3 je atom fluoru, díky indukčnímu efektu a omezené možnosti odevzdat elektron, skupinou odtahující elektrony. Na rozdíl od methylového radikálu má čtyřstěnný tvar s velkou přechodovou bariérou, disponuje větší elektrofilitou a je též reaktivnější (například při reakci se styrenem 440krát[50]). V roce 1949 byla popsána fotochemická reakce trifluorjodmethanu s ethenem za vzniku 3-jod1,1,1-trifluorpropanu.[51]
K látkám či směsím, o kterých je známo, že mohou být použity na přímou trifluormethylaci arenů, patří CF3I, CF3Br, trifluoroctan stříbrný s TiO2 a trifluormethansulfinát sodný s Cu(OSO2CF3)2/tBuOOH.
Nukleofilní trifluormethylace
V nukleofilní trifluormethylaci je aktivní látkou anion CF -
3 ,[52] o kterém se však předpokládá, že je pouze přechodným produktem a tak jej není možné izolovat, i když byla zachycena a popsána jeho sloučenina s kationtem [K(18-crown-6)]+.[53]
Pozorování trifluormethyového aniontu je obtížné z důvodu jeho silně zásadité povahy a snahy vytvořit pětinásobně koordinované sloučeniny s křemíkem, například [(CH3)3Si(CF3)2]− nebo [(CH3)3Si(F)(CF3)]−; příkladem může být reaktivita fluoroformu za přítomnosti silné zásady jako je terc-butoxid draselný s karbonylovými sloučeninami v dimethylformamidu (DMF),[52] kdy CF -
3 reaguje s DMF za vzniku hemiaminolátového aduktu.([Me2NCH(O)CF3]K).[24][54][55][56]
 |
| Trifluormethylace s využitím methylfluorsulfonyldifluoroctanového aniontu; |
Elektrofilní trifluormethylace
Při elektrofilní trifluormethylaci má donor trifluormethylové skupiny kladný náboj.[58][59] Tvorba kationtu CF +
3 byla označena za „velmi obtížnou“.[60] První odpovídající činidla, diaryl(trifluoromethyl)sulfoniové soli (Ar2S+CF3SbF6−) byla připravena roku 1984 reakcí aryltrifluormethylsulfoxidu 1 s SF 3
+ SbF −
6 následovanou reakcí s arenem bohatým na elektrony.[61] tato látka se používala k trifluormethylaci thiofenolátů. Tetrafluorboritan S-(trifluormethyl)dibenzothiofenia představuje komerčně dostupné trifluormethylační činidlo fungující stejným způsobem; poprvé byl připraven v roce 1990.[62][63] U tohoto druhu sloučenin může být síra nahrazena kyslíkem, selenem nebo tellurem. Jako substráty je možné použít například pyridin, anilin, trifenylfosfin a lithnou sůl fenylacetylenu.
 |
 |
 |
| 5-(trifluormethyl)dibenzothiofeniumtrifluormethansulfonát | Tetrafluorboritan 5-(trifluormethyl)dibenzothiofenia | 3,3-dimethyl-1-(trifluormethyl)-1,2-benziodoxol |
Další skupinou donorů trifluormethylové skupiny jsou hypervalentní sloučeniny CF3 s trojmocným jodem jako například 3,3-dimethyl-1-(trifluoromethyl)-1,2-benziodoxol.[64][65][66][67] Substráty zde mohou být thioly, alkoholy, fosfiny, areny,[68] neaktivované alkeny[69] a nenasycené karboxylové kyselny.[70]
 |
| Trifluormethylace na thiolové skupině pomocí hypervalentního jodu[68] |
Remove ads
Asymetrická trifluormethylace
Během asymetrické trifluormethylace se trifluormethylová skupina na substrát připojuje enantioselektivně.[71][72] K dosažení enantioselektivity lze použít Ruppertova činidlo, s nímž je možné připravit deriváty chirálních aminokyselin,[73] sacharidů[74] a steroidů. Jako katalyzátory se také používají chirální amoniumfluoridy.[75][76] K prvním popsaným elektrofilním asymetrickým trifluormethylacím patří například reakce enolátů kovů s trifluormethylchlakogenovými solemi za přítomnosti chirálního katalyzátoru s obsahem boru.[77]
 |
 | |
| Asymetrická trifluorace popsaná v roce 1994[75] | Asymetrická trifluorace popsaná v roce 2003[76] |
Později byly objeveny velmi enantioselektivní metody α trifluormethylace aldehydů karbonylových sloučenin pomocí fotoredoxních katalyzátorů, například tris(bipyridin)chloridu ruthenatého[78] nebo jodonia.[79] Trifluormethylaci je možné provést i u β ketoesterů[80] a též u enolátů zirkonia, v tomto případě probíhá jako radikálová adice, katalyzovaná sloučeninami ruthenia.[81]
Remove ads
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
