Ниобиум
From Wikipedia, the free encyclopedia
Remove ads
Ниобиум, порано познат како колумбиум, е хемиски елемент со симбол Nb (порано познат како Cb) и атомски број 41. Ниобиумот е мек, сив, кристален, нодуларен преоден метал, кој често се наоѓа во минералите пирохлор и колумбит, па оттука доаѓа и претходното име „колумбиум“. Името потекнува од старогрчката митологија Ниоба, која била ќерка на Тантал.. Името на елементот одразува голема сличност помеѓу двата елементи во нивните физички и хемиски својства, што ги прави тешко да се разликуваат.[2]
Англискиот хемичар Чарлс Хатет во 1801 година објавил нов елемент сличен на тантал и го нарекол колумбиум. Во 1809 година, англискиот хемичар Вилијам Хајд Воластон погрешно заклучил дека тантал и колумбиум се идентични. Германскиот хемичар Хајнрих Роуз во 1846 година утврдил дека талантските руди содржат втор елемент, кој го нарекол ниобиум. Во 1864 и 1865 година, серија научни сознанија појасниле дека ниобиум и колумбиум биле ист елемент (како што се разликувал од тантал), и за еден век двете имиња биле користени наизменично. Ниобиумот официјално бил усвоен како име на елементот во 1949 година, но името Колумбиум останува во сегашната употреба во металургијата во САД.
Од почетокот на 20 век, ниобиумот првпат се користел комерцијално. Бразил е водечки производител на ниобиум и ферониобиум, легура од 60-70% ниобиум со железо. Ниобиумот најчесто се користи во легури, најголем дел во специјалниот челик, како и оној што се користи во гасоводот. Иако овие легури содржат максимум 0,1%, малиот процент на ниобиум ја зголемува цврстината на челикот. Стабилноста на температурата на ниобиум содржат суперлегури, и е од голема важност за неговата употреба во авионите и ракетните мотори.
Ниобиум се користи во разни суперпроводливи материјали. Овие суперпроводливи легури, кои содржат титаниум и калај, се широко користени во суперпроводните магнети на скенери за МРИ. Други апликации на ниобиум вклучуваат заварување, јадрена индустрија, електроника, оптика, нумизматика и накит.
Remove ads
Историја


Ниобиумот бил идентификуван од страна на англискиот хемичар Чарлс Хатет во 1801 година.[3][4][5] Тој пронашол нов елемент во минерален примерок кој бил испратен во Англија од Конектикат, САД во 1734 година од страна на Џон Винтроп ФРС (внук на Џон Винтроп Помладиот ) и го именувал минералниот колумбит и новиот елемент колумбиум по Колумбија, поетското име за САД.[6][7][8] Колумбиумот бил откриен од Хатчет, која била најверојатно мешавина од новиот елемент заедно со тантал.[6]
По извесно време, се појавила значителна конфузија [9] околу разликата помеѓу колумбиумот (ниобиум) и тесно поврзаниот тантал. Во 1809 година, англискиот хемичар Вилијам Хајд Воластон ги споредувал оксидите добиени од колумбиум-колумбит, со густина 5.918 г/см3, и танталот- Tанталит, со густина над 8 г/см3, и заклучил дека двата оксиди, и покрај значителната разлика во густината, биле идентични. Така го задржало името Тантал.[9] Овој заклучок бил оспорен во 1846 година од страна на германскиот хемичар Хајнрих Роуз, која тврди дека има две различни елементи во примерокот од Tанталитот, и ги именувал по децата на Тантал : ниобиум (од Niobe ) и пелопиум (од Pelops ).[10][11] Оваа конфузија произлегла од минималните забележани разлики помеѓу тантал и ниобиум. Новите елементи пелопиј, илмениум и дијаниум [12], всушност биле идентични со ниобиумиот или мешавините на ниобиум и тантал.[13]
Разликите меѓу танталот и ниобиумот беа недвосмислено докажани во 1864 година од страна на Кристијан Вилхелм Бломстранд [13] и Анти Етјен Сент-Клер Девил, како и Луј Џ. Трост, кој ги утврдил формулите на некои од соединенијата во 1865 година [13][14] и конечно од страна на швајцарскиот хемичар Жан Чарлс Галисард де Марињица [15] во 1866 година, кој сите докажаа дека има само два елементи. Примероци на илмениумот продолжиле да се појавуваат до 1871 година.[16]
Де Mарињац бил првиот кој го подготвувил металот во 1864 година, кога го намалил ниобиевиот хлорид со загревање во атмосферата на водород.[17] Иако Де Mарињац бил во можност да произведува ниобиум без тантал во поголем обем до 1866 година, не било сè до почетокот на 20 век кога ниобиум бил користен во филаментовите на блескаво светило, првата комерцијална апликација.[14] Оваа употреба брзо стана застарена преку замена на ниобиум со волфрам, кој има повисока точка на топење. Тој ниобиум ја подобрува цврстината на челикот за кој за првпат бил откриен во 1920-тите, и оваа апликација и понатаму останува негова доминантна употреба.[14] Во 1961 година, американскиот физичар Јуџин Кунцлер и соработниците во Bell Labs откриле дека ниобиумот-калај продолжува да покажува суперспроводливост во присуство на силни електрични струи и магнетни полиња,[18] што го прави првиот материјал за поддршка на високите струи и полиња неопходни за корисно високомоќни магнети и машини за електрична енергија. Ова откритие овозможи - две децении подоцна - производство на долги мулти-влакнести кабли намотани во калеми за да се создадат големи, моќни електромагнети за ротирачки машини, акселератори на честички и детектори за честички.[19][20]
Именување на елементот
Колумбиумот (симбол "Cb") [21] било името што првично го доделува Хатхет по неговото откривање на металот во 1801 година.[4] Името се рефлектирало дека примерокот од рудата доаѓа од Америка ( Колумбија ).[22] Ова име останало во употреба во американските списанија - последниот труд објавен од страна на Американското хемиско друштво со колумбиум во нејзиниот наслов кое датира од 1953 година [23] - додека во Европа бил употребен ниобиумот. За да се стави крај на оваа конфузија, името ниобиум беше избран за елемент 41 на 15-та Конференција на Сојузот на хемијата во Амстердам во 1949 година.[24] Една година подоцна ова име беше официјално усвоено од страна на Меѓународниот сојуз за чиста и применета хемија (ИУПАК) по 100 години контроверзии, и покрај хронолошката предност на името колумбиум,[24] IUPAC го прифатиле волфрамот во одбрана на употребата во Северна Америка; и ниобиум, наместо колумбиум, во Европа. Додека голем број американски хемиски друштва и владини организации обично го користат официјалното име на ИУПАК, некои металурзи и метални општества сè уште го користат оригиналното американско име, " колумбиум ".[25][26][27]
Remove ads
Особености
Физички
Ниобиум е сјаен, сив, нодуларен, парамагнетски метал во групата 5 од периодниот систем (види табела), со електронска конфигурација во најоддалечените школки атипични за групата 5. (Ова може да се забележи во соседството на рутениумот (44), родиум (45) и паладиум (46). )
Иако се смета дека има телесна кубична кристална структура од апсолутната нула до точката на топење, мерењата со висока резолуција на топлинското ширење по трите кристалографски оски откриваат анизотропии кои не се во согласност со кубична структура.[28] Затоа, се очекува понатамошно истражување и откривање во оваа област.
Ниобиумот станува суперпроводник при ниски температури. При атмосферскиот притисок, таа има највисока критична температура на елементарните суперпроводници на 9.2 К. [29] Ниобиум има најголема магнетна пенетрација на секој елемент.[29] Покрај тоа, тој е еден од трите елементарни Суперпроводници од тип II, заедно со ванадиум и технециум. Суперспроводните својства се силно зависни од чистотата на металиот ниобиум.[30]
Кога е многу чиста, таа е релативно мека и нодуларна, но нечистотијата го отежнува.[31]
Металот има низок пресек на зафаќање на топлински неутрони ;[32] така што се користи во јадрената индустрија каде што се сакани неутронски транспарентни структури.[33]
Хемиски
Металот има синкаста нијанса кога е изложен на воздух на собна температура на подолг временски период.[34] И покрај високата точка на топење во елементарна форма (2,468 °C), има помала густина од другите огноотпорни метали. Покрај тоа, тој е отпорен на корозија, покажува својства на суперспроводливост и формира диелектрични оксидни слоеви.
Ниобиумот е помалку електропозитивен и покомпактен од својот претходник во периодниот систем, циркониум, додека истиот е речиси идентичен со големите атоми на тантал, како резултат на контракцијата на лантаноид.[31] Како резултат на тоа, хемиските својства на ниобиумот се многу слични на оние за тантал, кој се појавува директно под ниобиум во периодниот систем.[14] Иако неговата отпорност на корозија не е толку извонредна како онаа на тантал, пониската цена и поголемата достапност го прават ниобиумот привлечен за помалкуте потребните апликации, како што се веѓите во хемиските постројки.[31]
Изотопи
Ниобиумот во Земјината кора се состои од еден стабилен изотоп, 93 Nb.[35] До 2003 година беа синтетизирани најмалку 32 радиоизотопи, кои се движеа со атомска маса од 81 до 113. Најстабилниот од овие е 92 Nb со полуживот од 34.7 милиони години. Еден од најмалку стабилните е 113 Nb, со проценета половина живот од 30 милисекунди. Изотопите кои се полесни од стабилната 93 Nb имаат тенденција да се распаѓаат со β + распаѓање, а оние кои се потешки имаат тенденција да се распаѓаат со β - распаѓање, со неколку исклучоци. 81 Nb, 82 Nb и 84 Nb има мали β + одложен емисија на протонската патеки на забите, 91 Nb распаѓа со фаќање на електрони и позитрон емисиона, а 92 Nb распаѓа со двете β + и β - распаѓање.[35]
Опишани се најмалку 25 јадрени изомери, кои се движат со атомска маса од 84 до 104. Во рамките на овој опсег, само 96 Nb, 101 Nb и 103 Nb немаат изомери. Најстабилните изомери на ниобиумот се 93m Nb со полуживот од 16.13 години. Најмал стабилен изомер е 84m Nb со полуживот од 103 ns. Сите изомери на ниобиумот се распаѓаат со изомерна транзиција или бета распаѓање освен 92m1 Nb, која има мала гранка на електронски зафати.[35]
Појава
Ниобиум се проценува дека е 34-ти најчест елемент во Земјината кора, со 20 ppm.[36] Некои мислат дека изобилството на Земјата е многу поголемо и дека високата густина на елементите го концентрирала во јадрото на Земјата.[26] Слободниот елемент не е пронајден во природата, но ниобиум се јавува во комбинација со други елементи во минералите.[31] Минералите што содржат ниобиум често содржат и тантал. Примерите вклучуваат колумбит (Fe, Mn) (Nb, Ta) 2 O 6 ) и колумбит-танталит (или coltan, (Fe, Mn) (Ta, Nb) 2 O 6 ).[37] Колумбит-танталитните минерали (најчести видови се колумбит- (Fe) и танталит- (Fe), каде што "- (Fe)" е наставката на Левинсон, кој известува за преовладувањето на железото над други елементи како манганот [38][39][40][41] ) најчесто се наоѓаат како помошни минерали во упадите на пегматит и во алкалните интрузивни карпи. Помалку чести се ниобатите на калциум, ураниум, ториум и ретки земјени елементи. Примери за такви ниобати се пирохлор ((Na, Ca) 2 Nb 2 O 6 (OH, F)) (сега е име на група, со релативно чест пример, на пример, флуоркалциопирохлор [42][43][40][41][44] ) и еуксенит (правилно именуван еуксенит (Y) [45][40][41] ) ((Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2 O 6 ). Овие големи депозити на ниобиум се пронајдени поврзани со карбонатити ( карбонат - силикатни магнетни карпи ) како составен дел на пирохлорот.[46]
Трите најголеми рудници на пирохлор, два во Бразил и еден во Канада, беа пронајдени во 1950-тите и сè уште се главни производители на концентрати на ниобиум минерали.[14] Најголем депозит е домаќин во упад на карбонат во Аракса, државата Минас Жераис, Бразил, во сопственост на CBMM ( Companhia Brasileira de Metalurgia e Mineração ); другиот активен бразилски депозит се наоѓа во близина на Каталоан, држава Гојас, а е во сопственост на Кина молибден, која исто така, била домаќин на упад на карбонат.[47] Заедно, овие два рудници произведуваат околу 88% од понудата во светот.[48] Бразил, исто така, има голем, но сепак неискористен депозит во близина на Сао Габриел да Качеира, држава Амазонас, како и неколку помали депозити, особено во државата Рораима.[48]
Третиот најголем производител на ниобиум е рудникот Ниобек, во кој се наоѓа во карбонат, во Сен-Оноре, во близина на Чикутими, Квебек, Канада, во сопственост на Magris Resources.[49] Таа произведува помеѓу 7% и 10% од понудата во светот.[47][48]
Remove ads
Производство

При одвојувањето, од другите минерали се добиваат мешаните оксиди од тантал Ta 2 O 5 и ниобиум Nb 2 O 5. Првиот чекор во обработката е реакцијата на оксидите со флуороводородна киселина :[37]
- Ta 2 O 5 + 14 HF → 2 H 2 [ TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [ NbOF 5 ] + 3 H 2 O
Првата индустриска разделба, развиена од Де Марињац, ги експлоатирал различните раствори на комплекс ниобиум и тантал флуориди, дикатисиум оксипентафлуоробиобен монохидрат (K 2 [ NbOF 5 ] · H 2 O) и дикатисиум хептафлуоронтанталат (K 2 [ TaF 7 ] ) кај вода. Поновите процеси ја користат течната екстракција на флуориди од воден раствор со органски растворувачи како циклохексанон.[37] Комбинираниот ниобиум и тантал флуори се екстрахираат одвоено од органскиот растворувач со вода и или се преципираат со додавање на калиум флуорид за да се добие комплекс од калиум флуорид или да се предизвика со амонијак како пентоксид:[50]
- H 2 [ NbOF 5 ] + 2 KF → K 2 [ NbOF 5 ] ↓ + 2 HF
проследена со:
- 2 H 2 [ NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Неколку методи се користат за намалување на металниот ниобиум. Електролизата на стопена мешавина од K 2 [ NbOF 5 ] и натриум хлорид е една. А другата е намалување на флуоридот со натриум. Со овој метод може да се добие релативно висока чистота ниобиум. Во производството на големи размери, Nb 2 O 5 се намалува со водород или јаглерод.[50] Во алуро-топонична реакција, мешавина од железен оксид и ниобиум оксид реагира со алуминиум :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Мали количини на оксидирачи како натриум нитрат се додаваат за подобрување на реакцијата. Резултатот е алуминиум оксид и ферониобиум, легура на железо и ниобиум што се користат во производството на челик.[51][52] Ферониобиумот содржи помеѓу 60 и 70% ниобиум.[47] Без железен оксид, алуротоплинскиот процес се користи за производство на ниобиум. Понатамошно прочистување е неопходно да се достигне нивото на суперспроводните легури. Електронскиот сноп кој се топи под вакуум е методот што го користат двајцата главни дистрибутери на ниобиум.[53][54]
Од 2013[update] , ЦБММ контролира 85 проценти од светското производство на ниобиум.[55] Геолошкото истражување на САД проценува дека производството се зголемило од 38.700 тони во 2005 година на 44.500 тони во 2006 година.[56][57] Се проценува дека ресурсите во светот се 4.400.000 тони.[57] Во текот на десетгодишниот период помеѓу 1995 и 2005 година, производството повеќе од двојно, почнувајќи од 17.800 тони во 1995 година.[58] Помеѓу 2009 и 2011 година, производството беше стабилно на 63.000 тони годишно,[59] со мало намалување во 2012 година на само 50.000 тони годишно.[60]
Помалите износи се наоѓаат во Канјиака, Малави ( рудник Канјика ).
Remove ads
Соединенија
На многу начини, ниобиумот е сличен на танталот и циркониумот. Таа реагира со повеќето неметали на високи температури; со флуор на собна температура; со хлор и водород на 200 ° C ; и со азот на 400 °C, со производи кои често се интерстицијални и нестехиометриски.[31] Металот почнува да оксидира на воздух на 200 ° C. [50] Тој се спротивставува на корозијата со споени алкалии и со киселини, вклучувајќи аква регрија, хлороводородна, сулфурна, азотна и фосфорна киселина.[31] Ниобиум е нападнат од мешавини на флуороводородна киселина и флуороводородна / азотна киселина.
Иако ниобиумот ги прикажува сите формални состојби на оксидација од +5 до -1, најчестите соединенија имаат ниобиум во +5 состојба.[31] Карактеристично, соединенијата во оксидационите состојби имаат помалку од 5+ дисплеј Nb-Nb врска. Во водени раствори, ниобиумот ја покажува само оксидациската состојба +5. Исто така, е лесно склона кон хидролиза и едвај растворлив во разредени раствори на хлороводородна, сулфурна, азотна и фосфорна киселина поради таложење на хидроен Nb оксид.[53] Nb (V) исто така е малку растворлив во алкалните медиуми поради формирањето на растворливи полиоксиниобатни видови.[61][62]
Оксиди и сулфиди
Ниобиум формира оксиди во оксидационите состојби +5 ( Nb <sub id="mwAj8">2</sub> O <sub id="mwAkA">5</sub> ),[63] +4 ( NbO <sub id="mwAkI">2</sub> ), +3 ( Nb2O3 </br> Nb2O3 </br> Nb2O3 ),[50] и поретка оксидациона состојба, +2 ( NbO ).[64] Најчести се пентоксид, претходник на скоро сите соединенија на ниобиум и легури.[50][65] Ниобатите се генерираат со растворање на пентоксид во основни хидроксидни раствори или со топење во оксиди од алкални метали. Примери се литиум ниобат (LiNbO 3 ) и лантан ниобат (LaNbO 4 ). Во литиумот ниобатот е тригонски искривена перовскитна структура, додека NbO3−
4 на лантан содржи осамен NbO3−
4 јони.[50] Слојниот ниобиум сулфид (NbS 2 ) е исто така познат.[31]
Материјалите можат да бидат обложени со тенок филм од хемиска пареа на натопи од ниобиум (V) оксид или процеси на нанесување на атомски слој, произведени од топлинско разложување на ниобиум (V) етоксид над 350 °C.[66][67]
Халиди


Ниобиум формира халиди во оксидационите состојби на +5 и +4, како и разновидни субстеохиометриски соединенија.[50][53] Пентахалидите ( NbX5 ) прикажуваат октаедрични Nb центри. Ниобиум пентафлуорид (NbF 5 ) е бела цврста материја со точка на топење од 79,0 °C и ниобиум пентахлорид (NbCl 5 ) е жолто (види слика слева) со точка на топење од 203,4 °C. И двата се хидролизираат за да дадат оксиди и оксихариди, како што е NbOCl 3. Пентахлоридот е разновиден реагенс кој се користи за генерирање на органометални соединенија, како што е ниооблен дихлорид ( (C5H5)2NbCl2 ).[68] Тетрахалидите ( NbX4 ) се темно-обоени полимери со врски Nb-Nb; на пример, црниот хигроскопски ниобиум тетрафлуорид (NbF 4 ) и кафеавиот ниобиум тетрахлорид (NbCl 4 ).
Анјонските халидни соединенија на ниобиум се добро познати, што се должи делумно на киселоста на Луис од пентахалидите. Најважно е дека [NbF 7 ] 2-, е средно во одвојувањето на Nb и Ta од рудите.[37] Овој хептафлуорид има тенденција да го формира оксопентафлуоридот многу лесно отколку што соединението на тантал. Други халид комплекси вклучуваат октаедричен [NbCl 6 ] - :
- Nb 2 Cl 10 + 2 Cl - → 2 [NbCl 6 ] -
Како и кај другите метали со ниски атомски броеви, познати се различни редуцирани јони на халидните кластери, при што главниот пример е [Nb 6 Cl 18 ] 4-.[64]
Нитриди и карбиди
Други бинарни соединенија на ниобиум вклучуваат ниобиум нитрид (NbN), кој станува суперпроводник на ниски температури и се користи во детектори за инфрацрвена светлина.[69] Главната ниобиум карбид е NBC, исклучително тешко, огноотпорни, керамички материјал, што се користи комерцијално во сечење на алатка битови.
Remove ads
Апликации

Од 44.500 тони ниобиум миниран во 2006 година, околу 90% се користи во висококвалитетен структурен челик. Втората по големина апликација е суперфолија.[70] Суперпроводниците од легура на ниобиум и електронските компоненти сочинуваат многу мал дел од светското производство.[70]
Производство на челик
Ниобиум е ефикасен микроалкален елемент за челик, во кој се формира ниобиум карбид и ниобиум нитрид.[26]. Овие ефекти за возврат ја зголемуваат цврстината, силата, способноста за формирање и заварување.[26] Со микроалкилирани не’рѓосувачки челици, содржината на ниобиум е мала (помалку од 0,1% [71] ), но е важна примена на високоцврсти нисколегирани челици кои се широко користени во модерните автомобили.[26] Ниобиум понекогаш се користи во значително повисоки количини за машински компоненти отпорни на абење и ножеви, дури и 3% во не’рѓосувачки челик Crucible CPM S110V.[72]
Овие исти ниобиеви легури често се користат во конструкцијата на цевководот.[73][74]
Супер Легури

Количините на ниобиум се користат во никел, кобалт и железо- засновани суперлајои во пропорции до 6,5% [71] за такви примени како компоненти на моторните мотори, гасни турбини, ракетни подсимбли, системи за турбо полнач, отпорни на топлина и согорување опрема. Ниобиум предизвикува стврднување γ '' -фаза во структурата на зрната на суперлајонот.[75]
Еден пример суперлајој е Инконел 718, кој се состои од околу 50% никел, 18.6% хром, 18.5% железо, 5% ниобиум, 3.1% молибден, 0.9% титан и 0.4% алуминиум.[76][77] Овие суперлегури биле користени, на пример, во напредните системи за рамки на воздухот за програмата Гемини. Друга ниобиева легура се користела за млазницата на Модулот за сервис на Аполо. Бидејќи ниобиумот се оксидира на температура над 400 °C, потребна е заштитна облога за овие апликации за да се спречи лепењето на легурата.[78]
Легури засновани на ниобиум
C-103 легура била развиена во почетокот на 1960-тите заеднички од страна на Вах Чанг корпорација и Boeing Co ДуПонт, Унион карбид Корп, Генерал Електрик копродукции и неколку други компании се развиваат Nb-засновани легури истовремено, во голема мера управувано од Студената војна и Вселенска трка. Составена е од 89% ниобиум, 10% хафиум и 1% титан и се користи за распрскувачи на течни ракети, како што е главниот мотор на Аполо месечевите модули.[78]
Млазницата на серијата мотори на Мерлин вакуум развиена од SpaceX за горната фаза на ракетата 9 со сокол е направена од ниобиева легура.[79]
Реактивноста на ниобиум со кислород бара од него да се работи во вакуум или инертна атмосфера, со што значително се зголемуваат трошоците и тежината на производството. Вакуум лак преплавување (ВАР) и топење на електроните (EБM), нови процеси во тоа време, овозможија развој на ниобиум и други реактивни метали. Проектот кој дадоа C-103 почна во 1959 година со околу 256 експериментални ниобиум легури во "C-серијата" (веројатно од к оломбиум) кои можат да се стопи како копчиња и дојдов во лист. Вах Чанг имаше попис на хафиум, префинет од легури на јадрената циркониум, што сакаше да го стави на комерцијална употреба. 103-от експериментален состав на легурите на C-серијата, Nb-10Hf-1Ti, ја имаше најдобрата комбинација на способност за формирање и висока температура. Вах Чанг ја измислил првата топлина со C-103 од 500 фунти во 1961 година, ингота на лист, со користење на EБM и ВАР. Предвидените апликации вклучуваат турбински мотори и течни метални разменувачи на топлина. Конкурентните ниобиеви легури од тоа време вклучувале FS85 (Nb-10W-28Ta-1Zr) од Фенстил Металуршка Корпорација., Cb129Y (Nb-10W-10Hf-0.2Y) од Вах Чанг и Боинг, Cb752 (Nb-10W-2.5Zr) од Унија карбид, и Nb1Zr од Супериор Тјуб копродукции [78]
Суперспроводливи магнети
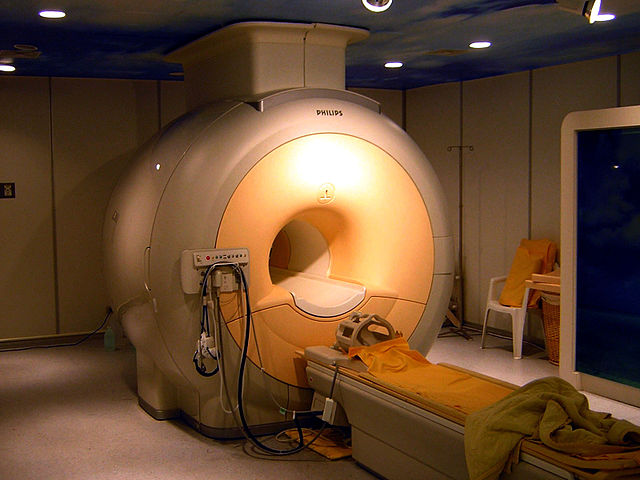
Ниобиум-германиум ( Nb3Ge </br> Nb3Ge ), ниобиум-калај ( Nb3Sn </br> Nb3Sn ), како и ниобиум-титанските легури се користат како суперспроводни жици од тип II за суперпроводски магнети.[80][81] Овие суперкомпјутери магнети се користат во магнетна резонанца и инструменти за јадрена магнетна резонанца, како и во акцелераторите на честички.[82] На пример, Големиот хадронски колајдер користи 600 тони суперспроводливи влакна, додека Меѓународниот термојадрен експериментален реактор користи околу 600 тони на Nb 3 Sn нишки и 250 тони NbTi синџири.[83] Само во 1992 година, повеќе од 1 американски долари милијарди вредни системи за клиничка магнетна резонанца беа изведени со жица од ниобиум-титан.[19]
Други суперпроводници

Суперспроводните радио честоти (СРФ) кои се користат во ласерите со слободен електрон ФЛЕШ (резултат на откажаниот TESLA линеарен акцелераторски проект) и XFEL се направени од чист ниобиум.[84] Тимот на криомодулите во Фермилаб ја користеше истата СРФ технологија од проектот ФЛЕШ за да развие 1.3 GHz девет-клеточни СРФ шуплини направени од чист ниобиум. Кавитетите ќе се користат во 30 километри линеарен забрзувач на честички на Меѓународниот линеарен колајдер.[85] Истата технологија ќе се користи во LCLS-II во SLAC National Accelerator Laboratory и PIP-II во Фермилаб.[86]
Големата чувствителност на суперспроводливите ниоби нитридни болометери ги прави идеален детектор за електромагнетно зрачење во честотниот опсег на THz. Овие детектори беа тестирани на телескопот Сублимиметер, Телескопот Јужниот Пол, Телексовиот ласерски телескоп и во АПЕКС, а сега се користат во инструментот на ХИФИ на опсерваторијата "Хершел".[87]
Други намени
Електрокерамика
Литиум ниобата, кој е фероелектрик, се користи широко во мобилните телефони и оптичките модулатори, како и за производство на површински акустични бранови. Таа му припаѓа на ABO <sub id="mwAws">3</sub> структурата на ферроелектричари како литиум танталат и бариум титанат.[88] Ниобиумските кондензатори се достапни како алтернатива на танталовите кондензатори,[89] но тантелските кондензатори сè уште преовладуваат. Ниобиум се додава во стакло за да се добие повисок показател на прекршување, што овозможува можни потенки и полесни корективни очила.
Хипоалергични апликации: медицина и накит
Ниобиум и некои ниобиеви легури се физиолошки инертни и хипоалергични. Поради оваа причина, ниобиумот се користи во простетиката и имплантските уреди, како што се пејсмејкерите.[90] Ниобиумот третиран со натриум хидроксид формира порозен слој кој помага при осеинтеграција.[91]
Како титан, тантал и алуминиум, ниобиумот може да се загрее и да се анодира ("реактивна анодизација на метали") за да се произведе широк спектар на расеани бои за накит,[92][93] каде што нејзината хипоалергенска особина е многу пожелна.[94]
Нумизматика
Ниобиум се користи како благороден метал во комеморативни монети, често со сребро или злато. На пример, Австрија произвела серија евро- монети од сребро ниобиум, почнувајќи од 2003 година; бојата на овие монети е создадена со дифракција на светлината со тенок анодизиран оксиден слој.[95] Во 2012 година, на располагање се десет монети кои покажуваат широк спектар бои во центарот на монетата: сина, зелена, кафеава, виолетова, виолетова или жолта. Два други примери се комеморативната монета од Австрија од 2004 година на алпската железничка пруга од 25 години 150 години,[96] и комеморативната монета за европска сателитска навигација од Австрија од 2006 година.[97] Австриската нанела за Латвија произведе слична серија монети, почнувајќи од 2004 година,[98] со една следна во 2007 година.[99] Во 2011 година, Кралската канадска наметка започна со производство на монетарна сребрена и ниобиева монета од 5 долари, наречена Хантер-Мун [100] во која ниобиумот селективно се оксидирал, создавајќи уникатни бои каде што не постојат две монети.
Друго
Плочата на лак-цевка на лампи од натриумска пареа под висок притисок се направени од ниобиум, понекогаш легиран со 1% циркониум ; ниобиумот има многу сличен коефициент на топлинско ширење, што одговара на синтеруваната цевка армија лак цевка керамика, проѕирен материјал кој се спротивставува хемиски напад или намалување од страна на топла течност натриум и натриум пареа содржани во внатрешноста на оперативната светилка.[101][102][103]
Ниобиум се користи во лаковите за заварување за некои стабилизирани степени од не’рѓосувачки челик [104] и во аноди за системи за катодна заштита на некои резервоари за вода, кои потоа обично се обложени со платина.[105][106]
Ниобиум е важна компонента на хетерогени катализатори со високи перформанси за производство на акрилна киселина со селективна оксидација на пропан.[107][108][109][110]
Ниобиум се користи за да се направи високонапонската жица на модулот за рецептори на честичките Сончева корона на сончевата сондата Parker [111]
Remove ads
Мерки на претпазливост
Ниобиум нема позната биолошка улога. Додека ниобиевата прашина е раздразнувач за око и кожа и потенцијална опасност од пожар, елементарниот ниобиум во поголем обем е физиолошки инертен (и со тоа хипоалергичен) и безопасен. Често се користи во накит и е тестиран за употреба во некои медицински импланти.[113][114]
Нивобиумските соединенија ретко се среќаваат кај повеќето луѓе, но некои се токсични и треба да се третираат со внимание. Кратката и долготрајната изложеност на ниобати и ниобиум хлорид, две хемикалии кои се растворливи во вода, биле тестирани кај стаорци. Стаорци третирани со единечна инјекција на ниобиум пентахлорид или ниобати покажуваат средна смртоносна доза (ЛД 50 ) помеѓу 10 и 100 mg / kg.[115][116][117] За орална администрација токсичноста е помала; студија со стаорци даде ЛД 50 по седум дена од 940 година mg / kg.[115]
Remove ads
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




