Karbono (latine carbo: "karbo") estas kemia elemento kun simbolo C kaj atomnumero 6. Ĝi estas nemetala kaj kvarvalenta—kvar el ĝiaj elektronoj povas formi kovalentajn ligojn. Ĝi apartenas al grupo 14 de la perioda tabelo.[2] Karbono faras nur ĉirkaŭ 0,025% de la krusto de Tero.[2] Tri izotopoj okazas nature, 12C kaj 13C restas stabilaj, kvankam 14C estas radioaktiva kaj havas duonvivon de ĉirkaŭ 5 730 jaroj.[3] Karbono estas unu el la malmultaj elementoj konataj ekde antikvo.[4]
| Ĉi tiu artikolo temas pri kemia elemento. Por terhistoria epoko rigardu la paĝon Karbonio. Por solida fosilia brulaĵo legu la artikolon Terkarbo. Koncerne aliajn signifojn aliru la apartigilon Karbo (apartigilo). |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kemia elemento • atmophile element | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| poliatoma nemetalo • nemetalo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ĝeneralaj informoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomo (latine), simbolo, numero | karbono (carbonium), C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-numero | 7440-44-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Karakteriza grupo | (nespecifita) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| abundeco en terkrusto | 0,087 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombro de naturaj izotopoj | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomaj ecoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativa atompezo | 12,0096-12,0116[1] amu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenta radiuso | 76 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiuso de van der Waals | 170 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrona konfiguracio | 1s2 2s2 2p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronoj en ĉiu energia ŝelo | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidiĝa nombro | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikaj ecoj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Materia stato | solida | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Degelpunkto | 3642 °C (3915 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diversaj | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativeco | 2.55 (Pauling-skalo) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Se ne estas indikite alie, estas uzitaj unuoj de SI kaj SVP. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Karbono estas la 15-a plej abunda elemento en la krusto de la Tero kaj la kvara plej abunda en la universo post hidrogeno, heliumo kaj oksigeno. Pro ĝia abundeco, unika diverseco de organikaj substancoj kaj ĝia nekutima kapablo formi polimerojn je la temperaturoj pli oftaj sur Tero, tiu elemento troviĝas en ĉiu konata vivo-formo. Ĝi estas la dua plej abunda elemento en la homa korpo (ĉirkaŭ 18,5% laŭ maso) post oksigeno.
La atomoj da karbono aranĝas plurmaniere, kaj tio rezultas en diversaj alotropoj. Ĝiaj plej konataj alotropoj estas grafito, diamanto, amorfa karbono, kaj fulereno.[5] La fizikaj ecoj de karbono vaste varias laŭ la alotropa formo. Ekzemple, grafito estas maldiafana kaj nigra dum diamanto estas tre travidebla. Grafito estas sufiĉe mola por formi strion sur papero (tial ties nomo, el la greka verbo "γράφειν" kiu signifas "skribi"), dum diamanto estas la plej dura nature okazanta materialo konata. Grafito estas bona elektra konduktanto sed diamanto estas izolaĵo. Sub normalaj kondiĉoj, diamanto, nanotuboj de karbono kaj grafeno estas la plej bonaj varmokonduktantoj de ĉiuj konataj materialoj. Sub normaj kondiĉoj pri temperaturo kaj premo, ĉiuj karbonalotropoj estas solidaj, kaj grafito estas la plej termodinamike stabila formo. Ili estas inertaj kaj bezonas altan temperaturon por reagi eĉ kun oksigeno.
La plej ofta oksidiĝa nombro de karbono en neorganikaj kombinaĵoj estas +4, dum +2 troviĝas en karbona monooksido kaj en transirmetalaj karbonilaj kompleksoj. La plej grandaj fontoj de neorganika karbono estas kalkoŝtonoj, dolomitoj kaj karbona dioksido, sed signifaj kvantoj okazas en organikaj ercoj da karbo, torfo, petrolo kaj metano-klatratoj. Karbono formas vastan nombron da kombinaĵoj, pli ol iu alia elemento, kun preskaŭ dek milionoj da kombinaĵoj konataj ĝis nun, tamen tiu nombro estas nur frakcieto de la nombro da teorie eblaj kombinaĵoj sub normaj kondiĉoj.[6] Tial, oni priparolas karbonon kiel la "reĝo de la elementoj".

Inter la alotropoj da karbono estas grafito, unu el la plej molaj substancoj kaj diamanto, la plej dura natura substanco. Ĝi facile ligiĝas kun aliaj malgrandaj atomoj, inkluzive kun aliaj karbonaj atomoj kaj povas formi plurajn stabilajn kovalentajn ligojn kun taŭgaj plurvalentaj atomoj. Karbono kapablas formi preskaŭ dek milionojn da kombinaĵoj, la plimulto de ĉiuj kemiaj kombinaĵoj.[6] Karbono ankaŭ havas la plej altan subliman punkton de ĉiuj elementoj. Ĉe atmosfera premo ĝi ne havas fandopunkton, ĉar ĝia triobla punkto estas ĉe 10,8 ± 0,2 megapaskaloj (106,6 ± 2,0 atm) kaj 4 600 ± 300 K (4 330 ± 300 °C), do ĝi sublimas ĉe pli ol 3 900 K (3 630 °C).[7] Grafito estas multe pli reaktiva ol diamanto ĉe normaj kondiĉoj, eĉ malgraŭ tio, ke grafito estas pli termodinamike stabila, ĉar ties pi sistemo estas multe pli vundebla. Ekzemple, sub normaj kondiĉoj, grafito oksidiĝas de varma koncentrata nitrata acido al mielita acido, C6(CO2H)6, kiu konservas la sesangulajn unuojn de grafito dum la pli granda strukturo rompiĝas.[8]
Karbono sublimas en karbona arko, kiu havas temperaturon de ĉirkaŭ 5 800 K (5 530 °C). Tiel, sendepende de ties alotropa formo, karbono restas solida ĉe pli altaj temperaturoj ol la metaloj kun la plej alta fandopunkto, kiel tungsteno aŭ renio. Kvankam termodinamike vundebla al oksidiĝo, karbono rezistas pli efike ol elementoj kiel fero kaj kupro, kiuj estas pli malfortaj reduktantaj agentoj ĉe ĉambra temperaturo.
Karbono estas la sesa elemento, kun elektra konfiguracio de 1s22s22p2, de kiu la kvar plej eksteraj elektronoj estas valentaj. Ĝiaj unuaj kvar jonigaj energioj, 1 086,5, 2 352,6, 4 620,5 kaj 6 222,7 kJ/Mol, estas multe pli altaj ol tiuj de la pli pezaj elementoj de grupo 14. La elektronegativeco de karbono estas 2,5, signife pli alta ol la pli pezaj elementoj de grupo 14 (1,8-1,9), sed proksime al la plimulto de la apudaj nemetaloj kaj ankaŭ al iuj el la transirmetaloj de la periodoj 3 kaj 4. La kovalentaj radiusoj de karbono estas normale konsiderata kiel 77,2 pm (C-C), 66,7 pm (C=C) kaj 60,3 pm (C≡C), kvankam tiuj povas varii depende de kunordigonombro kaj de kio la karbono ligas. Ĝenerale, la kovalenta radiuso malpliiĝas kun pli malalta kunordigonombro kaj pli alta ligo-ordo.
Karbonkombinaĵoj formas la bazon de ĉiuj konataj vivoformoj sur la Tero, kaj la karbon-nitrogena ciklo provizas iom de la energio produktita de la Suno kaj aliaj steloj. Kvankam karbono formas specialan gamon da kombinaĵoj, la plejparto de ĝiaj formoj estas relative nereaktivaj sub normaj kondiĉoj. Ĉe norma temperaturo kaj premo, ĝi rezistas al ĉiuj krom la plej fortaj oksidigantoj. Ĝi ne reagas kun sulfata acido, klorida acido, kloro aŭ ajnaj alkalaj metaloj. Ĉe altaj temperaturoj, karbono reagas kun oksigeno por formi karbonajn oksidojn, kaj ŝtelas oksigenon de metaloksidoj. Oni uzas tiun eksoterman reakcion en la metalurgio por forĝi feron kaj por regi la karbonenhavon de ŝtalo:
- Fe3O4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
Karbona monooksido povas esti reciklata por forĝi eĉ pli da fero:
- Fe3O4 + 4 CO(g) → 3 Fe(s) + 4 CO2(g)
kiu ligas al sulfuro por formi karbonan disulfidon kaj kun vaporo en la karbo-gasa reago:
- C(s) + H2O(g) → CO(g) + H2(g).
Karbono ligas al kelkaj metaloj ĉe altaj temperaturoj por formi metalajn karbidojn, kiel ekzemple la ferkarbidocementidon en ŝtalo, kaj volframkarbidon, vaste utiligata kiel abraziloplej molaj kaj por farado de malmolaj pintoj por tranĉiloj.
La sistemo de karbonalotropoj formas gamon da ekstremaĵoj:
| Grafito estas unu el la plej molaj materialoj. | Sinteza nanokrstala diamanto estas la plej dura materialo.[9] |
| Grafito estas tre bona lubrikaĵo, montrante superlubrikeco.[10] | Diamanto estas la plej forta abrazivo. |
| Grafito estas elektra konduktanto.[11] | Diamanto estas bonega elektra izolaĵo kaj havas la plej altan elektran rezistancon.[12] |
| Kelkaj formoj de grafito estas uzataj por varmoizolaĵo (t.e. refraktaraj materialoj kaj kontraŭvarmaj ŝildoj), sed kelkaj aliaj formoj estas bonaj varmokonduktantoj. | Diamanto estas la plej bona varmokonduktanto nature okazanta. |
| Grafito estas opaka. | Diamanto estas tre travidebla. |
| Grafito kristaligas en heksagona sistemo. | Diamanto kristaliĝas en kuba sistemo. |
| Amorfa karbono estas tute izotropa. | Nanotuboj de karbono estas inter la plej anizotropaj materialoj. |
Alotropoj
Atoma karbono estas tre efemera specio kaj tial, karbono stabilas en diversaj pluratomaj strukturoj kun diversaj molekulaj konfiguracioj kiuj nomiĝas alotropoj. La tri plej konataj alotropoj de karbono estas amorfa karbono, grafito kaj diamanto. Iam konsiderataj ekzotaj, fulerenoj estas nuntempe ofte sintezataj por uzi en esploro; ili inkludas buckminster-fulerenojn, nanotubojn, nanobastonetojn kaj nanofibrojn de karbono.[13] Aliaj ekzotaj alotropoj ankaŭ estis eltrovitaj, kiel lonsdalito, vitreca karbono, karbono nanoŝauma kaj linia etina karbono (karbino).[14][15]
Grafeno estas du-dimensiaj folioj de karbono kun atomoj aranĝitaj en sesangula krado. Ekde 2009, grafeno estas la plej forta materialo iam ajn elprovita.[16][17] La procezo apartigi ĝin de grafito postulos plian teknologian evoluadon antaŭ ol ĝi estu ekonomia por industriaj procezoj.[18] Se sukcesa, oni povos uzi grafenon en la konstruado de kosmolifto. Oni ankaŭ povus uzi ĝin por sekure enteni hidrogenon ene de motoroj de hidrogenaj aŭtomobiloj.

Trovejoj



Karbono estas la kvara plej abunda kemia elemento en la observebla universo post hidrogeno, heliumo kaj oksigeno. En julio 2020, astronomoj raportis indikon, ke karbono estis formita plejparte en blankaj nanaj steloj, precipe tiuj pli grandaj ol du sunaj masoj.[19][20] Karbono estas abunda en la Suno, steloj, kometoj kaj en la atmosferoj de plejmultaj planedoj.[21] Kelkaj aerolitoj enhavas mikroskopajn diamantojn kiuj estis formitaj kiam la suna sistemo estis ankoraŭ protoplaneda disko.[22] Mikroskopaj diamantoj ankaŭ povas formiĝi per intensa premo kaj alta temperaturo ĉe la ejoj de aerolitaj kolizioj.
Karbona ciklo

Ĉe surteraj kondiĉoj, tre malofte unu elemento konvertiĝas al alia. Tial, la kvanto de karbono sur Tero restas konstanta. Tiel, karbon-procezoj devas akiri ĝin de ie kaj forlasi ĝin alie. La vojoj de karbono en la naturmedio formas la karbono-ciklon. Ekzemple, fotosintezo kaptas karbonan dioksidon de atmosfero (aŭ marakvo) kaj ĝin konvertas al biomaso, kiel en la Kalvin-ciklo, procezo de karbona fiksado. Ioman biomason manĝas bestoj, kvankam ioman karbonon elspiris bestoj kiel karbona dioksido. La karbono-ciklo estas konsiderinde pli komplika ol tio; ekzemple, ioma karbona dioksido estas solvita en la oceanoj; se bakterioj ne konsumas ĝin, mortintaj plantoj aŭ bestaj ekskrementoj fariĝas petrolo aŭ karbo, kiu liberigas karbonon kiam oni bruligas ĝin.[23][24]
Organikaj kombinaĵoj

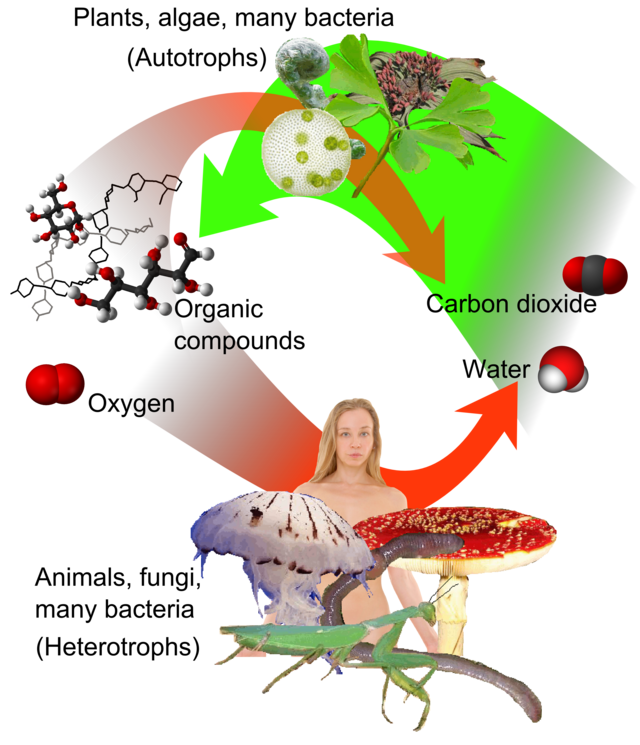
Karbono povas formi tre longaj ĉenoj da ligoj karbono–karbono, eco konata kiel katenado. Ligoj karbono-karbono estas tre fortaj kaj stabilaj. Tra katenado, karbono formas sennombrajn kombinaĵojn. Plejparte de ĉiuj unikaj kombinaĵoj enhavas karbonon.[25] La saman oni povas diri por hidrogeno ĉar plejpartoj de organikaj kombinaĵoj enhavas hidrogenon ligita al karbono aŭ alia ofta elemento kiel oksigeno aŭ nitrogeno.
La plej simpla klaso de organika molekulo estas la hidrokarbonoj — granda familio de organikaj molekuloj kiu enhavas hidrogenaj atomoj ligitaj al ĉeno de karbonaj atomoj. Hidrokarbona spino povas anstataŭigis de aliaj atomoj, konata kiel heteroatomoj. Oftaj heteroatomoj kiu aperas en organikaj kombinaĵoj estas oksigeno, nitrogeno, sulfuro, fosforo kaj la ne-radioaktivaj halogenoj, tiel kiel la metala litio kaj magnezio. Organikaj kombinaĵoj kun ligoj al metalo estas konataj kiel organometalaj kombinaĵoj. Certaj grupoj da atomoj, ofte kun heteroatomoj, ripetiĝas en granda nombro da organikaj kombinaĵoj. Ĉi tiuj grupoj, nomita funkciaj grupoj, formas skemon kiu permesas nian sisteman studon kaj kategoriado de organikaj kombinaĵoj. Ĉena longeco, formo kaj funkciaj grupoj ĉiuj influas en la stabileco de organikaj molekuloj.

La esperanta nomo karbono venas el la latina carbo por terkarbo kaj lignokarbo, el kie ankaŭ venas la francan charbon, signifanta karbo.[26] En la germana, nederlanda kaj dana, oni nomiĝas karbono Kohlenstoff, koolstof kaj kulstof respektive, ĉiuj laŭvorte signifante karbo-substanco.
Karbono estis eltrovita en prahistorio kaj estis konata de fruaj civilizacioj sub formo de fulgo kaj lignokarbo. Diamantoj verŝajne estas konata de 2 500 BCE en Ĉinio, kvankam karbono sub formo de karbo estis farita ekde Romaj tempoj de sama maniero ĝis nun, per varmiganta ligno en piramido kovrita kun argilo por ekskludi aeron.[27][28]

Dum 1722, René Antoine Ferchault de Réaumur montris ke fero estas transformita en ŝtalo tra la sorbo de iu substanco, nun sciita kiel karbono. Dum 1772, Antoine Lavoisier montris ke diamantoj estas formo de karbono; kiam li brulis specimenojn de karbo kaj diamanto kaj trovis ke ili ambaŭ ne produktis akvon kaj liberigis la saman kvanton de karbona dioksido por gramo. Dum 1779, Carl Vilhelmo Scheele montris ke grafito, kiu oni pensis esti formo de plumbo, estis identa al karbo sed kun malgranda miksaĵo de fero kaj ke ĝi liberigas "aeran acidon" (lia nomo por karbona dioksido) kiam oksidiĝita kun nitroza acido.[29][30] En 1786, la francaj sciencistoj Klaŭdo Louis Berthollet, Gaspard Monge kaj C. A. Vandermonde konfirmis ke grafito estas plejparte karbono per oksidado en oksigeno, simile al eksperimento de Lavoisier kun diamanto.[31] Iu fero denove estis lasita, do la francaj sciencistoj pensis ke ĝi estis necesa al grafita strukturo. En ilia eldono ili proponis la nomon carbone (latine carbonum) por la elemento en grafito kiu estis liberigita de brula grafito sub la formo de gaso. Antoine Lavoisier tiam enlistigis karbonon kiel elemento en sia lernolibro de 1789.[30]
Jean-Baptiste Dumas kaj Jean Stas establis la atompezon de karbono pesante specimenon de pura materialo, bruligante ĝin en pura oksigeno, kaj poste pesante la karbondioksidon produktitan ĉirkaŭ 1840.
Nova alotropo de karbono, fulereno, eltrovita dum 1985 enhavas nanostrukturajn formojn kiel buckminster-fulerenojn kaj nanotubojn.[13] Iliaj eltrovintoj – Robert Curl, Harold Walter Kroto kaj Richard Smalley – ricevis la Nobel-premion de Kemio en 1996.[32] La rezultinta renoviĝinta intereso pri novaj formoj kondukis al eltrovo de aliaj alotropoj, inkluzivanta de vitreca karbono kaj la eltrovo de ke "senforma karbono" ne estas strikte senforma.[33]
Grafito
Komerce uzeblaj naturaj rezervejoj da grafito ekzistas en multaj partoj de la mondo, sed la plej gravaj estas en Ĉinio, Barato, Brazilo kaj Nord-Koreio. Grafitaj ercoj havas metamorfan devenon, kaj estas trovita kune kun kvarco, glimo kaj feldspato en schists, gnejsoj kaj metamorfaj grejsoj kaj kalkoŝtono kiel lensoj aŭ vejnoj, foje de unu metro aŭ pli da dikeco. Rezervoj da grafito en Borrowdale, Cumberland, Anglio estis tiom granda kaj pura ke, ĝis la 19a jarcento, oni faris krajonoj simple per segado de blokoj de natura grafito en strioj antaŭ enfermante la striojn en ligno. Hodiaŭ, oni obtenis pli malgrandajn rezervojn da grafito per disbatado de la roko kaj flotado de ĝi sur akvo.
Diamanto

La diamanta provizoĉeno estas kontrolita de limhava nombro de potencaj kompanioj kaj estas ankaŭ tre koncentrita en malgranda nombro de lokoj ĉirkaŭ la mondo (vidu bildon).
En Usono, oni trovis diamantoj en Arkansaso, Koloradio kaj Montano.[34] En 2004, surpriza eltrovo de mikroskopa diamanto en Usono kaŭzis amasan specimenigon de kimberlitaj pipoj en izolita parto de Montano dum Januaro de 2008.[35][36]
Nuntempe, la plej grandaj diamantaj ercoj kun komerca valoro estas en Rusio, Bocvano, Aŭstralio kaj Demokrata Respubliko Kongo. En 2005, Rusio produktis preskaŭ unu-kvinono de la tutmonda diamanta produktado, kiel raportas British Geological Survey. Aŭstralio havas la plej riĉan diamantan minejon, kun produktadaj niveloj de 42 metraj tunoj (41 longaj tunoj; 46 mallongaj tunoj) jare dum la 1990-aj jaroj. Estas ankaŭ komercaj diamantaj minejoj aktivaj en la Nordokcidentaj Teritorioj de Kanado, Siberia (plejparte en Jakutia teritorio; ekzemple, Mir mino kaj Udachnaya mino), Brazilo kaj en Norda kaj Okcidenta Aŭstralio.


Karbono estas havenda al ĉiuj konataj vivaj sistemoj kaj sen ĝi vivo kiel ni scias ne povus ekzisti. Grava ekonomia uzo de karbono estas ne nur por manĝaĵo kaj ligno, sed ankaŭ por hidrokarbonoj, plej precipe la fosilia metana gaso kaj kruda petrola. Kruda petrolo estas distilita en rafinejoj de la petrolkemia industrio produkti benzinon, kerosene kaj aliaj produktoj. Celulozo estas natura karbonpolimero, produktita de plantoj sub la formo de ligno, kotono, lino kaj kanabo. Celulozo estas uzata por rezista strukturo en plantoj. Lano, kaŝmirlano kaj silko estas karbono-polimeroj de komerca valora kaj de besta deveno. Plastoj estas faritaj de sinteza karbono-polimeroj, ofte kun oksigenaj kaj nitrogenaj atomoj regule inkluzivita en la ĉefa polimerĉeno. La kruda materialo por multaj da tiuj sintezaj substancoj venas de kruda petrolo.
Uzado de karbono kaj de ties kombinaĵoj ekstreme varias. Ĝi formas alojojn kun fero, de kiuj karbonŝtalo estas la plej ofta. Grafito kombiniĝas kun argiloj por formi la ingoto uzata en krajonoj por skribi kaj desegni. Oni ankaŭ uzas ĝin kiel lubrikaĵo kaj pigmento, kiel muldanta materialo en glasa fabrikado, en elektrodoj por sekaj baterioj kaj en elektrolamenado kaj elektrometalurgio, en brosoj por elektromotoroj kaj kiel neŭtrona moderigilo en nukleaj reaktoroj.
Estas proksimume dek milionoj da malsamaj karbonaj kombinaĵoj en nia planedo. La organika kemio temas pri ili. Petrolo, alkoholo, sukero, ligno, karbo, lignokarbo, kaj koakso donas al ni energion kaj varmon por vivi. Ankaŭ nutraĵo donas al niaj korpoj energion kaj varmon. Pura karbono troviĝas en la naturo nur kiel karbo, grafito kaj diamanto. Jen la statoj de alotropo ekz.: grafito, diamanto, fulereno kaj grafeno.
La plej abunda izotopo de karbono, karbono-12, havas ses protonojn, ses neŭtronojn, kaj ses elektronojn. Ĉi tiu izotopo adoptiĝis en 1961 kiel la atompeza normo. Sub ordinara premo, karbono ne fandiĝas, sed je 3500 °C ŝanĝiĝas rekte en gason.
Karbono povas esti uzata por scii, kiel malnova estas aĵo. Estas du stabilaj izotopoj de karbono: 12C kaj 13C. Krome, ekzistas radioaktiva izotopo 14C. En la naturo, estas miksaĵo de la izotopoj, do kiam planto kreskas kaj enprenas karbonon ĝi prenas la miksaĵon de la CO2 en la atmosfero. Sed poste kiam la planto mortas, ĝi ne plu enprenas karbonon, kaj la izotopo 14 komencas malpliiĝi, ĉar ĝi estas radioaktiva. Kaj do post iom da tempo malpliiĝas la kompara kvanto de izotopo 14 kontraste al izotopo 12. Do, mezurante la du izotopojn, oni povas kalkuli, antaŭ kiom da tempo mortis la planto. Tio utilas ekzemple, kiam temas pri objekto farita el ligno.
En aktivado de vulkanoj ĝi aperas en formo de gasoj, nome CO2, CO, HCN kaj CH4. En sedimentoj ĝi troviĝas tre ofte kiel karbonatoj. La geokemia studo de la karbono alportas onin al organika geokemio, branĉo de la geokemio.
- Karbono en perioda tabelo
- Aspekto de grafito
- a) diamanto, b) grafito. c) sesangulaĵo, d) fulereno (C60), e) C540, f) C70, g) amorfa solido, h) nanotubo
- Baza fazodiagramo de karbono, kiu montras la statojn de materio por variaj temperaturo kaj premo. La kradaj regionoj indikas kondiĉojn, sub kiuj fazo estas metastabila, tiel ke du fazoj povas kunekzisti.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


