Oksigeno
kemia elemento kun simbolo O kaj atomnumero 8 From Wikipedia, the free encyclopedia
Remove ads
Oksigeno (latine Oxygenium) estas kemia elemento kun la simbolo O kaj la atomnumero 8. Kongrue al sia atomnumero ĝi troviĝas en la oka pozicio de la perioda tabelo kaj apartenas al la 16a grupo, la grupo de la ĥalkogenoj. Konsiderante la mason oksigeno estas la plej abunda elemento de la terkrusto (45,5%) kaj 89% de la maso de akvo (H2O) estas oksigeno.[2] Sub normalaj kondiĉoj oksigeno ekzistas kiel kovalenta duatoma molekulo konsistanta el du oksigenaj atomoj kun la resuma formulo O2 tiel nomata Dioksigeno. Ĝi estas senkolora kaj senodora gaso. La aero enhavas 20,942% da oksigeno. Ĝi rolulas en multaj brul- kaj korodiĝprocezoj. Ĝi ebligas la bruligon de la fueloj kiel gaso, benzino, oleo, mazuto, karbo, kaj ligno. Preskaŭ ĉiuj vivaĵoj bezonas oksigenon nepre por vivi (kutime plantoj tamen eligas dum fotosintezo pli da oksigeno ol ili forkonsumas). Plej ofte ili prenas ĝin per spiro el la aero aŭ per ensorbo el la akvo (solvita oksigeno). Altkoncentrite oksigeno estas venena al la plej multaj vivaĵoj. La metastabila, plienergienhava kaj reakciema alotropa formo de oksigeno, konsistanta el tri atomoj, nomiĝas Ozono (O3). Atoma oksigeno en la formo de unuopaj oksigenatomoj nur ekzistas sub ekstremaj kondiĉoj kiel ekzemple en la vakuo de la interstela spaco aŭ en varmegaj stelaj atmosferoj. Ĝi tamen agas kiel grava reakciema intermedia produkto en kelkaj reakcioj de atmosfera kemio.[3]
Remove ads
Historio de la studo
La moderna koncepto pri la elemento oksigeno disvolviĝis dum kvin jarcentoj kaj inkluzivis multajn rilatajn malkovrojn kaj malsukcesajn teoriojn. Pluraj homoj faris diversajn kontribuojn al la koncepto: neniu unuopa persono malkovris oksigenon.[4][5]
Fruaj eksperimentoj
Unu el la unuaj konataj eksperimentoj pri la rilato inter brulado kaj aero estis farita de la 2-a-jarcenta a.n.e. greka verkisto pri mekaniko, Filono de Bizanco. En sia verko Pneumatica, Filono observis, ke renversante vazon super brulanta kandelo kaj ĉirkaŭante la kolon de la vazo per akvo, iom da akvo leviĝas en la kolon.[6] Filono malĝuste supozis, ke partoj de la aero en la vazo konvertiĝis en la klasikan elementon fajro kaj tiel povis eskapi tra poroj en la vitro. Multajn jarcentojn poste Ibn al-Nafis, skribante en 1250 n.e., ĝuste priskribis oksigenadon de sango en la kardiovaskula sistemo; Mikaelo Serveto retrovis ĉi tiun koncepton en 1553, sed liaj libroj estis sisteme detruitaj.[4] Science bazita kaj influa priskribo estis publikigita de William Harvey en 1628.[7]
Leonardo da Vinci observis, ke parto de aero konsumiĝas dum brulado kaj spirado.[8] Pola alkemiisto, filozofo kaj kuracisto Michael Sendivogius (Michał Sędziwój), skribante en 1604,[9] priskribis substancon enhavitan en aero, nomante ĝin cibus vitae ('nutraĵo de vivo');[4] ĉi tiu substanco estas identa kun oksigeno.[10] Dum siaj eksperimentoj, faritaj inter 1598 kaj 1604, Sendivogius ĝuste rekonis, ke la substanco estas ekvivalenta al la gasa kromprodukto liberigita per la termika malkomponiĝo de kalia nitrato. Tamen, ĉi tiu grava ligo ne estis komprenita de samtempaj sciencistoj kiel Robert Boyle.[4][10]
Nekonscia pri la laboro de Sendivogius, John Mayow skribis pri parto de aero, kiu provizis varmon en fajro kaj la homa korpo. Ĉi tiu verko estis ignorita ĉar ĝi ne sukcesis kongrui kun la domina flogistona teorio pri aero kaj fajro. Mayow observis, ke antimono plipeziĝis kiam varmigita, kaj konkludis, ke la nitroaereus certe kombiniĝis kun ĝi.[11] Li ankaŭ pensis, ke la pulmoj apartigas nitroaereus de aero kaj pasas ĝin en la sangon kaj ke besta varmo kaj muskola movado rezultas el la reakcio de nitroaereus kun kelkaj substancoj en la korpo.[11] Raportoj pri tiuj kaj aliaj eksperimentoj kaj ideoj estis publikigitaj en 1668 en lia verko Tractatus duo en la traktaĵo "De respiratione".[12]
Post kiam Robert Boyle pruvis, ke aero estas necesa por brulado fine de la 17-a jarcento, la angla kemiisto John Mayow (1641–1679) rafinis ĉi tiun laboron montrante, ke fajro postulas nur parton de aero, kiun li nomis *spiritus nitroaereus*.[11] En unu eksperimento, li trovis, ke meti aŭ muson aŭ bruligantan kandelon en fermitan ujon super akvo igis la akvon leviĝi kaj anstataŭigi unu-kvarononon de la volumeno de la aero antaŭ ol estingi la subjektojn.[12] El tio, li supozis, ke *nitroaereus* estas konsumata kaj en spirado kaj en brulado.[13]
Flogista teorio
Robert Hooke, Ole Borch, Miĥail Lomonosov, kaj Pierre Bayen ĉiuj produktis oksigenon en eksperimentoj en la 17-a kaj 18-a jarcentoj, sed neniu el ili rekonis ĝin kiel kemian elementon.[14] Ĉi tio eble parte okazis pro la disvastiĝo de la filozofio pri brulado kaj korodo nomata la flogistona teorio, kiu tiam estis la preferata klarigo de tiuj procezoj.[15]

Establita en 1667 de la germana alkemiisto J. J. Becher, kaj modifita de la kemiisto Georg Ernst Stahl antaŭ 1731,[16] la flogista teorio asertis, ke ĉiuj brulemaj materialoj konsistas el du partoj. Unu parto, nomata flogisto, eliĝis kiam la substanco enhavanta ĝin bruliĝis, dum la senflogistigita parto estis konsiderata ĝia vera formo, aŭ kalko.[8]
Tre brulemaj materialoj, kiuj lasas malmulte da restaĵoj, kiel ekzemple ligno aŭ karbo, supozeble konsistas plejparte el flogisto; nebrulemaj substancoj, kiuj korodas, kiel ekzemple fero, enhavis tre malmulte. Aero ne ludis rolon en la flogista teorio, nek oni faris iujn ajn komencajn kvantajn eksperimentojn por testi la ideon; anstataŭe, ĝi baziĝis sur observaĵoj pri tio, kio okazas kiam io brulas, ke plej oftaj objektoj ŝajnas fariĝi pli malpezaj kaj perdi ion en la procezo.[8]
Scienca epoko
La sveda farmaciisto Carl Wilhelm Scheele produktis kaj priskribis kelkajn ecojn de oksigeno iam ĉirkaŭ 1770-1775, sed li ne publikigis sian laboron ĝis kelkaj jaroj poste[17] ĉar li ne kapablis interpreti siajn trovitaĵojn en la kadro de la flogista teorio.[4] Scheele estis produktinta oksigenan gason varmigante hidrargan oksidon (HgO) kaj variajn nitratojn en 1771–1772.[18][19][8] Post legado pri la laboro de Priestley en 1775, Scheele publikigis en 1777, nomante la gason "fajraero" ĉar ĝi tiam estis la sola konata agento subtenanta bruladon.[20]

Carl Wilhelm Scheele malkovris la elementon oksigeno en la jaro 1771 en Upsalo. La anglo Joseph Priestley sendepende malkovris ĝin en la jaro 1774 en Leeds. Scheele ektrovis, ke el varmigo de brunŝtono (mangana dioksido MnO2) aŭ kalia permanganato KMnO4 kun koncentrita sulfata acido (vitriolo) rezultas senkolora gaso. Tiu gaso favoras bruladon. Tial Scheele ĝin nomis ‚fajra aero‘ aŭ laŭ ĝia origino ‚vitriola aero‘. Li malkovris ke kutima aero konsistas el tiu ‚fajra aero‘ kaj alispeca ‚putra aero‘, kiu ne favoras bruladon. Priestley du jarojn pli poste ricevis oksigenon varmigante hidrargan oksidon HgO per lupeo. La brito publikigis siajn eltrovaĵojn en 1775, Scheele publikigis sian libron nur du jarojn pli poste, en 1777.[21] Priestley publikigis siajn trovitaĵojn en 1775 en artikolo titolita "An Account of Further Discoveries in Air" (Raporto pri Pliaj Malkovroj en Aero), kiu estis inkludita en la dua volumo de sia libro titolita Experiments and Observations on Different Kinds of Air (Eksperimentoj kaj Observaĵoj pri Malsamaj Specoj de Aero).[8][22]
Post malkovro de oksigeno ĝia rolo en brulado ankoraŭ estis nekonata. Ekde la ŝtonepoko kaj ĝis la mezepoko fajro estis por la homoj donaco de la ĉielo. Kelkspecajn ideojn pri la esenco de fajro kreis la antikvaj naturfilozofiistoj kaj la alĥemiistoj de la mezepoko. Georg Ernst Stahl ekverkis novan teorion pri brulado en la 17a jarcento. Li postulis ke ĉiu brulanta materio eligas specialan ege malpezan gasecan substancon, la tiel nomatan flogistono (aŭ flogisto), laŭ la greka φλογιστός ‚flogistos‘ „brulebla“, kiu kaŭzas la bruladon.
La franco kemiisto Antoine Lavoisier poste asertis esti malkovrinta la novan substancon sendepende. Priestley vizitis Lavoisier en oktobro 1774 kaj rakontis al li pri sia eksperimento kaj kiel li liberigis la novan gason. Scheele ankaŭ sendis leteron al Lavoisier la 30-an de septembro 1774, kiu priskribis sian malkovron de la antaŭe nekonata substanco, sed Lavoisier neniam agnoskis esti ricevinta ĝin (kopio de la letero estis trovita en la havaĵoj de Scheele post lia morto).[20]

Antoine Lavoisier dum siaj eksperimentoj ekkonis la elementan karakteron de oksigeno. Li eltrovis, ke dum brulprocesoj ne iu flogisto eliras la brulaĵon sed oksigeno estas kemie ligita per ĝi. Li konstatis ke la pezo de ia substanco dum brulado pligrandiĝas kontraste al la aserto de la ĝis tiam domininta teorio pri flogisto. La kialo por la pli granda pezo postbrula estis la oksigeno dum la brulado konsumita.[23]
Komence oni taksis oksigenon nepran komponanton de ĉiuj acidoj. Lavoisier tial proponis la nomon ‚oksygenium‘ laŭ la greka ὀξύς ‚oxys‘ „akra, acida“ kaj γεννᾰ́ω ‚gennao‘ „generi, fari, naski“, kune „acid-faranto“ en la jaro 1779.[24] Vere, multaj gravaj acidoj kiel sulfata acido, fosfata acido kaj nitrata acido enhavas oksigenon kaj nur pli poste oni eksciis, ke ne oksigeno sed hidrogeno kaŭzas ties acidecon.
Lavoisier renomis la "vital air" (viva aero) al oxygène en 1777 el la radikoj de la greka oxys (ὀξύς; "acido", laŭvorte 'akra', el la gusto de acidoj) kaj -genēs (-γενής; "produktanto", laŭvorte 'generinto'), ĉar li erare miskomprenis, ke oksigeno estas konstituanto de ĉiuj acidoj.[25] Kemiistoj (kiel Sir Humphry Davy en 1812) finfine determinis, ke Lavoisier malpravis en tiu aserto (ekz. Hidrogena klorido (HCl) estas forta acido kiu ne enhavas oksigenon), sed tiam la nomo estis bone establita.[26] La francdevena vorto oxygen eniris en la angla lingvo spite opozicion de anglaj sciencistoj kaj la fakto ke estis la angla Priestley kiu la unua izoligis la gason kaj verkis pri ĝi. Tio okazis parte pro poemo kiu temis pri la gaso titolita "Oxygen" en la populara libro The Botanic Garden (1791) de Erasmus Darwin, avo de Charles Darwin.[20]
Claude Louis Berthollet, kolego de Lavoisier, en 1787 montris ke hidrogena cianido HCN ne enhavas oksigenon kaj la anglo Humphry Davy pruvis en 1810 ke la gaso hidrogena klorido HCl ne enhavas oksigenon kaj tamen acidigas akvon.[27]
Moderna historio

La originala atomhipotezo de John Dalton supozis, ke ĉiuj elementoj estas unuatomaj kaj ke la atomoj en kombinaĵoj normale havus la plej simplajn atomproporciojn unu rilate al la alia. Ekzemple, Dalton supozis, ke la formulo de akvo estas HO, kondukante al la konkludo, ke la atomomaso de oksigeno estas 8-obla tiu de hidrogeno, anstataŭ la moderna valoro de ĉirkaŭ 16.[28] En 1805, Joseph Louis Gay-Lussac kaj Alexander von Humboldt montris, ke akvo konsistas el du volumoj da hidrogeno kaj unu volumeno da oksigeno; kaj antaŭ 1811 Amedeo Avogadro alvenis al la ĝusta interpreto de la konsisto de akvo, bazita sur tio, kio nun nomiĝas la leĝo de Avogadro, kaj la diatomaj elementaj molekuloj en tiuj gasoj.[29]
En 1879 la francaj fratoj Quentin kaj Arthur Brin malkovris komerce fareblan reakcion por krei oksigenon. Ili rimarkis, ke la konata reigebla reakcio 2BaO(s) + O2(g) ↔ 2BaO2(s) estis malaktivigita per la formado de baria karbonato el karbondioksido en la aero; traktado de aero por forigi la karbondioksidon permesis, ke la reakcio estu inversigita senfine. Ilia kompanio uzis la procezon inter 1886 kaj 1906, kiam pli ekonomia frakcia distilado komencis esti uzata.[30]

Fine de la 19-a jarcento, sciencistoj komprenis, ke aero povus esti likvigita kaj ĝiaj komponantoj izolitaj per kunpremado kaj malvarmigo. Uzante kaskadan metodon, la svisa kemiisto kaj fizikisto Raoul Pierre Pictet vaporigis likvan sulfuran dioksidon por likvigi karbondioksidon, kiu siavice estis vaporigita por malvarmigi oksigenan gason sufiĉe por likvigi ĝin. Li sendis telegramon la 22-an de decembro 1877 al la Franca Akademio de Sciencoj en Parizo, anoncante sian malkovron de likva oksigeno.[31] Nur du tagojn poste, la franca fizikisto Louis Paul Cailletet anoncis sian propran metodon por likvigi molekulan oksigenon.[31] Nur kelkaj gutoj de la likvaĵo estis produktitaj en ĉiu kazo kaj neniu senchava analizo povus esti farita. Oksigeno estis likvigita en stabila stato por la unua fojo la 29-an de marto 1883 fare de polaj sciencistoj de la Jagelona Universitato, nome Zygmunt Wróblewski kaj Karol Olszewski.[32]
En 1891, la skota kemiisto James Dewar kapablis produkti sufiĉe da likva oksigeno por studado.[33] La unua komerce realigebla procezo por produkti likvan oksigenon estis sendepende evoluigita en 1895 fare de la germana inĝeniero Carl von Linde kaj de la brita inĝeniero William Hampson. Ambaŭ viroj malaltigis la temperaturon de aero ĝis ĝi likviĝis kaj poste distilis la komponantajn gasojn per boligado de ili unu post la alia kaj kaptado de ili aparte.[34] Poste, en 1901, oksiacetilena veldado estis montrita por la unua fojo per bruligado de miksaĵo de acetileno kaj kunpremita O2.[34]
En 1923, la usona sciencisto Robert H. Goddard fariĝis la unua persono kiu disvolvis raketan motoron kiu bruligis likvan fuelon; la motoro uzis benzinon kiel fuelon kaj likvan oksigenon kiel oksidigilon. Goddard sukcese flugigis malgrandan likvaĵ-fuelan raketon 56 m je 97 km/h la 16-an de marto 1926, en Auburn, Masaĉuseco, Usono.[34][35]
Remove ads
Ecoj
Fizikaj ecoj
Oksigeno kutime estas senkolora gaso. Tamen ĝi povas aspekti blueta se ĝi estas alkoncentrita. Sufiĉe malvarmigite oksigeno fariĝas helblua likvaĵo, kiu vaporiĝas je sia bolpunkto de 90,18 K. La denso de la likvo je 90,19 K estas 1141,2 kg · m−3; tiu de la gaso je 294,25 K estas 1,3088 kg · m−3. Sub la fandopunkto je 54,4 K oksigeno solidiĝas kaj formas helbluajn kubajn kristalojn (γ-O2). Ankaŭ ekzistas romboedra (β-O2) sub 43,8 K kaj sub 23,89 K monoklina (α-O2) solidaj formoj.[36] Sian trifazan punkton oksigeno havas je temperaturo de 54,36 K kaj premo de 14,8 kPa. La sojla punkto troviĝas je temperaturo de 154.58 K kaj premo de 5043 kPa.[37]
Izotopoj
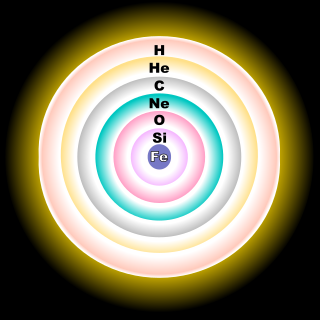
16O koncentriĝas en la O-ŝelo, 17O en la H-ŝelo kaj 18O en la He-ŝelo.
Estas tri stabilaj izotopoj de oksigeno. Estas ankaŭ 14 radioaktivaj izotopoj. La norma atompezo estas 15.9994(3) u.
Nature okazanta oksigeno estas komponita el tri stabilaj izotopoj, 16O, 17O kaj 18O. La 16O estas la plej abunda kun 99,762% en naturo.
Estas trovitaj 14 radioaktivaj izotopoj de oksigeno, iliaj masnumeroj estas ekde 12 ĝis 28. La plej stabila el ili estas 15O kun duoniĝotempo de 122,24 sekundoj kaj 14O kun duoniĝotempo de 70,606 sekundoj. La plej komuna disfala reĝimo por izotopoj malpli pezaj ol la stabilaj estas elektrona kapto kaj la plej komuna reĝimo por izotopoj pli pezaj ol la stabilaj estas beto-disfalo. La disfalaj produktoj estas izotopoj de azoto kaj fluoro respektive.
Remove ads
Rezervejoj de oksigeno
Oksigeno estas unu el la pli abundaj elementoj de la Tero kaj ĉeestas granda porcio de ĉiu ĉefa rezervejo. For antaŭe la plej granda rezervejo de tera oksigeno troviĝas en silikataj kaj mineralaj oksidoj de la terkrusto kaj la termantelo (99.5% laŭ pezo).[38] La teraj atmosfero, hidrosfero kaj biosfero kune enhavas malpli ol 0.05% de la tuta tera oksigenmaso. Krom O2, aldonitaj oksigenaj atomoj ĉeestas laŭ variaj formoj disvastigitaj tra la surfacaj rezervejoj en la molekuloj de biomaso, H2O, CO2, HNO3, NO, NO2, CO, H2O2, O3, SO2, H2SO4, MgO, CaO, AlO, SiO2, and PO4.
Atmosfero
En atmosfero estas ~20.9% da oksigeno je volumeno, kio egalas al ĉirkaŭ 34 × 1018 moloj da oksigeno. Aliaj atmosferaj molekuloj, kiuj enhavas oksigenon estas ozono (O3), karbona dioksido (CO2), akvovaporo (H2O), kaj sulfuraj kaj nitrogenaj oksidoj (SO2, NO, N2O ktp).
Hipoksio estas termino kiu referencas al malalta enhavo de oksigeno. Normale, 20.9% el la gaso en la Atmosfero de la Tero estas oksigeno. La parta premo de oksigeno en la atmosfero estas de 20.9% el la totala barometria premo.[39]
Biosfero
En biosfero estas 22% da oksigeno je volumeno, ĉefe en komponantoj de organikaj kombinaĵoj (CxHxNxOx) kaj akvomolekuloj.
Hidrosfero
En hidrosfero estas 33% da oksigeno je volumeno, ĉefe en komponantoj de akvomolekuloj kun libera oksigeno kaj karbonataj acidoj (HxCO3)
En akvo, oksigenaj niveloj estas multe pli malaltaj, proksimume 7 ppm aŭ 0.0007% en bonkvalita akvo, kaj fluktuas loke depende el la ĉeesto de fotosintezaj organismoj kaj relativa distanco al la surfaco (se estas pli da oksigeno en la aero, ĝi disiĝos tra la parta premogradiento).[40]
Litosfero
En litosfero estas 46,6% da oksigeno je volumeno, ĉefe en silico (SiO2) kaj aliaj mineralaj oksidoj.
Produktado de O2 per fotosintezo
En natura medio, libera oksigeno estas produktita de la lum-aganta disigo de akvo per oksigena fotosintezo. Laŭ iuj taksoj, verdaj algoj kaj cianobakterioj en maraj medioj provizas ĉirkaŭ 70% de la libera oksigeno produktata sur la Tero, kaj la resto estas produktata de teraj plantoj[41]. Aliaj taksoj de la oceana kontribuo al atmosfera oksigeno estas pli altaj, dum kelkaj taksoj estas pli malaltaj, sugestante ke oceana produktado estus ~45% de la atmosfera oksigeno de la Tero ĉiujare[42].
Simpligita resumformo por fotosintezo estas[43]:
- 6 CO2 + 6 H2O + fotonoj → C6H12O6 + 6 O2
aŭ alivorte
- karbona dioksido + akvo + sunlumo → glukozo + dioksigeno .
Fotolitika oksigena evoluo okazas en la tilakoidaj membranoj de fotosintezaj organismoj kaj postulas la energion de kvar fotonoj. Multaj paŝoj estas implicitaj, sed la rezulto estas la formado de protona gradiento tra la tilakoida membrano, kiu estas uzata por sintezi adenozinan trifosfaton ( ATP) per fotofosforilado[44]. La O2-molekuloj restantaj (post ilia produktado el la akvaj molekuloj) estas liberigitaj en la atmosferon.
Remove ads
Oksigena ciklo

La oksigena ciklo estas biogeokemia ciklo, kiu klarigas la transformojn de oksigeno en la tera biosfero.
Estas nedisigeblaj de la karbona ciklo, ĉar ĝi okazas per la karbona dioksido uzata en la fotosintezo. Ĉi tiu lasta produktita oksigeno, kiu, tra la spirado de vivantaj organismoj, estas brulita por produkti karbonan dioksidon.
Finfine, fotosintezo kaj spirado kaŭzas la produktadon kaj ekvilibron de atmosferaj gasoj.
La du mekanismoj - CO2 + H2 O → sukeroj + oksigeno kaj inverse - determinas la fluojn de karbono kaj oksigeno.
Tiu ciklo ne inkludas la apartan ciklon oksigeno-ozono, kiu ĉefe okazas en la stratosfero.
Remove ads
Uzado
La ŝtala industrio uzas oksigenon por produkti ŝtalon, tiel forigante grandparton da karbono el ĝi laŭ ĝia dezirita kvalito. Veldistoj uzas oksigenon por havi varmegan flamon (je 3300C). Oni uzas likvan oksigenon en raketoj.
Kemiaj komponaĵoj
Bildaro
Referencoj
Vidu ankaŭ
Bibliografio
Eksteraj ligiloj
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


