Азот
хемиски елемент From Wikipedia, the free encyclopedia
Remove ads
Азот (лат.: Nitrogenium) — хемиски елемент; има симбол N и атомски број 7. Азотот е неметал и најлесниот член од групата 15 од периодниот систем на елементите, често наречени пниктогени. Тој е вообичаен елемент во Вселената, кој се проценува на седмото место во вкупното изобилство во Млечниот Пат и Сончевиот Систем. При стандардна температура и притисок, два атома на елементот се поврзуваат за да формираат N2, двоатомски гас без боја и мирис. N2 формира околу 78% од Земјината атмосфера, што го прави најзастапен хемиски вид во воздухот. Поради испарливоста на азотните соединенија, азот е релативно редок во цврстите делови на Земјата.
- За истоимената област во Македонија, погл. Азот (област).
За прв пат бил откриен и изолиран од шкотскиот лекар Даниел Радерфорд во 1772 година и независно од Карл Вилхелм Шеле и Хенри Кевендиш приближно во исто време. Името nitrogène било предложено од францускиот хемичар Жан-Антоан-Клод Шаптал во 1790 година кога било откриено дека азот е присутен во азотна киселина и нитрати. Антоан Лавоазје наместо тоа го предложил името azote, од старогрчкото ἀζωτικός „безживотен“, бидејќи е асфиксирачки гас; ова име се користи во голем број јазици и се појавува во англиските имиња на некои азотни соединенија како што се хидразин, азид и азосоединение.
Елементарниот азот обично се произведува од воздух со технологија за впивање со нишање на притисок. Околу 2/3 од комерцијално произведениот елементарен азот се користи како инертен (без кислород) гас за комерцијални намени како пакување храна, а голем дел од остатокот се користи како течен азот преку криогеника. Голем број на индустриски важни соединенија, како што се амонијак, азотна киселина, органски нитрати (пропеланти и експлозиви) и цијаниди, содржат азот. Екстремно силната тројна врска во елементарниот азот (N≡N), втората најсилна врска во која било двоатомска молекула после јаглерод моноксид (CO), доминира во азотната хемија. Ова предизвикува тешкотии и за организмите и за индустријата во претворањето на N2 во корисни соединенија, но во исто време тоа значи дека согорувањето, експлозијата или разградувањето на азотни соединенија за да се формира азотен гас ослободува големи количини често корисна енергија. Синтетички произведениот амонијак и нитрати се клучни индустриски ѓубрива, а нитратите од ѓубрива се клучни загадувачи во еутрофикацијата на водните системи. Освен неговата употреба во вештачки ѓубрива и енергетски складишта, азотот е составен дел на органски соединенија различни како арамиди кои се користат во ткаенина со висока цврстина и цијаноакрилат што се користат како суперлепак.
Азотот се наоѓа во сите организми, првенствено во аминокиселините (а со тоа и протеините), во нуклеинските киселини (ДНК и РНК) и во молекулата за пренос на енергија аденозин трифосфат. Човечкото тело содржи околу 3% азот по маса, четвртиот најзастапен елемент во телото по кислородот, јаглеродот и водородот. Азотниот циклус го опишува движењето на елементот од воздухот, во биосферата и органските соединенија, а потоа назад во атмосферата. Азотот е составен дел на секоја главна фарматолошка класа на лекови, вклучувајќи ги и антибиотиците. Многу лекови се имитирачки или пролекови на природни сигнални молекули што содржат азот: на пример, органските нитрати нитроглицерин и нитропрусид го контролираат крвниот притисок преку метаболизирање во азотен оксид. Многу значајни лекови кои содржат азот, како што се природниот кофеин и морфин или синтетичките амфетамини, делуваат на рецепторите на животинските невротрансмитери.
Remove ads
Историја

Азотните соединенија имаат многу долга историја, а амониум хлоридот му бил познат на Херодот. Тие биле добро познати во средниот век. Алхемичарите ја познавале азотна киселина како аква фортис (силна вода), како и други азотни соединенија како амониум соли и нитратни соли. Мешавината од азотни и хлороводородни киселини била позната како аква регија (кралска вода), позната по својата способност да го раствори златото, кралот на металите.[3]
Откривањето на азотот му се припишува на шкотскиот лекар Даниел Радерфорд во 1772 година, кој го нарекол штетен воздух.[4][5] Иако не го препознал како сосема поинаква хемиска супстанција, тој јасно го разликувал од „фиксниот воздух“ или јаглерод диоксидот на Џозеф Блек. Фактот дека постои некоја компонента во воздухот што не поддржува согорување му бил познат на Радерфорд, иако не бил свесен дека тоа е елемент. Азотот исто така бил проучуван во исто време од Карл Вилхелм Шеле,[6] Хенри Кевендиш,[7] и Џозеф Пристли,[8] кои го нарекувале изгорен воздух или флогистициран воздух. Францускиот хемичар Антоан Лавоазје го нарекува азотниот гас како „мефитски воздух“ или азот, од грчкиот збор άζωτικός (azotikos), „безживотен“, бидејќи е загушувачки (асфикција).[9][10] Во атмосфера на чист азот, животните се загушуваат, а пламенот се гаси. Иако името на Лавоазје не било прифатено на англиски, бидејќи било истакнато дека сите гасови освен кислородот се или загушувачки или целосно отровни, тој се користи на многу јазици (француски, италијански, португалски, полски, руски, албански, турски итн.; германското Stickstoff слично се однесува на истата карактеристика, т.е. многу азотни соединенија, како што се хидразин и соединенија на азидниот јон. Така, тоа довело до името „пниктогени“ за групата на чело со азот, од грчкото πνίγειν „да се задави“.[3]
Англискиот збор nitrogen (1794) влегол во јазикот од француското nitrogène, измислен во 1790 година од францускиот хемичар Жан-Антоан Шаптал (1756–1832), од француското nitre ( калиум нитрат, исто така наречено шалтер) и францускиот суфикс -gène, „производство“, од грчкото -γενής (-genes, „беготен“). Значењето на Чаптал било дека азот е суштински дел од азотна киселина, која пак се произведува од нитер. Во претходните времиња, нитерот се мешал со египетскиот „натрон“ (натриум карбонат) – наречен νιτρον (нитрон) на грчки – кој и покрај името не содржел нитрат.
Најраните воени, индустриски и земјоделски примени на азотни соединенија користеле шелетра (натриум нитрат или калиум нитрат), особено во барут, а подоцна и како ѓубриво. Во 1910 година, Лорд Рејли открил дека електричното празнење во азотниот гас произведува „активен азот“, монатомски алотроп на азот. „Вртливиот облак од сјајна жолта светлина“ произведен од неговиот апарат реагирал со жива за да произведе експлозивен жива нитрид.
Долго време, изворите на азотни соединенија биле ограничени. Природните извори потекнуваат или од биологијата или од депозитите на нитрати произведени од атмосферски реакции. Врзувањето на азотот со индустриски процеси како што се процесот Франк-Каро (1895-1899) и процесот Хабер-Бош (1908-1913) го олеснил овој недостиг на азотни соединенија, до степен до кој половина од глобалното производство на храна денес се потпира на синтетички азотни ѓубрива. Во исто време, употребата на Оствалдовиот процес (1902) за производство на нитрати од индустриско врзување на азот овозможило големо индустриско производство на нитрати како суровина во производството на експлозиви во Светските војни во 20 век.[11][12]
Азотот со двата хоризонтални соседи има предност за формирање на повеќе врски, обично со јаглерод, кислород или други атоми на азот, преку pπ–pπ интеракции. Така, на пример, азотот се јавува како двоатомски молекули и затоа има многу помало топење (-210 °C) и точки на вриење (−196 °C) од останатиот дел од неговата група, бидејќи N2 молекулите се држат заедно само со слаби вандервалсови заемни дејствија и има многу малку достапни електрони за да создадат значајни моментални диполи. Ова не е можно за неговите вертикални соседи; Така, азотни оксиди, нитрити, нитрати, нитро-, нитрозо-, азо- и диазо -соединенија, азиди, цијанати, тиоцијанати и имино -деривати не наоѓаат ехо со фосфор, арсен, антимон или бизмут. Меѓутоа, според истиот принцип, сложеноста на фосфорните оксокиселини не наоѓа ехо со азот. [1] Доколку се оставаат настрана нивните разлики, азотот и фосфорот формираат широка серија на соединенија еден со друг; овие имаат синџир, прстен и структури на кафез.[13]
Табела на топлински и физички својства на азотот (N2) при атмосферски притисок:[14][15]
| Температура (K) | Густина (kg m−3) | Специфична топлина (kJ kg−1 °C−1) | Динамички вискозитет (kg m−1 s−1) | Кинематички вискозитет (m2 s−1) | Топлинска спроводливост (W m−1 °C−1) | Топлинска дифузија (m2 s−1) | Пранделов број |
| 100 | 3.4388 | 1.07Предлошка:Figure spaceПредлошка:Figure space | 0 | 0 | 0.00958 | 0 | 0.768 |
| 150 | 2.2594 | 1.05Предлошка:Figure spaceПредлошка:Figure space | 0 | 0 | 0.0139Предлошка:Figure space | 0 | 0.759 |
| 200 | 1.7108 | 1.0429 | 0 | 0 | 0.01824 | 0 | 0.747 |
| 300 | 1.1421 | 1.0408 | 0 | 0 | 0.0262Предлошка:Figure space | 0 | 0.713 |
| 400 | 0.8538 | 1.0459 | 0 | 0 | 0.03335 | 0 | 0.691 |
| 500 | 0.6824 | 1.0555 | 0 | 0 | 0.03984 | 0 | 0.684 |
| 600 | 0.5687 | 1.0756 | 0 | 0 | 0.0458Предлошка:Figure space | 0 | 0.686 |
| 700 | 0.4934 | 1.0969 | 0 | 0 | 0.05123 | 0 | 0.691 |
| 800 | 0.4277 | 1.1225 | 0 | 0 | 0.05609 | 0 | 0.7Предлошка:Figure spaceПредлошка:Figure space |
| 900 | 0.3796 | 1.1464 | 0 | 0 | 0.0607Предлошка:Figure space | 0 | 0.711 |
| 1000 | 0.3412 | 1.1677 | 0 | 0 | 0.06475 | 0 | 0.724 |
| 1100 | 0.3108 | 1.1857 | 0 | 0 | 0.0685Предлошка:Figure space | 0 | 0.736 |
| 1200 | 0.2851 | 1.2037 | 0 | 0 | 0.07184 | 0 | 0.748 |
| 1.300 | 0.2591 | 1.219Предлошка:Figure space | 0 | 0 | 0.081Предлошка:Figure spaceПредлошка:Figure space | 0 | 0.701 |
Изотопи

Азотот има два стабилни изотопи: 14N and 15N. Првиот е многу почест, сочинува 99,634% од природниот азот, а вториот (кој е малку потежок) ги сочинува останатите 0,366%. Ова води до атомска тежина од околу 14.007 u..[16] И двата од овие стабилни изотопи се произведуваат во Јаглеродно-азотно-кислородниот циклус во ѕвездите, но 14N е почест бидејќи неговото зафаќање на протон е чекор со ограничување на брзината. 14N е еден од петте стабилни непарни-непарни нуклиди (нуклид со непарен број на протони и неутрони); останатите четири се 2H, 6Li, 10B, и 180mTa.[17]
Релативното изобилство на 14N и 15N е практично постојано во атмосферата, но може да варира на друго место, поради природното изотопско фракционирање од биолошките редукциски реакции и испарувањето на природниот амонијак или азотна киселина.[18] Биолошки посредуваните реакции (на пример, асимилација, нитрификација и денитрификација) силно ја контролираат динамиката на азот во почвата. Овие реакции обично резултираат со 15N збогатување на подлогата и исцрпување на производот.[19]
Тешкиот изотоп 15N првпат бил откриен од С.М. Нуде во 1929 година, а набргу потоа биле откриени тешки изотопи на соседните елементи кислород и јаглерод.[20] Претставува еден од најниските топлински пресеци за зафаќање на неутрони од сите изотопи.[21] Често се користи во спектроскопијата на јадрена магнетна резонанца (ЈМР) за одредување на структурите на молекулите што содржат азот, поради неговото фракционо јадрено вртење од една половина, што нуди предности за ЈМР, како што е потесна ширина на линијата. 14N, иако и теоретски може да се користи, има целоброен јадрен спин од еден и на тој начин има четириполен момент што води до пошироки и помалку корисни спектри.[16] 15N ЈМР сепак има компликации кои не се среќаваат во почестите 1H и 13C ЈМР спектроскопија. Ниското природно изобилство од 15N (0,36%) значително ја намалува чувствителноста, проблем кој само се влошува со неговиот низок жиромагнетен однос (само 10,14% од 1H). Како резултат на тоа, односот сигнал-шум за 1H е околу 300 пати поголем од оној за 15N при иста јачина на магнетно поле.[22] Ова може донекаде да се ублажи со изотопско збогатување од 15N со хемиска размена или фракциона дестилација. 15N- соединенијата збогатени со N ја имаат предноста што во стандардни услови, тие не подлежат на хемиска размена на нивните азотни атоми со атмосферскиот азот, за разлика од соединенијата со означени изотопи на водород, јаглерод и кислород кои мора да се држат подалеку од атмосферата. Односот 15N:14N најчесто се користи во стабилна анализа на изотоп во областа на геохемијата, хидрологијата, палеоклиматологијата и палеокеанографијата, каде што се нарекува δ15N.[23]
Од тринаесетте други изотопи произведени синтетички, кои се движат од 9N to 23N, 13N има полуживот од десет минути, а останатите изотопи имаат полуживот помал од осум секунди.[24][25] Со оглед на разликата во полуживот, 13N е најважниот азотен радиоизотоп, кој е релативно долготраен за да се користи во позитронска емисиона томографија (ПЕТ), иако неговиот полуживот е сè уште краток и затоа мора да се произведе на местото на ПЕТ, на пример во циклотрон преку протонско бомбардирање на честички од 16O и продукт од 16N.[26]
Радиоизотопот 16N е доминантен радионуклид во течноста за ладење на водопритисочниот реактор или реакторите за врела вода за време на нормална работа. Се произведува од 16O (во вода) преку реакција (n,p), во која атомот 16O фаќа неутрон и исфрла протон. Има краток полуживот од околу 7,1 s, но неговото распаѓање назад до 16O произведува високо-енергетско гама-зрачење (5 до 7 MeV).[25][27] Поради ова, пристапот до примарната цевка на течноста за ладење во водопритисочниот реактор мора да биде ограничен за време на работата на реакторот. Тоа е чувствителен и непосреден показател за протекување од примарниот систем на течноста за ладење до секундарниот циклус на пареа и е основно средство за откривање на таквите истекувања.[27]

Remove ads
Својства
Атомски

Атомот на азот има седум електрони. Во основната состојба, тие се распоредени во електронска конфигурација1s2
2s2
2p1
x2p1
y2p1
z. Според тоа, постојат пет валентни електрони во орбиталите 2s и 2p, од кои три (p-електроните) се неспарени. Има една од највисоките електронегативности меѓу елементите (3,04 на Полинговата скала), надмината само со хлор (3,16), кислород (3,44) и флуор (3,98). (Лесните благородни гасови, хелиум, неон и аргон, веројатно би биле и поелектронегативни, а всушност се на Ален.) Следејќи ги периодичните трендови, неговиот ковалентен полупречник со една врска од 71 pm е помал од оние на борот (84 pm) и јаглерод (76 pm), додека е поголем од оние на кислородот (66 pm) и флуорот (57 часот). Нитридниот анјон, N3−, е многу поголем на 146 pm, слична на онаа на оксидот (O2−: 140 pm) и флуор (F−: 133 pm) анјони. [1] Првите три енергии на јонизација на азот се 1.402, 2.856, и 4.577 MJ·mol−1, а збирот на четвртиот и петтиот е 16,920. Поради овие многу високи бројки, азотот нема едноставна катјонска хемија. .[28] Недостатокот на радијални јазли во 2p подшколка е директно одговорен за многу од аномалните својства на првиот ред од p-блокот, особено во азот, кислород и флуор. Подобвивката 2p е многу мала и има многу сличен радиус со обвивката 2s, што ја олеснува орбиталната хибридизација. Исто така, резултира со многу големи електростатски сили на привлекување помеѓу јадрото и валентните електрони во 2s и 2p обвивките, што резултира со многу високи електронегативности. Хипервалентноста е речиси непозната во 2p елементите од истата причина, бидејќи високата електронегативност го отежнува малиот атом на азот да биде средишен атом во трицентрична четири-електронска врска богата со електрони бидејќи има тенденција силно да ги привлече електроните кон себе. Така, и покрај позицијата на азот на чело на групата 15 во периодниот систем, неговата хемија покажува огромни разлики од онаа на неговите потешки сродни соединенија како фосфор, арсен, антимон и бизмут.[29]
Азотот може корисно да се спореди со јаглеродот и кислородот како негови хоризонтални соседи, како и со неговите вертикални соседи во колоната на пниктогените, фосфорот, арсенот, антимонот и бизмутот. Иако секој елемент на периодниот систем 2 од литиум до кислород покажува некои сличности со периодот 3 во следната група (од магнезиум до хлор; овие се познати како дијагонални врски), нивниот степен нагло опаѓа покрај парот бор-силициум. Сличностите на азот со сулфур се претежно ограничени на соединенијата на прстенот на сулфур нитрид кога двата елементи се единствените присутни.
Азотот не ја дели склоноста на јаглеродот за катенација. Како јаглеродот, азотот има тенденција да формира јонски или метални соединенија со металите. Азотот формира широка серија нитриди со јаглерод, вклучувајќи ги и оние со структури слични на графит и фулерен..[30]
Наликува на кислород со неговата висока електронегативност и истовремена способност за водородно поврзување и способност да формира координациски комплекси со донирање на неговите осамени електронски парови. Постојат некои паралели помеѓу хемијата на амонијак NH3 и водата H2O. На пример, капацитетот на двете соединенија да се протонираат за да се добијат NH4+ and H3O+ или да се депротонираат за да се добијат NH2− and OH−, при што сите овие можат да се изолираат во цврсти соединенија.[31]
Алотропи
Атомскиот азот, познат и како активен азот, е многу реактивен, бидејќи е трирадикал со три неспарени електрони. Слободните азотни атоми лесно реагираат со повеќето елементи за да формираат нитриди, па дури и кога два атоми на слободен азот се судираат за да произведат молекула N2, тие може да ослободат толку многу енергија при судир дури и со такви стабилни молекули како јаглерод диоксид и вода предизвикувајќи хомолитичко делење во радикали како што се CO и O или нитрогенот електричен гас се подготвува преку атомски дистанцирање на нитроген и Н. 0,1-2 mmHg, кој произведува атомски азот заедно со праска-жолта емисија која полека згаснува како последен сјај неколку минути дури и по завршувањето на испуштањето.
Главно поради големата реактивност на атомскиот азот, елементарниот азот обично се јавува како молекуларен N2, динитроген. Оваа молекула е дијамагнетен гас без боја, мирис и вкус при стандардни услови: се топи на -210 °C и врие на −196 °C. Динитрогенот е главно нереактивен на собна температура, но сепак ќе реагира со литиум метал и некои комплекси на преодни метали. Ова се должи на неговата врска, која е единствена помеѓу двоатомските елементи во стандардни услови со тоа што има тројна врска N≡N. Тројните врски имаат кратки должини на врската (во овој случај, 109,76 pm) и високи енергии на дисоцијација (во овој случај, 945,41 kJ/mol), и затоа се многу силни, објаснувајќи го ниското ниво на хемиска реактивност на динитрогенот.[32]
Можни се и други азотни олигомери и полимери. Доколку би можеле да се синтетизираат, тие би можело да имаат потенцијална примена како материјали со многу висока енергетска густина, кои би можеле да се користат како моќни погони или експлозиви.[33] Под екстремно високи притисоци (1.1 милиони атм) и високи температури (2000 К), како што се произведува во дијамантска наковална ќелија, азотот полимеризира во едноврзаната кубна кристална структура. Оваа структура е слична на онаа на дијамантот, и двете имаат исклучително силни ковалентни врски, што резултира со неговиот прекар „азотен дијамант“.[34]

При атмосферски притисок, молекуларниот азот се кондензира (се втечнува) на 77 К (-195,79°C) и замрзнува на 63 К (-210.01 °C) [35] во бета хексагонална тесно спакувана кристална алотропна форма. Под 35,4 К (-237,6 °C) азотот ја зема кубната кристална алотропна форма (наречена алфа-фаза).[36] Течен азот, безбојна течност што наликува на вода по изглед, но со 80,8% од густината (густината на течниот азот во неговата точка на вриење е 0,808 g/mL), е вообичаен криоген.[37] Цврстиот азот има многу кристални модификации. Тој формира значителна динамична површинска покриеност на Плутон [38] и надворешните месечини на Сончевиот Систем како што е Тритон.[39] Дури и при ниски температури на цврстиот азот, тој е прилично испарлив и може да се сублимира за да формира атмосфера или да се кондензира назад во азотен мраз. Тој е многу слаб и тече во форма на ледници, а на Тритон гејзерите од азотен гас доаѓаат од областа на поларната ледена капа.[40]
Remove ads
Хемија и соединенија
Динитрогени комплекси

Првиот пример за откриен комплекс на динитроген бил [Ru(NH3)5(N2)] 2+ (види слика десно), а наскоро биле откриени и многу други такви комплекси. Овие комплекси, во кои азотната молекула донира барем еден пар електрони на средишниот метален катјон, илустрираат како N2 може да се поврзе со металот(ите) во нитрогеназата и катализаторот за Хаберовиот процес: овие процеси кои вклучуваат активирање на динитрогенот се од витално значење во биологијата и во производството на фертилиси.[41][42]
Динитрогенот може да се координира со металите на пет различни начини. Подобро карактеристичните начини се крајот на M←N≡N ( η1) и M←N≡N→ M ( μ, би- η1 ), во кои осамените парови на азотните атоми се донирани на металниот катјон. Помалку добро карактеризираните начини вклучуваат диатроген да донира електронски парови од тројната врска, или како премостувачки лиганд на два метални катјони (μ, би-η2 ) или само на еден (η2 ). Петтиот и единствен метод вклучува тројна координација како премостувачки лиганд, донирање на сите три електронски парови од тројната врска ( μ3 -N2). Неколку комплекси имаат повеќе N2 лиганди, а некои имаат N2 врзани на повеќе начини. Бидејќи N2 е изоелектронски со јаглерод моноксид (CO) и ацетилен (C2H2 ), врската во динитрогенските комплекси е тесно поврзана со онаа во карбонилните соединенија, иако N2 е послаб σ -донатор и π -акцептор од CO. Теоретските изучувања покажуваат дека донацијата σ е поважен фактор што овозможува формирање на врската M–N од п назад-донацијата, што главно само ја ослабува N–N врската, а донирањето од крај (η1) е полесно остварено од донирањето странично (η2).
Во денешно време, динитрогенските комплекси се познати по речиси сите преодни метали, кои сочинуваат неколку стотици соединенија. Тие обично се подготвуваат со три методи:
- Замена на лабилните лиганди како што се H2O, H− или CO директно со азот: ова се често реверзибилни реакции кои продолжуваат при благи услови.
- Намалување на металните комплекси во присуство на соодветен ко-лиганд во вишок под азотен гас. Вообичаен избор вклучува замена на хлоридните лиганди со диметилфенилфосфин (PMe2 Ph) за да се надомести помалиот број на азотни лиганди поврзани со оригиналните хлорни лиганди.
- Претворање на лиганд со N-N врски, како што се хидразин или азид, директно во динитроген лиганд.
Повремено, врската помеѓу N≡N може да се формира директно во метален комплекс, на пример со директно реагирање на координиран амонијак (NH3) со азотна киселина (HNO2), но тоа генерално не е применливо. Повеќето динитрогени комплекси имаат бои во опсегот бело-жолто-портокалово-црвено-кафеаво; познати се неколку исклучоци, како што е сината [{Ti(η5-C5H5)2}2 -(N2)].
Нитриди, азиди и нитридо комплекси
Азотот се поврзува со речиси сите елементи во периодниот систем, освен со првите два благородни гасови, хелиум и неон, и некои од многу краткотрајните елементи по бизмутот, создавајќи огромна разновидност на двојни соединенија кои имаат различни својства и употреби. Познати се многу двојни соединенија: со исклучок на азотните хидриди, оксиди и флуориди, тие обично се нарекуваат нитриди. Голем број на стехиометриски фази обично се присутни за повеќето елементи (на пр. MnN, Mn6N5, Mn3N2, Mn2N, Mn4N и MnxN за 9,2 < x < 25,3). Тие би можело да се класифицираат како „солидни“ (најчесто јонски), ковалентни, „како дијаманти“ и метални (или интерстицијални), иако оваа класификација има ограничувања кои генерално произлегуваат од континуитетот на типовите на поврзување наместо од дискретните и одделни типови што ги подразбира. Тие вообичаено се подготвуваат со директно реагирање на метал со азот или амонијак (понекогаш по загревањето), или со топлинско разложување на металните амиди:
- 3 Ca + N 2 → Ca3 N2
- 3 Mg + 2 NH3 → Mg 3 N 2 + 3 H 2 (на 900 °C)
- 3 Zn(NH2)2 → Zn3N2 + 4 NH3
Можни се многу варијанти на овие процеси. Најјонски од овие нитриди се оние на алкалните метали и земноалкалните метали, Li3N (Na, K, Rb и Cs не формираат стабилни нитриди поради стерични причини) и M3N2 (M = Be, Mg, Ca, Sr, Ba). Овие формално може да се сметаат како соли на N3- анјонот, иако раздвојувањето на полнежот всушност не е целосно дури и за овие високо електропозитивни елементи. Сепак, азидите на алкалните метали NaN3 и KN3, кои се карактеризираат со линеарна N−
3 анјон се добро познати, како и Sr(N3)2 и Ba(N3)2. Азидите од металите од Б-подгрупата (оние во групите од 11 до 16) се многу помалку јонски, имаат покомплицирани структури и лесно се детонираат кога ќе се шокираат.

Исто така се познати голем број на ковалентни двојни нитриди. Примерите вклучуваат цијаноген ((CN)2), трифосфор пентанитрид (P3N5), дисулфур динитрид (S2N2) и тетрасулфур тетранитрид (S4 N4). Суштински ковалентен силициум нитрид (Si3N4 ) и германиум нитрид (Ge3N4) се исто така познати: силициум нитрид, особено, би направил перспективна керамика доколку не е тешко да се работи со неа и да се синтерува. Особено, нитридите од групата 13, од кои повеќето се ветувачки полупроводници, се изоелектронски со графит, дијамант и силициум карбид и имаат слични структури: нивното поврзување се менува од ковалентно во делумно јонско во метално како што групата се спушта. Особено, бидејќи единицата B-N е изоелектронска до C-C, а јаглеродот е суштински со средна големина помеѓу борот и азот, голем дел од органската хемија наоѓа ехо во хемијата на бор-азот, како на пример во боразин („неоргански бензен“). Сепак, аналогијата не е веродостојна поради леснотијата на нуклеофилниот напад на бор поради неговиот недостаток во електрони, што не е можно во прстен кој целосно содржи јаглерод.
Најголемата категорија на нитриди се интерстицијалните нитриди со формулите MN, M2N и M4N (иако променливиот состав е совршено возможен), каде што малите азотни атоми се позиционирани во празнините во метална кубна решетка или хексагонална блиску спакувана решетка. Тие се непроѕирни, многу тврди и хемиски инертни, се топат единствено на многу високи температури (обично над 2500 °C). Тие имаат метален сјај и спроведуваат струја како и металите. Тие се хидролизираат единствено многу бавно за да дадат амонијак или азот.
Нитридниот анјон (N3−) е најсилниот π донатор познат меѓу лигандите (вториот најсилен е O2−). Нитридо комплексите генерално се создаваат со топлинско разложување на азиди или со депротонирање на амонијак, и тие обично вклучуваат терминална {≡N} 3- група. Линеарниот азиден анјон (N−
3), како изоелектронски со азотен оксид, јаглерод диоксид и цијанат, формира многу координациски комплекси. Понатамошното катенирање е ретко, иако N4−
4 (изоелектронски со карбонат и нитрат) е познато.
Хидриди

Индустриски, амонијакот (NH3) е најважното соединение на азот и се подготвува во поголеми количини од кое било друго соединение бидејќи значително придонесува за нутритивните потреби на копнените организми со тоа што служи како претходник на храната и вештачките ѓубрива. Тоа е безбоен алкален гас со карактеристичен лут мирис. Присуството на водородни врски има многу значајни ефекти врз амонијакот, што му дава висок степен на топење (-78 °C) и вриење (−33 °C). Како течност, тој е многу добар растворувач со висока топлина на испарување (што му овозможува да се користи во вакуумски колби), кој исто така има низок вискозитет и електрична спроводливост и висока диелектрична константа и е помалку густ од водата. Сепак, водородната врска во NH3 е послаба од онаа во H2O поради помалата електронегативност на азот во споредба со кислородот и присуството на само еден осамен пар во NH3 наместо два во H2O. Тоа е слаба база во воден раствор (pKb 4,74); нејзината конјугирана киселина е амониум, NH+
4. Може да делува и како екстремно слаба киселина, губејќи протон за да го произведе амидниот анјон, NH−
2 . Така, тој се подложува на само-дисоцијација, слично на водата, за да произведе амониум и амид. Амонијакот гори во воздухот или кислородот, иако не лесно, и произведува азотен гас; согорува во флуор со зеленикаво-жолт пламен за да добие азот трифлуорид. Реакциите со другите неметали се многу сложени и имаат тенденција да доведат до мешавина на производи. Амонијакот реагира при загревање со метали и дава нитриди.
Познати се многу други двојни азотни хидриди, но најважни се хидразин (N2H4) и водород азид (HN3). Иако не е азотен хидрид, хидроксиламинот (NH2OH) е сличен по својства и структура со амонијакот и хидразинот. Хидразин е испарувана, безбојна течност која мириса слично на амонијак. Нејзините физички својства се многу слични на оние на водата (точка на топење 2.0 °C, точка на вриење 113,5 °C, густина 1,00 g/cm3). И покрај тоа што е ендотермично соединение, тој е кинетички стабилен. Брзо и целосно гори во воздухот многу егзотермично за да даде азот и водена пареа. Тоа е многу корисно и разноврсно средство за намалување и е послаба основа од амонијакот. Исто така, најчесто се користи како ракетно гориво.[43]
Хидразинот генерално се добива со реакција на амонијак со алкален натриум хипохлорит во присуство на желатин или лепак:
- NH 3 + OCl − → NH 2 Cl + OH −
- NH 2 Cl + NH 3 → N2H+
5 + Cl − (бавно) - N2H+
5 + OH − → N 2 H 4 + H 2 O (брзо)
(Нападите од хидроксид и амонијак може да се поништат, па наместо тоа да се мине низ средно NHCl -) Причината за додавање на желатин е што ги отстранува металните јони како Cu2+ што го катализира уништувањето на хидразин со реакција со монохлорамин (NH2Cl) за производство на амониум хлорид и амониум хлорид.
Водород азид (HN3) за првпат бил произведен во 1890 година со оксидација на воден хидразин со азотна киселина. Тој е многу експлозивен, па дури и разредените раствори можат да бидат опасни. Има непријатен и иритирачки мирис и е потенцијално смртоносен (но не и кумулативен) отров. Може да се смета за конјугирана киселина на азидниот анјон и е слично аналогно на хидрохаличните киселини .
Халиди и оксохалиди

Познати се сите четири едноставни азотни трихалиди. Познати се неколку мешани халиди и хидрохалиди, но главно се нестабилни; примерите вклучуваат NClF2, NCl2F, NBrF2, NF2H, NFH2, NCl2H, and NClH2
Азот трифлуорид (NF3, првпат подготвен во 1928 година) е безбоен и без мирис гас кој е термодинамички стабилен и најлесно се произведува со електролиза на стопен амониум флуорид растворен во безводен водород флуорид. Како јаглерод тетрафлуорид, тој воопшто не е реактивен и е стабилен во вода или разредени водени киселини или алкалии. Единствено кога се загрева, делува како флуорирачки агенс и реагира со бакар, арсен, антимон и бизмут при контакт на високи температури за да се добие тетрафлуорохидразин (N2F4). Катјоните NF+
4 и N2F+
3 се исто така познати (последните од реакцијата на тетрафлуорохидразин со силни флуориди-акцептори како што е арсен пентафлуорид), како што е ONF3, што предизвикува интерес поради краткото растојание N-O што покажува делумно двојно поврзување и високо поларната и долгата N-F врска. Тетрафлуорохидразин, за разлика од самиот хидразин, може да се дисоцира на собна температура и повисока за да го даде радикалот NF2•. Флуор азидот (FN3) е многу експлозивен и топлински нестабилен. Динитроген дифлуорид (N2F2) постои како топлински интерконвертибилни цис и транс изомери, и првпат бил пронајден како производ на топлинско разложување на FN3.
Азот трихлорид (NCl3) е густа, испарлива и експлозивна течност чии физички својства се слични на оние на јаглеродниот тетрахлорид, иако единствена разлика е во тоа што NCl3 лесно се хидролизира со вода додека CCl4 не. За прв пат бил синтетизиран во 1811 година од Пјер Луј Дулонг, кој изгубил три прсти и око поради неговите експлозивни тенденции. Како разреден гас, тој е помалку опасен и затоа се користи индустриски за белење и стерилизирање на брашното. Азот трибромид (NBr3), првпат подготвен во 1975 година, е длабоко црвена, чувствителна на температура, испарлива цврста супстанца која е експлозивна дури и на -100 °C. Азотниот тријодид (NI3) е сè уште понестабилен и бил подготвен дури во 1990 година. Неговиот додаток со амонијак, кој бил познат порано, е многу чувствителен на шок: може да се активира со допир на пердув, поместување на воздушните струи или дури и алфа-честички.[44] Поради оваа причина, малите количини на азот тријодид понекогаш се синтетизираат како демонстрација за средношколците по хемија или како чин на „хемиска магија“.[45] Хлор азидот (ClN3) и бром азидот (BrN3) се исклучително чувствителни и експлозивни.[46][47]
Познати се две серии на азотни оксохалиди: нитросил халиди (XNO) и нитрил халиди (XNO2). Првата серија претставуваат многу реактивни гасови кои можат да се направат со директно халогенирање на азотен оксид. Нитросил флуорид (NOF) е безбојно и енергично флуорирачко средство. Нитросил хлоридот (NOCl) се однесува на ист начин и често се користи како јонизирачки растворувач. Нитросил бромид (NOBr) е црвен. Реакциите на нитрилхалидите се главно слични: нитрил флуорид (FNO2) и нитрил хлорид (ClNO2) се исто така реактивни гасови и енергични халогенирачки агенси.
Оксиди

Азотот формира девет молекуларни оксиди, од кои некои претставувале првите гасови кои биле идентификувани: N2O (азотен оксид), NO (азотен оксид), N2O3 (динитроген триоксид), NO2 (азот диоксид), N2O4 (динитроген тетрооксид), N2O5 (динитроген оксид), N4O (нитрозилазид), и N( NO2)3 (тринитрамид).[48] Сите тие се топлинско нестабилни кон распаѓање на нивните елементи. Еден друг можен оксид кој сè уште не е синтетизиран е оксатетразол (N4O), ароматичен прстен.[49]
Азотниот оксид (N2O), попознат како „гас за смеење“, се добива со топлинско разложување на стопениот амониум нитрат на 250 °C. Ова е оксидационо-редукциона реакција и на тој начин азотен оксид и азот исто така се произведуваат како споредни производи. Најчесто се користи како погонско средство и средство за конзервирана павлака, а порано најчесто се користел како анестетик. И покрај изгледот, не може да се смета дека е анхидрид на хипонитрозна киселина (H2N2O2) бидејќи таа киселина не се произведува со растворање на азотен оксид во вода. Тој е прилично нереактивен (не реагира со халогените, алкалните метали или озонот на собна температура, иако реактивноста се зголемува при загревањето) и има несиметрична структура N–N–O (N≡N+O− ↔ −N=N+ =O): над 600 °C се дисоцира со раскинување на послабата N–O врска. Азотниот оксид (NO) е наједноставната стабилна молекула со непарен број електрони. Кај цицачите, вклучително и луѓето, тој е важна клеточна сигнална молекула вклучена во многу физиолошки и патолошки процеси.[50] Се формира со каталитичка оксидација на амонијак. Тоа е безбоен парамагнетен гас кој, бидејќи е топлинско-динамички нестабилен, се распаѓа на азот и кислород на 1100-1200 °C. Нивната врска е слична на онаа кај азот, но еден дополнителен електрон се додава на орбиталата за антиврзување π* и на тој начин редоследот на врската е намален на приближно 2,5; оттука димеризацијата во O=N–N=O е неповолна, освен под точката на вриење (каде што cis изомерот е постабилен), бидејќи всушност не го зголемува вкупниот редослед на врската и затоа што неспарениот електрон е делокализиран низ молекулата на NO, давајќи му стабилност. Исто така, постојат докази за асиметричниот црвен O=N–O=N кога азотен оксид се кондензира со поларни молекули. Тој реагира со кислород добивајќи кафеав азот диоксид и со халогени добивајќи нитрозил халиди. Тој, исто така, реагира со соединенија на преодни метали добивајќи нитросил комплекси, од кои повеќето се длабоко обоени.[49]
Синиот дитроген триоксид (N2O3) е достапен единствено како цврста супстанца бидејќи брзо се дисоцира над неговата точка на топење добивајќи азотен оксид, азот диоксид (NO2) и динитроген тетрооксид (N2O4). Последните две соединенија се малку тешки за поединечно проучување поради рамнотежата меѓу нив, иако понекогаш дитроген тетрооксид може да реагира со хетеролитичко цепење до нитросониум и нитрат во средина со висока диелектрична константа. Азот диоксид е остар, корозивен кафеав гас. Двете соединенија може лесно да се подготват со разградување на сув метален нитрат. И двете соединенија реагираат со вода формирајќи азотна киселина. Динитроген тетрооксид е многу корисен за подготовка на безводни метални нитрати и нитрато комплекси, и тој станаува оксиданс за складирање на избор за многу ракети и во САД и во СССР до крајот на 1950-тите. Тоа е затоа што тоа е хиперголно гориво во комбинација со ракетно гориво базирано на хидразин и може лесно да се складира бидејќи е течно на собна температура.
Топлинско нестабилниот и многу реактивен дитроген пентооксид (N2O5) е анхидрид на азотна киселина и може да се направи од него со дехидрација со фосфор пентооксид. Се употребува при подготовка на експлозиви.[51] Тоа е деликатна, безбојна кристална цврстина која е чувствителна на светлина. Во цврста состојба е јонски поврзн со структура [NO2]+[NO3]−; како гас и во раствор е молекуларен O2N–O–NO2. Хидратацијата на азотна киселина доаѓа лесно, како и аналогната реакција со водород пероксид што дава пероксонитрична киселина (HOONO2). Тоа е силен оксидирачки агенс. Гасниот дитроген пентооксид се разградува на следниов начин:
- N2O5 ⇌ NO2 + NO3 → NO2 + O2 + NO
- N2O5 + NO ⇌ 3 NO2
Оксокиселини, оксоаниони и соли на оксокиселини
Познати се многу азотни оксо киселини, иако повеќето од нив се нестабилни како чисти соединенија и се познати единствено како водени раствори или како соли. Хипонитрозната киселина (H2N2O2) е слаба дипротична киселина со структура HON=NOH (pKa1 6.9, pKa2 11.6). Киселите раствори се доста стабилни, но над pH 4, катализирано со база се распаѓа преку [HONNO] - до азотен оксид и хидроксидниот анјон. Хипонитрити (вклучувајќи го N2O2−
2 анјон) се стабилни на редукционите агенси и почесто делуваат како самите редукциони агенси. Тие се среден чекор во оксидацијата на амонијакот во нитрит, што се јавува во азотниот циклус. Хипонитритот може да дејствува како премостувачки или хелатен бидентатен лиганд.
Азотната киселина (HNO2) не е позната како чисто соединение, но е честа компонента во гасовитата рамнотежа и е важен воден реагенс: неговите водени раствори може да се направат од закиселување на ладен воден нитритски (NO−
2) раствор, иако веќе на собна температура диспропорционалноста со нитратот и азотен оксид е значајна. Тоа е слаба киселина со pKa 3,35 на 18 °C. Тие може да бидат титриметриски анализирани со нивна оксидација до нитрат со перманганат. Тие лесно се редуцираат до азотен оксид и азотен оксид со сулфур диоксид, до хипонитрозна киселина со калај (II) и до амонијак со водород сулфид. Соли на хидразиниум N2H+
5 реагираат со азотна киселина произведувајќи азиди кои понатаму реагираат и даваат азотен оксид и азот. Натриум нитрит е благо отровен во концентрации над 100 mg/kg, но мали количини често се користат за лекување на месо и како конзерванс за да се избегне бактериско расипување. Исто така се користи за синтеза на хидроксиламин и за дијазотис на примарните ароматични амини како што следува:
- ArNH2 + HNO2 → [ArNN]Cl + 2 H2O
Нитритот е исто така вообичаен лиганд кој би можело да биде координиран на пет начини. Најчести се нитро (врзани од азот) и нитрито (врзани од кислород). Нитро-нитрито изомеризмот е вообичаен, каде формата на нитрито вообичаено е помалку стабилна.

Азотната киселина (HNO3) е убедливо најважната и најстабилната од азотните оксокиселини. Таа е една од трите најупотребувани киселини (другите две се сулфурна киселина и хлороводородна киселина) и за прв пат била откриена од алхемичарите во текот на 13 век. Се добива со каталитичка оксидација на амонијак во азотен оксид, кој се оксидира до азот диоксид, а потоа се раствора во вода добивајќи се концентрирана азотна киселина. Во Соединетите Американски Држави, секоја година се произведуваат над седум милиони тони азотна киселина, од кои најголемиот дел се користат за производство на нитрати за ѓубрива и експлозиви, меѓу другите намени. Безводна азотна киселина може да се направи со дестилирање на концентрирана азотна киселина со фосфор пентооксид при низок притисок во стаклена апаратура во темница. Може да се направи единствено во цврста состојба, бидејќи при топење спонтано се распаѓа до азот диоксид, а течната азотна киселина се подложува на самојонизација во поголема мера од која било друга ковалентна течност како што следува:
- 2 HNO3 ⇌ H2NO+
3 + NO−
3 ⇌ H2O + [NO2] + + [NO3] −
Познати се два хидрата, HNO3·H2O и HNO3·3H 2 O, кои можат да се кристализираат. Тоа е силна киселина и концентрираните раствори се силни оксидирачки агенси, иако златото, платината, родиумот и иридиумот се имуни на напад. Мешавина 3:1 од концентрирана хлороводородна киселина и азотна киселина, наречена аква регија (царска вода), е сè уште посилна и успешно ги раствора златото и платината, бидејќи се формираат слободниот хлор и нитрозил хлорид и хлоридните анјони можат да формираат силни комплекси. Во концентрирана сулфурна киселина, азотна киселина се протонира формирајќи нитрониум, кој може да дејствува како електрофил за ароматична нитрација:
- HNO3 + 2 H2SO4 ⇌ NO+
2 + H3O + + 2 HSO−
4
Топлинската стабилност на нитратите (вклучувајќи го тригоналното рамно NO−
3 анјон) зависи од базичноста на металот, а исто така и производите на распаѓање (термолиза), кои може да варираат помеѓу нитритот (на пример, натриум), оксидот (калиум и олово), па дури и самиот метал (сребро) во зависност од нивната релативна стабилност. Нитратот е исто така вообичаен лиганд со многу начини на координација.
Иако ортонитричната киселина (H3NO4), која би била аналогна на ортофосфорната киселина, не постои, тетраедричниот ортонитратен анјон NO3−
4 е познат во неговите соли на натриум и калиум:
Треба да се напомене дека овие бели кристални соли се многу чувствителни на водена пареа и јаглерод диоксид во воздухот:
- Na3 NO4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3
И покрај неговата ограничена хемија, тој е интересен од структурна гледна точка поради неговата правилна тетраедрална форма и кратките должини на врската N-O, што имплицира значителен поларен карактер на поврзувањето.
Органски азотни соединенија
Азотот е еден од најважните елементи во органската хемија. Многу органски функционални групи вклучуваат јаглеродно-азотна врска, како што се амиди (RCONR2), амини ( R3N ), имини (RC(=NR)R), имиди (RCO) 2 NR, азиди (RN3), азосоединенија ( RN2R), цијанати ( ROCN), изоцијати (RNCO), нитрати (RCN), изонитрили (RNC), нитрити (RONO), нитро соединенија (RNO2), нитрозо-соединенија (RNO), оксими (RC(=NOH)R) и деривати на пиридин. C-N врските се силно поларизирани кон азот. Во овие соединенија, азотот е обично тривалентен (иако може да биде четиривалентен во кватернарните амониумски соли, R4N+), со осамен пар кој може да му даде базичност на соединението координирајќи се со протон. Ова може да се компензира со други фактори: на пример, амидите не се основни бидејќи осамениот пар е делокализиран во двојна врска (иако тие можат да дејствуваат како бази при многу ниска pH вредност, протонирани на кислород), а пиролот не е основен бидејќи осамениот пар е делокализиран како дел од ароматичен прстен.[52] Количеството на азот во хемиската супстанција може да се определи со Келдаловиот метод .[53] Особено, азотот е суштинска компонента на нуклеинските киселини, аминокиселините, а со тоа и протеините, и молекулата што носи енергија аденозин трифосфат и затоа е витален за целиот живот на Земјата.
Remove ads
Појава
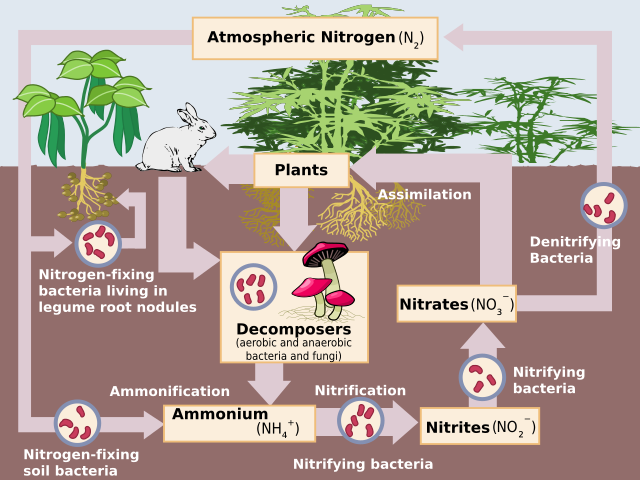
Азотот е најчестиот чист елемент во земјата, сочинувајќи 78,1% од волуменот на атмосферата (75,5% по маса), околу 3,89 милиони гигатони (3.890.000.000.000.000.000 ). И покрај ова, тој не е многу застапен во Земјината кора, сочинувајќи некаде околу 19 делови на милион, на исто ниво со ниобиум, галиум и литиум. (Ова претставува од 300.000 до еден милион гигатони азот, во зависност од масата на кората.[54]) Единствените важни азотни минерали се нитра ( калиум нитрат, шелетра) и сода нитра ( натриум нитрат, чилеанска солена руда). Сепак, тие не се важен извор на нитрати од 1920-тите, кога индустриската синтеза на амонијак и азотна киселина станала вообичаена.
Азотните соединенија постојано се разменуваат помеѓу атмосферата и живите организми. Азотот најпрвин мора да се преработи, или „врзи“, во форма што може да се користи за растенијата, обично амонијак. Дел од азотното врзување се врши со удари кои произведуваат азотни оксиди, но повеќето се прават од дијазотрофни бактерии преку ензими познати како азитрогенази (иако денес индустриското поврзување на азот во амонијак е исто така значајна). Кога амонијакот го земаат растенијата, тој се употребува за синтеза на протеини. Овие растенија потоа се вари од животните кои ги користат азотните соединенија за да ги синтетизираат нивните протеини и да излачуваат отпад што носи азот. На крај, овие организми умираат и се распаѓаат, подложени на бактериска и еколошка оксидација и денитрификација, враќајќи го слободниот динитроген во атмосферата. Индустриското поврзување на азот преку Хаберовиот процес најчесто се користи како ѓубриво, иако вишокот отпад што содржи азот, кога ќе се исцеди, доведува до еутрофикација на слатката вода и создавање на морски мртви региони, бидејќи бактерискиот раст поттикнат од азот го осиромашува кислородот на водата до тој степен што сите повисоки организми умираат. Понатаму, азотен оксид, кој се произведува при денитрификација, ја напаѓа атмосферската озонска обвивка.
Голем дел од морските риби произведуваат големи количини на триметиламин оксид за да ги заштитат од високите осмотски ефекти на нивната околина; конверзијата на ова соединение во диметиламин е одговорна за раниот мирис кај несвежата морска риба.[55] Кај животните, слободниот радикален азотен оксид (добиен од аминокиселина) служи како важна регулаторна молекула за циркулација.[56]
Брзата реакција на азотен оксид со вода кај животните резултира со производство на неговиот метаболит нитрит. Животинскиот метаболизам на азот во протеините, генерално, резултира со излачување на уреа, додека животинскиот метаболизам на нуклеинските киселини резултира со излачување на уреа и мочна киселина. Карактеристичниот мирис на распаѓањето на животинското месо е предизвикан од создавањето на амини со долг синџир, кои содржат азот, како што се путресцин и кадаверин, кои се продукти на распаѓање на аминокиселините орнитин и лизин, соодветно, во протеините кои се распаѓаат.[57]
Remove ads
Производство
Азотниот гас претставува индустриски гас произведен со фракционална дестилација на течен воздух, или со механички средства со употреба на гасовит воздух (осмотска мембрана под притисок или атсорпција со промена на притисокот). Генераторите на азотен гас кои користат мембрани или атсорпција со нишање на притисок (PSA) обично се поекономични и енергетски поефикасни од азотот кој се испорачува на големо.[58] Комерцијалниот азот често е нуспроизвод на преработка на воздухот за индустриска концентрација на кислород за производство на челик и други цели. Кога се испорачува компримиран во цилиндри, често се нарекува OFN (азот без кислород).[59] Азот од комерцијална класа веќе содржи најмногу 20 ppm кислород и специјално прочистени оценки кои содржат најмногу 2 ppm кислород и 10 ppm аргон се достапни.
Во хемиска лабораторија, тој се подготвува со третирање на воден раствор на амониум хлорид со натриум нитрит.[60]
- NH4 Cl + NaNO2 → N2 + NaCl + 2H2O
Во оваа реакција се формираат и мали количини на нечистотии NO и HNO3. Нечистотиите може да се отстранат со поминување на гасот низ водена сулфурна киселина која содржи калиум дихромат.
Може да се добие и со топлинско разложување на амониум дихромат.[61]
- 3(NH4)2 Cr2O7 → 2N2 + 9H2 O + 3Cr2O3 + 2NH3 + 32O2
Многу чист азот може да се подготви со топлинско разложување на бариум азид или натриум азид.[62]
- 2 NaN3 → 2 Na + 3 N2
Remove ads
Употреба
Употребата на азотни соединенија се природно екстремно широко разновидни поради огромната големина на оваа класа: оттука, овде ќе се разгледуваат единствено употребите на самиот чист азот. Две третини (2/3) од азот произведен од индустријата се продава како гас, а преостанатата една третина (1/3) како течност.
Гас
Гасот најчесто се употреува како безбедна атмосфера со ниска реактивност секаде каде што кислородот во воздухот би претставувал пожар, експлозија или опасност од оксидација. Некои примери вклучуваат:
- Како модифицирана атмосфера, чиста или измешана со јаглерод диоксид, за нитрогенизација и зачувување на свежината на пакуваната или наголемата храна (со одложување на ранцидноста и другите форми на оксидативно оштетување). Чистиот азот како додаток на храна е означен во Европската Унија со Е-бројот E941.[63]
- Во жарулки како евтина алтернатива на аргон.[64]
- Во системи за сузбивање пожар за опрема за информатичка технологија (ИТ) .
- Во производството на нерѓосувачки челик.[65]
- Во хемиско-топлинска обработка на метали со нитридирање.[66]
- Во некои системи за гориво на авиони за да се намали опасноста од пожар
- За надувување на гумите за тркачки автомобили и авиони,[67] со што се намалуваат проблемите со неконзистентно ширење и контракција предизвикани од влага и кислород во природниот воздух.
Азотот најчесто се употребува за време на подготовката на примерокот при хемиска анализа. Се користи за концентрирање и намалување на волуменот на течните примероци. Насочувањето на протокот на азотен гас под притисок нормално на површината на течноста предизвикува растворувачот да испарува додека зад себе ги остава растворената супстанца и неиспарениот растворувач.[68]
Азотот може да се користи како замена, или во комбинација со, јаглерод диоксид за притисок на бурињата на некои пива, особено темните и британските пива, поради помалите меурчиња што ги произведува, што го прави пивото помазно.[69] Азотната капсула чувствителна на притисок попозната како „ виџет“ овозможува пивата наполнети со азот да се пакуваат во лименки и шишиња.[70][71] Резервоарите со азот исто така го заменуваат јаглеродниот диоксид како главен извор на енергија за пејнтбол пиштоли. Азотот мора да се чува на поголем притисок од CO2, што ги прави резервоарите N2 потешки и поскапи.
Опрема
Дел од градежната опрема користи азотен гас под притисок за да му помогне на хидрауличниот систем да обезбеди дополнителна енергија на уредите како што е хидрауличниот чекан. Азотниот гас, формиран од распаѓањето на натриум азид, се користи за надувување на воздушните перничиња.
Погубување
Бидејќи азот сам по себе е гас за асфиксија, некои јурисдикции го разгледале задушувањето односно извршувањето на смртната казна со вдишување чист азот како средство за смртна казна (како замена за смртоносна инекција).[72][73][74] Во јануари 2024 година, Кенет Смит станал првиот човек погубен со асфиксија со азот.[75]
Течност
Течниот азот е криогена течност која личи на вода. Кога е изолиран во соодветни контејнери, како што се термоси, може да се пренесе и складира со мала стапка на губење на испарувањето.[76]

Како сувиот мраз, главната употреба на течниот азот е за ладење на ниски температури. Се користи за криопрезервација на биолошки материјали како што се крвта и репродуктивните клетки (сперма и јајце клетки). Се користи во криотерапија за отстранување на цисти и брадавици на кожата со нивно замрзнување.[77] Се користи во лабораториски ладни стапици и во криопумпи за да се добијат помали притисоци во системи со вакуум пумпа. Се користи за ладење на електроника чувствителна на топлина, како што се инфрацрвени детектори и детектори на Х-зраци. Други употреби вклучуваат материјали за мелење и обработка со замрзнување кои се меки или гумени на собна температура, склопување на инженерски компоненти и поопшто за постигнување на многу ниски температури каде што е потребно. Поради неговата ниска цена, течниот азот често се користи за ладење дури и кога таквите ниски температури не се строго неопходни, како што се ладење на храната, замрзнување на добитокот, замрзнување на цевките за да се запре протокот кога не се присутни вентили и консолидирање на нестабилна почва со замрзнување секогаш кога се врши ископ одоздола.
Remove ads
Безбедност
Гас
Иако азотот не е отровен, кога се ослободува во затворен простор може да го измести кислородот и затоа претставува опасност од задушување. Ова може да се случи со неколку предупредувачки симптоми, бидејќи човечкото каротидно тело е релативно слабо и претставува бавен систем за чувствителност на ниско ниво на кислород (хипоксија).[78] Еден пример се случил непосредно пред лансирањето на првата мисија на Спејс шатлот на 19 март 1981 година, кога двајца техничари починале од задушување откако влегле во просторот кој се наоѓал во мобилната платформа за исфрлување на вселенското летало кој пак бил под притисок со чист азот како мерка на претпазливост од пожар.[79]
Кога се вдишува при високи делумни притисоци (повеќе од околу 4 бари, се среќаваат на длабочини под околу 30 m во нуркање), азотот е анестетик, предизвикувајќи азотна наркоза, привремена состојба на ментално оштетување слична на интоксикација со азотен оксид.[80][81]
Азотот се раствора во крвта и телесните масти. Брзата декомпресија (кога нуркачите се искачуваат пребрзо или астронаутите пребрзо се декомпресираат од притисокот во кабината до притисокот на вселенскиот костум) може да доведе до потенцијално фатална состојба наречена декомпресирачка болест (порано позната како кесонова болест), кога се формираат азотни меури во крвотокот, нервите, зглобовите или другите чувствителни региони.[82][83] Меурчиња од други „внатрешни“ гасови (гасови освен јаглерод диоксид и кислород) ги предизвикуваат истите ефекти, така што замената на азот во дишните гасови може да спречи азотна наркоза, но не ја спречува болеста на декомпресија.[84]
Течност
Како криогена течност, течниот азот може да биде опасен со предизвикување ладни изгореници при контакт, иако Лајденфростовиот ефект обезбедува заштита за многу кратко изложување (околу една секунда)..[85] Голтање течен азот може да предизвика сериозно внатрешно оштетување. На пример, во 2012 година, на една млада жена во Англија морало да и биде отстранет желудникот откако проголтала коктел направен со течен азот.[86]
Бидејќи експанзициониот сооднос течност-гас на азот е 1:694 на 20 °C, може да се генерира огромна количина на сила доколку течниот азот брзо се испарува во затворен простор. Во инцидент на 12 јануари 2006 година, на Универзитетот А&М во Тексас, уредите за намалување на притисокот на резервоарот со течен азот не функционирале и подоцна биле запечатени. Како резултат на последователното зголемување на притисокот, резервоарот катастрофално откажал. Силата на експлозијата била доволна за да го придвижи резервоарот низ таванот веднаш над него, да ја скрши армирано-бетонската греда веднаш под него и да ги разнесе ѕидовите на лабораторијата 0,1–0,2 m од нивните темели.[87]
Течниот азот лесно испарува за да формира гасовит азот, па оттука и мерките на претпазливост поврзани со гасовитиот азот се применуваат и за течниот азот.[88][89][90] На пример, сензорите за кислород понекогаш се користат како безбедносна мерка на претпазливост при работа со течен азот за да ги предупредат работниците за излевање на гас во затворен простор.[91]
Садовите што содржат течен азот можат да го кондензираат кислородот од воздухот. Течноста во таков сад се повеќе се збогатува со кислород (точка на вриење е -183 °C, повисока од онаа на азот) бидејќи азотот испарува и може да предизвика насилна оксидација на органскиот материјал.[92]
Remove ads
Галерија
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {\mathrm {NaNO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow[{300{\vphantom {A}}^{\circ }\mathrm {C} ~\mathrm {for} ~7\,\mathrm {days} }]{\mathrm {Ag} ~\mathrm {crucible} }} {}\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{4}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ec729bc88f520e08fdce8a013dec8ae601d28509)