தைட்டானியம்
From Wikipedia, the free encyclopedia
Remove ads
தைட்டானியம் அல்லது டைட்டேனியம் (ஆங்கிலம்:Titanium, (IPA: /tʌɪˈteɪniəm/) என்னும் வேதிப்பொருள் தனிம அட்டவணையில் அணுவெண் 22 கொண்ட, Ti என்னும் குறியீடு கொண்ட தனிமம். இது வெள்ளி போன்ற வெண்மையான பளப்பளப்பான பிறழ்வரிசை மாழை. இது அதிக கனம் இலாத, வலுவான, அரிப்பெதிர்ப்பு (அதிகம் வேதியியல் அரிப்புகள் உறாமல்) உள்ள திண்மம். குளோரின் மற்றும் கடலில் உள்ள உப்புநீர் போன்றவற்றிலிருந்தும் அதிகம் அரிப்புறாப் பொருள். பூமியில் அதிக அளவில் கிடைக்கும் தனிமங்களின் வரிசையில் இது 9 வது இடத்தைப் பெறுகிறது.[2] செம்பு , துத்தநாகம், ஈயம், தங்கம், வெள்ளி, பிளாட்டினம், மாலிப்பிடினம், டங்க்ஸ்டன், நிக்கல், டின் (வெள்ளீயம் ) இவற்றை விட பூமியின் புறவோட்டில் தைட்டானியம் அதிகமாகக் கிடைக்கிறது.[3][4] அதைப் பிரித்தெடுக்கும் கடிய வழிமுறைகளினால் அது இன்றைக்கும் ஓர் அரிய உலோகமாகவே கருதப்படுகிறது . தைட்டானியம் அதிக அளவில் ஆஸ்திரேலியாவிலும் அடுத்தபடியாக அமெரிக்கா, இந்தியா, பிரேசில் போன்ற நாடுகளிலும் கிடைக்கிறது.[3][5][6]
Remove ads
வரலாறு

1791 ல் இங்கிலாந்து நாட்டின் மத போதகரான கிரேகோர் வில்லியம் கிரிகோர் (William Gregor) என்னும் ஆங்கிலேயர் 1791இல் கண்டுபிடித்தார்.[7] இவர் அந்நாட்டின் மெனாக்சின்(Menaccin) கணவாய்ப் பகுதியிலிருந்து கிடைத்த ஒரு வகையான கருப்பு மணலை பகுத்தாராய்ந்து அதில் ஒரு புதிய தனிமம் இருப்பதை அறிவித்தார். இப் புதிய தனிமத்திற்கு மெனாக்சின்[7] என்றும் கனிமத்திற்கு மெனாக்கொனைட்டு என்றும் பெயர் சூட்டினார்.[2] இன்றைக்கு அக் கனிமத்தை இல்மனைட்டு (ilmanite) என்றும் தனிமத்தை தைட்டானியம் என்றும் அழைக்கின்றார்கள்.[8] மார்ட்டின் கலாப்ரோத்து என்ற இடாய்ச்சுலாந்திய (செருமன்) வேதியியல் அறிஞர் 1795 ல் அங்கேரி நாட்டிலிருந்து பெற்ற (உ)ரூட்டைல் என்ற கனிமத்திலிருந்து டைட்டானியத்தைப் பிரித்தெடுத்தார்.[7] தைட்டான் என்பது பூமியைக் குறிப்பிடும் காயியா (Gaea) என்ற கடவுளின் மகனாகும். இப்பொருள் வலிமையாக இருப்பதால், கிரேக்கத் தொல்கதைகளில் வரும் வலிமை மிக்க டைட்டன் என்பதன் அடிப்படையில் தைட்டானியம் எனப் பெயர் சூட்டினார்.[9] சில ஆண்டுகளுக்குப் பிறகே கலாப்ரோத்தும் கிரேகோரும் கண்டுபிடித்தது ஒரே தனிமம் எனத் தெரிய வந்தது. 1895 ல் பிரான்சு நாட்டின் வேதியியல் அறிஞர் என்றி மோய்சன் மின்வில் உலை (arc furnace) மூலம் தைட்டானியம் ஆக்சைடை ஐதரசனால் ஆக்சிசனிறக்கம் செய்து ஏறக்குறைய தூய தைடானியத்தைப் பெற்றார்.
இயல்பியல் பண்புகள்
இதன் வேதியியல் குறியீடு Ti ,அணுவெண் 22 ,அணு எடை 47.9 அடர்த்தி 4540 கிகி /கமீ,உருகு நிலையும் கொதி நிலையும் முறையே 1953 K(1679,85 °C) ,3573 K(3299,85 °C) ஆகும். தைட்டானியம் மிகச் சொற்ப அளவு தூய்மையற்று இருந்தாலும் அது உடைந்து நொறுங்கிப் பட்டறைப் பயன்களுக்கு உபயோகமாய் இருப்பதில்லை. தூய தைட்டானியம் குறைந்த அடர்த்தியும் மிகுந்த வலிமையையும் கொண்ட[3] பளபளப்பான வெண்ணிற மாழையாகும் (உலோகமாகும்).[8][10] தைட்டானியத்தின் இரண்டு வேற்றுருக்களும் ஐந்து ஓரிடத்தான்களும் அறியப்பட்டுள்ளது.[11]
தைட்டானியம் குறிபிட்ட எடைக்குத் தரும் வலு அதிகமான பொருள்.[11] எடை குறைவாகவும், அடர்த்தி குறைவாகவும், வலிமை அதிகமாகவும் உள்ள மாழை [12][13] இது பிறதனிமங்களோடு ஒப்பிடும்பொழுது, அதிக வெப்பநிலையில் உருகும் பொருளாகும். இதன் உருகு வெப்பநிலை(1922,15 K) 1,649 °C or 3,000 °F க்கும் அதிகம்.[3] இதனால் தைட்டானியம் வெப்பம் அதிகம் உள்ள இடங்களில் பயன்படுத்தும் சுட்டாங்கல் மாழைப் (refractory metal) பொருளாகப் பயன்படுகின்றது.
விற்பனைத்தொழில் சந்தையில் கிடைக்கும் 99.2% தூய்மை கொண்ட டைட்டேனியத்தின் இறுதி நீட்சி வலு (tensile strength) 63,000 சதுர அங்குலத்திற்கான பவுண்டு (psi) ஆகும் - இது எஃகுக் கலவைகளுக்கான நீட்சி வலுவுக்கு ஈடானது, ஆனால் 45% எடை குறைவானது.[14] தைட்டானியம் அலுமினியத்தை விட 60% கனமானது ஆனால் அலுமினியத்தை விட 2 பங்குக்கும் கூடிய வலிமை கொண்டது.[15]
Remove ads
வேதிப்பண்புகள்
உயர் வெப்பநிலையிலும் தைட்டானியம் ஆக்சைடு நிலைப்புத் தன்மை மிக்கதாக இருக்கும் (உருகு நிலை 1800 C ). மெதுவாக வேதி வினைகளில் ஈடுபடுவதற்குக் காரணம் நான்கு இணைதிறன் கொண்ட தைட்டானியம் அயனி இரண்டு இணைதிறன் கொண்ட ஆக்சிசனுடன் வலுவான பிணைப்பை ஏற்படுத்திக் கொள்வதுதான்.
தைட்டானியம் ஆக்சைடு அடர் கந்தகக் காடி, அடர் ஐதரோகுளோரிக் காடி, காரக் கரைசல்கள், கரிமக் கரைப்பான்களில் கரைவதில்லை. ஆனால் தைட்டானியம் மென் அரிப்பு மூலங்களை மட்டுமே எதிர்க்கிறது. அலுமினியம் போல ஒரு ஆக்சைடு படலத்தை காற்று வெளியில் ஏற்படுத்திக் கொள்வதே இதன் காரணம் பூமியை விடச் சந்திரனில் தைட்டானியம் ஆக்சைடு அதிகமாய் உள்ளது. உயர் வெப்ப நிலையில் தைட்டானியம், ஆக்சிசன், நைட்ரசன், குளோரின் மற்றும் பிற மாழையிலிகளுடன் (அலோகங்களுடன்) வினையாற்றுகிறது. நீர்த்த காடிகளில் கூட கரைந்து விடுகிறது
Remove ads
சேர்மங்கள்
தைட்டானியம் +4 என்ற ஆக்சிசனேற்ற நிலையில் ஆதிக்கம் செலுத்துகிறது [16]. எனினும் +3 என்ற ஆக்சிசனேற்ற நிலையிலும் சேர்மங்கள் காணப்படுகின்றன [17]. பொதுவாக தைட்டானியத்தின் அணைவுச் சேர்மங்கள் எண்முக ஒருங்கிணைப்பு வடிவத்தை ஏற்கின்றன. ஆனால் விதிவிலக்காக நான்முக TiCl4 அதனுடைய உயர் ஆக்சிசனேற்ற நிலை காரணமாக குறிப்பிடத்தக்கதாக உள்ளது. தைட்டானியம்(IV) சேர்மங்கள் சகப்பிணைப்பு கொண்ட சேர்மங்களாகக் காணப்படுகின்றன. பிற இடைநிலை தனிமங்கள் போல இல்லாமல் தைட்டானியத்திற்கு எளிய அக்குவா Ti(IV) அணைவுகள் அறியப்படுகின்றன.
ஆக்சைடுகள்
தைட்டானியத்தின் ஆக்சைடுகளில் முக்கியமானது TiO2 ஆகும். அனாடேசு, புரூக்கைட்டு, ரூட்டைல் என்ற மூன்று பல்லுருத் தோற்றங்களில் இது காணப்படுகிறது. இம் மூன்று வகைகளும் வெண்மை நிறத்துடன் அபரகாந்தத் தன்மை கொண்டவையாக உள்ளன. என்றாலும் கனிம மாதிரிகள் அடர் நிறத்தில் காணப்படுகின்றன. மேலும் இவை பல்பகுதிய கட்டமைப்பை ஏற்கின்றன. இதில் தைட்டானியம் வேறு தைட்டானியம் மையத்துடன் இணைக்கப்பட்ட ஆறு ஆக்சைடு ஈனிகளால் சூழப்பட்டுள்ளது. தைட்டானியம்(IV) சேர்மங்கள் பொதுவாக தைட்டனேட்டுகள் எனப்படுகின்றன. உதாரணமாக பேரியம் தைட்டனேட்டைக் குறிப்பிடலாம். இது பெரோவ்சிகைட்டு கட்டமைப்புடன் காணப்படுகிறது. மின் அழுத்தப் பண்புகளை வெளிப்படுத்துகிறது. ஒலியியல் மற்றும் மின்னியல் இடையிலான மாற்றத்திற்கு ஓர் ஆற்றல் மாற்றியாக இதைப் பயன்படுத்துகிறார்கள். பல கனிமங்கள் தைட்டனேட்டுகளாக உள்ளன. இல்மனைட்டு (FeTiO3), பெரோவ்சிகைட்டு என்பன இதற்கு உதாரணங்களாகும். விண்மீன் தோற்ற நீல மாணிக்கமும், மாணிக்கமும் அவற்றிற்கான பிரகாச ஒளியை அவற்றில் இடம்பெற்றுள்ள தைட்டானியம் டை ஆக்சைடு மாசுக்களில் இருந்தே பெறுகின்றன.
தைட்டானியத்தின் பல்வேறு வகையான ஒடுக்கப்பட்ட ஆக்சைடுகளும் அறியப்படுகின்றன. Ti(IV)-Ti(III) இனமாக விவரிக்கப்படும் Ti3O5 ஊதாநிற குறைக் கடத்தியாகும். TiO2 சேர்மத்துடன் ஐதரசன் வாயுவை உயர் வெப்பநிலைகளில் சேர்க்கும் போது Ti3O5 உருவாகிறது. எங்கெல்லாம் ஆவிப்படிவாக தைட்டானியம் டை ஆக்சைடு பூச்சு தேவைப்படுகிறதோ அத்தொழிற்சாலைகளில் இதைப் பயன்படுத்துகிறார்கள். இது தூய்மையான தைட்டானியம் ஆக்சைடாக ஆவியாகிறது. அதேநேரத்தில் TiO2 ஆக்சைடுகளின் கலவையாக ஆவியாகிறது. இதன் மேற்பூச்சுகள் வெவ்வேறு ஒளிவிலகல் எண்களுடன் காணப்படுகின்றன [18]. குருந்தம் கட்டமைப்புடன் TiO2 சேர்மமும், பாறை உப்பு கட்டமைப்பில் TiO சேர்மமும் பெரும்பாலும் விகிதவியல் அளவுகளின்றி காணப்படுவதையும் அறியமுடிகிறது [19].
ஆல்காக்சைடுகள்
தைட்டானியம்(IV) இன் ஆல்காக்சைடுகள் TiCl4உடன் ஆல்ககால்கள் சேர்த்து தயாரிக்கப்படுகின்றன. இவை நிறமற்ற சேர்மங்களாகும். இவற்றை நீருடன் வினைபுரியச் செய்தால் டையாக்சைடாக மாற்றலாம். திண்மநிலை TiO2 சேர்மத்தை சோல்-கெல் செயல்முறை வழியாக படியச்செய்ய இவை பெரிதும் பயனுள்ளதாக உள்ளன. சமச்சீர் கரிமச் சேர்மங்களை உற்பத்தி செய்ய தைட்டானியம் ஐசோபுரோப்பாக்சைடு பயன்படுகிறது.
சல்பைடுகள்
தைட்டானியம் பல்வேறு சல்பைடுகளாக உருவாகிறது ஆனால் TiS2 மட்டுமே கவனத்தை ஈர்ப்பதாக உள்ளது. அடுக்குக் கட்டமைப்பில் காணப்படும் இது இலித்தியம் மின்கலன்களில் எதிர்மின் வாயாகப் பயன்படுகின்றன. ஏனெனில் Ti(IV) ஒரு கடின நேர்மின் அயனி என்பதால் தைட்டானியத்தின் சல்பைடுகள் நிலைப்புத் தன்மை இல்லாமல் இருக்கின்றன. ஆக்சைடாக நீராற்பகுப்பு அடைந்து ஐதரசன் சல்பைடை விடுவிக்கின்றன.
Remove ads
நைட்ரைடுகள்
வெப்பமிழக்காத இடைநிலை உலோக நைட்ரைடுகள் குடும்பத்தில் தைட்டானியம் நைட்ரைடும் (TiN) ஒரு உறுப்பினராகும். வெப்பவியல் நிலைத்தன்மை, கடினத்தன்மை, வெப்பக் கடத்தல், மிக்கடத்தல், உயர் உருகுநிலை உள்ளிட்ட இரண்டு தனிமங்களின் ஒரேமாதிரியான சகப்பிணைப்பு பண்புகளையும் இவை வெளிப்படுத்துகின்றன [20].
பயன்கள்

டைட்டானியத்திலிருந்து பெறப்படும் தைட்டானியம் ஆக்சைடு வெள்ளை நிறமியாகும். இது ஈய வெள்ளையைக் காட்டிலும் சிறப்பானது. நச்சுத் தன்மை கொண்டதில்லை. கடல் நீரினால் ஏற்படும் உலோக அரிப்பை தைட்டானியம் பூச்சு தவிர்க்கிறது. இது தோல் மற்றும் துணிகளுக்குச் சாய மிடுதலிலும், கண்ணாடி, பீங்கான், செயற்கை ரத்தினங்கள் (போலி) இவற்றின் உற்பத்தி முறையிலும் பயன்படுகிறது. பற்பசையில் இருந்து, வீட்டுச் சுவர், மற்றும் மேசை நாற்காலி போன்றவற்றுக்குப் பூசும் நிறச்சாயம்[8] முதல், வெள்ளைத்தாள், நெகிழி போன்ற பல பொருட்களுக்குப் பயன்படும் வெண்ணிற நிறமியாகப் பயன்படுகின்றது.[21]

தைட்டானியம், இரும்பு, அலுமினியம், வனேடியம், மாலிப்டினம் போன்ற பிற மாழைகளுடன் சேர்ந்து கனம் குறைந்த ஆனால் வலுவான மாழைக்கலவைகள் உண்டாக்கப் பயன்படுகின்றது. இவை வானூர்தி, விண்கலங்கள் போன்ற துறைகளிலும், படைத்துறை (இராணுவம்), மற்றும் பல்வேறு தொழிலங்களில் பயன்படும் செய்முறைவினைகளுக்குப் பயன்படுகின்றது.[3]
(ஐதரோ-கார்பன் தொழிற்சாலைகளில்), உப்புநீக்குநன்னீர் ஆலைகளிலும், மரக்கூழ் தாள் உற்பத்தி ஆலைகளிலும் (வெண்ணிறம் தர தைட்டானியம் ஆக்ஸைடு), தானுந்து உற்பத்தித் தொழிலகங்களிலும், மருத்துவத்தில் செயற்கை இடுப்பு, கை-கால் துணைக்கருவிகளிலும், வேளாண்மைத் துறைகளிலும், பல்மருத்துவத்தில் புதுப்பல் புதைநிறுவல்களிலும் பயன்படுகின்றது.[3][7]
தைட்டானியம் கலந்த எஃகு தற்போது உயர் தொழில்நுட்ப விமானங்கள், போர் விமானங்கள், ஏவுகணைகள், விண்வெளி ஓடங்கள், மருத்துவ அறுவை சிகிச்சைக் கருவிகள்,[7] மின் சாதனங்கள் மற்றும் பல உயர் தொழில் நுட்ப சாதனங்களில் பயன்படுத்தப்படுகிறது.[4][8][23] அரிமானத்தை எதிர்க்கும் ஆற்றல் உள்ளதால் கடல் நீரைக் குடிநீராக மாற்றப் பயன்படுத்தப்படும் சாதனங்களிலும் இந்த உலோகக் கலவை பயன்படுத்தப்படுகிறது.[24]
தைட்டானியம் டை ஆக்சைடு பெரும்பாலும் வண்ணங்கள் தயாரிக்கப் பயன்படுத்தப்படுகிறது.[8] வெண்மை நிறத்தில் மாவுபோல் இருக்கும் தைட்டானியம் டை ஆக்சைடு நிறமியிலிருந்து தயாரிக்கப்படும் வர்ணப்பூச்சுகள் தரமானவை. சிறந்த ஒளிர்தன்மை, நிறைந்த உழைக்கும் திறம், தூய வெண்மை நிறம், ஒளியை உள்ளே புகவிடா தன்மை இவையெல்லாம் தைட்டானியம் - டை - ஆக்சைடு நிறமிக்கு உரித்தானவை. இரப்பர் தொழில், நெகிழி (பிளாஸ்டிக்கு) தொழில், தோல் மற்றும் துணி உற்பத்தி, அழகு சாதனத் தயாரிப்பு மற்றும் காகித ஆலைகளில் பயன்படுத்தப்படுகின்றன.[25]
சிர்கோனியா மற்றும் இசுட்ரான்சியம் தைட்டானேட்டு போலி வைரங்கள் தயாரிக்கப் பயன்படுகின்றன. இசுட்ரான்சியம் தைட்டானேட்டின் ஒளி பகுப்புத் திறன் அதிகமாக இருப்பதால் பட்டை தீட்டப் பட்ட இசுட்ரான்சியம் தைட்டானேட்டு அதிகமாக ஒளிர்கின்றது.
தைட்டானியம் தெட்ரா குளோரைடு அடர்த்தியான புகையை உண்டாக்கி காட்சியை மறைக்கின்றது. இது கலவரக் கூட்டத்தைக் கலைக்க அல்லது அது முன்னேற முடியாமல் தடுக்கப் பயன்படுகிறது.
தைட்டானியம், ஆக்சிசனுடன் தீவிரமாக வினை புரிவதால் இப்பண்பை இரும்பு ஆக்சைடிலிருந்து ஆக்சிசனை அகற்றப் பயன்படுத்திக் கொள்ளகின்றார்கள். இப் பண்புடைய சிலிக்கானை விட தைட்டானியம் 10 மடங்கு மேலானது. எஃகை வளிம வெளியேற்றத்திற்கு (degassing) உட்படுத்தினால் அதன் அரிமான எதிர்ப்பு அதிகரிப்பதுடன் பட்டறைப் பயன்படும் மேம்படுகின்றது. தைட்டானியம் அலுமினியத்தைவிட 12 மடங்கும் இரும்பை விட 4 மடங்கும் கடினத் தன்மை மிக்கது. இதனால் தைட்டானியத்தால் செய்யப்பட்ட இயந்திர உறுப்புகள் அதிகம் தேய்மானத்திற்கு ஆளாவதில்லை.
தைட்டானியம் மின்சாரத்தைக் கடத்துவதில்லை என்பதால் மின் காப்புச் சாதனங்கள் மற்றும் பீங்கான் பொருட்கள் தயாரிக்கப் பயன்படுகின்றது. அலுமினியத்தைப் போல வெப்பங் கடத்தாததால் உயர் வேகத்தில் விமானம் பறக்கும் போது உராய்வினால் உண்டாகும் வெப்பம் உட்பகுதிகளுக்குக் கடத்தப்படுவதில்லை. ஒலியின் வேகத்தையும் விஞ்சிய வேகத்தில் இயங்கும் விமானங்களைக் கட்டமைக்க தைட்டானியம் துணை நிற்கிறது . விண்வெளிப் பயணம் டைட்டானியத்தின் துணையின்றி பெரிதாக வளர்ந்து விட முடியாது. தைட்டானியத்தால் ஆன கலங்கள் நீர்ம எரிமங்களான நீர்ம ஐதரசன், நீர்ம ஆக்சிசன் போன்றவற்றைப் பாதுகாப்பாக வைத்துக் கொள்கிறது. மிகத் தாழ்ந்த வெப்ப நிலையில் தைட்டானியம் சிதைவதில்லை. மாறாகத் தன் வலிமையை அதிகரித்துக் கொள்கிறது. இதனால் பீற்று வளி விமானங்கள் (Jet), ஏவூர்திகளின் கட்டமைப்பில் தைட்டானியம் பங்கேற்றுள்ளது.
வெற்றிட வெளியில் டைட்டானியத்தை எளிதாக வெட்டவும், பற்றவைத்துப் பிணைக்கவும் முடிகிறது டைட்டானியமும் நிக்கலும் சேர்ந்து உருவாக்கப் பட்ட ஒரு கலப்பு உலோகம் நிட்டினால் (Nitinol ) ஆகும். இது தன் பழைய உருவத் தோற்றத்தை நினைவில் வைத்துக் கொள்ளும் தன்மை கொண்டது. உருவமாற்றத்திற்கு உட்பட்ட பின்பு, மீண்டும் பழைய தோற்றத்தை அதே சூழலில் இருக்கும் நிலையில் அடையப் பெறுகிறது. இதை நினைவு உலோகம் (memory metal ) அல்லது வடிவம் மறவா உலோகம் (shape memory metal ) என்பர். 1962 -ல் வில்லியம் ஜெ.பக்லர் என்ற அமெரிக்கப் பொறிஞரால் இது கண்டு பிடிக்கப்பட்டது. இப்பண்பு தொழில் நுட்பத் துறைகளில் பல புதிய பயன்களைத் தந்துள்ளது.
மின் கடத்தப் பொருட்களில் வலிமை குறைந்த புற மின் புலத்தில் மின் முனைவாக்கத் தூண்டலைப் பெறுவதுடன் அதைப் புற மின் புலம் நீங்கிய நிலையிலும் தக்க வைத்துக் கொள்கிறது. இம் முனைவாக்கம் (Polarization ) வெப்ப நிலையைச் சார்ந்திருக்கிறது என்பதால் வெப்ப நிலை மாற்றங்கள் முனைவாக்கத்தில் மாற்றங்களை ஏற்படுத்துகின்றது. இதை வெப்ப மின் முனைவாக்க விளைவு (Pyro electeric effect ) என்பர். இவ் விளைவை ஏற்படுத்தும் படிகங்களை வெப்ப முனைவாகுப் படிகம் என்றும், பெரோ மின் படிகம் என்றும் கூறுவர். இவற்றில் செறிவு மிக்க புற மின் புலத்தைத் தோற்றுவித்து இரு மின் முனைகளின் முனைவாகுத் திசையை 180 பாகை கூடத் திருப்பலாம். பேரியம் தைட்டானேட்(BaTiO3 ) இத் தன்மையது. இவை வெப்ப ஆற்றலை மின் ஆற்றலாக மாற்றும் மாற்றிகளில் பயன்படுகின்றன.
தைட்டானியக் கலப்புள்ள வேறு சில படிகங்களும் -லித்தியம் சிர்க்கோனியம் தைட்டனேட்டு, கால்சியம் பேரியம் தைட்டனேட்டு போன்றவைகளும்- இரும்பிய (பெரோ) மின் படிகங்களாகும்(Ferro electric crystals) இப்படிகங்கள் அமுக்க-மின் விளைவுக்கு (piezo electric effect )உட்படுகின்றன. இப் படிகங்களில் ஒரு திசை அச்சு வழியாக அழுத்தம் கொடுக்க ,அதற்குச் செங்குத்தான வேறொரு திசை அச்சு வழியில் குறுக்கிடும் பக்கப் பரப்பில் மின்னூட்டம் செறிவுறுகின்றன. இதன் மறுதலையாக ஒரு திசை அச்சு வழியாக மாறு மின் புலம் செயல்படுமாறு செய்ய அதற்குச் செங்குத்தான வேறொரு திசை அச்சு வழியில் குறுக்கிடும் பக்கங்கள் அதிர்வுக்குள்ளாகின்றன. இந்த அதிர்வு கேளா ஒளியை (ultasonic) எழுப்புகின்றன என்பதால் பேரியம் தைட்டனேட்டு கேளா ஒலி உற்பத்தி செய்யும் கருவிகளில் பயன் படுகின்றது.
Remove ads
படிமங்கள்
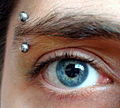
- A titanium body piercing.
- Characteristic weld beads on a handmade titanium bicycle frame.
- The குகென்ஹெயிம் அருங்காட்சியகம் is sheathed in titanium panels.
- A titanium spork useful for backpackers. About 16 grams, lighter than a steel utensil but stronger than a plastic implement.
- A fracture of the eye socket was repaired by stabilizing the fractured bones with small titanium plates and screws.
உசாத்துணை
- Barksdale, Jelks (1968). "Titanium". In Clifford A. Hampel (editor) (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 732–738. LCCN 68-29938.
{{cite book}}:|editor=has generic name (help)CS1 maint: ref duplicates default (link) - Emsley, John (2001). "Titanium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ISBN 0-19-850340-7.
{{cite book}}: CS1 maint: ref duplicates default (link) - Flower, Harvey M. (2000). "Materials Science: A moving oxygen story". Nature 407 (6802): 305–306. doi:10.1038/35030266. பப்மெட்:11014169.
- Greenwood, N. N. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}: Unknown parameter|coauthors=ignored (help)CS1 maint: ref duplicates default (link)
Remove ads
மேற்கோள்களும் குறிப்புகளும்
புற இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads